制备并初步评价KGDS靶向活化血小板纳米钆对比剂
郭惠庄,罗文峰,余盛龙,李 莉,陈汉威
(广州市番禺区中心医院医学影像研究所,广东 广州 511400)
动脉粥样硬化血栓形成指在动脉粥样硬化缓慢发展过程中斑块突然破裂引起急性血栓形成,可能导致严重后果,如急性冠脉综合征、短暂性脑缺血发作和卒中。据统计,约每3例死亡事件中,即有1例死于动脉粥样硬化血栓形成[1]。分子影像学技术是近年来发展迅猛,与传统影像学技术相比,能于组织和细胞水平反映疾病的病理过程,动态显示动脉粥样硬化斑块结构及成分变化,并可用于判断预防和治疗效果。动脉粥样硬化发生发展中,血小板是血栓形成的关键,不仅与脉管血栓闭塞终点事件相关,也与斑块发展的早期阶段存在密切关联。对聚集或黏附血小板进行成像,可更好地显示粥样硬化斑块破裂形成血栓[2-4]。铁蛋白分子在生物体内普遍存在,具有纳米级球形空腔及很好的生物相容性,非常适于作为药物载体[5]。本实验尝试以去铁铁蛋白为载体,将MR对比剂装载于其内部,在其表面连接具有靶向活化血小板功能的赖氨酸-甘氨酸-天冬氨酸-丝氨酸(Lys-Gly-Asp-Ser, KGDS)多肽,制备靶向活化血小板表面受体GPⅡb/Ⅲa的MR纳米对比剂(Gd-Afn-KGDS),并初步观察其体外靶向能力。
1 材料与方法
1.1 材料与试剂 去铁铁蛋白(Apoferritin,Sigma),异硫氰酸酯(FITC,Sigma),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,Sigma),N-羟基琥珀酰亚胺(NHS,Sigma),KGDS多肽(Abbiotec),二磷酸腺苷(ADP,Sigma),透析袋(截留分子量:8000~14000,源叶)。
1.2 仪器与设备 马尔文粒径分析仪(Malvern,Zetasizer Nano S90,英国),透射电子显微镜(FEI,Tecnai G2 F20,美国),荧光显微镜(Leica,DMi8-M,德国),蛋白定量仪(Thermo Fisher,NanoDrop 2000,美国),原子吸收光谱仪(Thermo Fisher,ICE 3500,美国);Siemens, MAGNETOM Avanto MR仪(德国);酶标仪(Bio-Rad,i-Mark,美国)。
1.3 实验方法
1.3.1 制备与纯化Gd-Afn-KGDS 取5 mg/ml去铁铁蛋白,用1 mol/L盐酸调节pH值为2,室温孵育15 min;称量0.093 8 g Gd-DOPA并缓慢加入上述溶液,待其完全溶解后用1 mol/L NaOH调节pH值为7.4,室温搅拌2 h后,4 000 rpm离心5 min除去白色沉淀,以磷酸盐缓冲液(phosphate buffer solution, PBS)(pH 7.4)透析24 h,得到Gd-Afn溶液,4℃保存备用[6]。
取1 mg KGDS粉末溶于0.5 ml的PBS,加入22 mg EDC和12 mg NHS搅拌活化90 min,在活化好的KGDS溶液中缓慢滴入Gd-Afn溶液2 ml,冰水浴搅拌反应过夜。将所得溶液装入透析袋,用PBS(pH 7.4)透析24 h,最后过0.22 μm孔径的滤膜,制得Gd-Afn-KGDS,4℃保存备用。
取Gd-Afn溶液和Gd-Afn-KGDS溶液各2 ml,分别加入黑色避光EP管中,向每管内加入0.2 mg FITC,避光孵育12 h。将所得溶液装入透析袋,用PBS(pH 7.4)避光透析24 h,得到FITC标记的Gd-Afn溶液(Gd-Afn-FITC )和FITC标记的Gd-Afn-KGDS溶液(Gd-Afn-KGDS-FITC),4℃避光保存备用。
1.3.2 Gd-Afn-KGDS特性表征 以透射电镜观察Gd-Afn-KGDS的纳米结构及分布,马尔文粒径分析仪检测Gd-Afn-KGDS的粒径大小及分布;将Gd-Afn-KGDS用于体外MR成像,并分析其T1增强效果。
1.3.3 测试Gd-Afn-KGDS细胞毒性 取对数生长期的脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC,由广东省脐带血库提供),以胰酶消化后重悬计数,调节细胞密度至8.0×104/ml。取96孔培养板,每孔加入100 μl细胞悬浮液,在37℃、5% CO2培养箱中孵育过夜,加入不同浓度Gd-Afn-KGDS溶液,在6、12 h时间节点取出96孔板,弃培养液,并以无菌PBS小心冲洗数次,每孔加入100 μl的新鲜培养液,并加入10 μl细胞计数试剂盒(cell counting kit-8, CCK-8)溶液,置于37℃、5% CO2培养箱中孵育4 h。用酶标仪测定450 nm处吸光度(OD)值[7],按下列公式计算细胞相对增殖率(relative growth rate, RGR):RGR(%)=(OD实验组-OD空白组)/OD对照组×100% 。
1.3.4 检测Gd-Afn-KGDS血小板靶向能力 取6周龄(300±20)g雄性SD大鼠新鲜抗凝血液(购于广东省医学实验动物中学),抗凝剂与血液比例为1∶9,800 rpm离心5 min,取上层血浆,以3 000 rpm离心10 min,弃上清,加入生理盐水以3 000 rpm离心洗涤3次留沉淀。于37℃下静置30 min,分离纯化后得到血小板溶液。所有操作均在室温下进行,pH 7.4。
实验组:取100 μl血小板溶液,加入20 μl ADP活化血小板,同时加入120 μl Gd-Afn-KGDS-FITC,避光孵育5 min,之后在荧光显微镜下观察活化血小板与Gd-Afn-KGDS的结合情况。对照组为Gd-Afn-FITC与未经活化的血小板共孵育5 min[8]。
1.3.5 观察Gd-Afn-KGDS体外血栓靶向能力 取6周龄(300±20)g雄性SD大鼠(购于广东省医学实验动物中学)新鲜血液100 μl,自然状态下形成凝血块,将凝血块转移至生理盐水中,实验组加入100 μl Gd-Afn-KGDS-FITC,对照组加入Gd-Afn-FITC,避光孵育5 min,之后用生理盐水冲洗3遍,在荧光显微镜下观察体外血栓与Gd-Afn-KGDS-FITC和Gd-Afn-FITC结合情况。
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料用±s表示,以t检验比较其差异;计数资料用百分比表示,以单因素方差分析比较其差异。P<0.05为差异有统计学意义。
2 结果
2.1 Gd-Afn-KGDS基本特性 所制Gd-Afn-KGDS为无色透明状溶液,透射电镜下呈球形,结构完整,粒径均一,为10~15 nm,Gd螯合物被包裹在铁蛋白空腔内。经动态光散射粒径分析仪检测,纳米颗粒水合粒径为(11.0±1.2)nm。T1WI显示,随Gd-Afn-KGDS溶液浓度增加,T1信号逐渐增强,Gd-Afn-KGDS T1增强信号强度与同等浓度钆喷酸葡胺无明显差异(t=0.387,P=0.835);分别利用电感耦合等离子体(inductively coupled plasma, ICP)和BCA蛋白定量试剂盒检测所制Gd-Afn-KGDS中Gd浓度和去铁铁蛋白浓度,换算得出单位体积中Gd含量和去铁铁蛋白含量,最终通过二者比值计算得出每个去铁铁蛋白包载Gd原子个数平均值为17.07(即包封率=17.07个钆/去铁铁蛋白)。见图1。
2.2 Gd-Afn-KGDS的细胞毒性 不同浓度Gd-Afn-KGDS与HUVEC共培养48 h后,HUVEC的RGR均在>85%,当Gd-Afn-KGDS浓度<200 μg/ml时,HUVEC的 RGR>95%,Gd-Afn-KGDS对细胞毒性评价分级为1级,无细胞毒性,生物相容性良好。见图2。
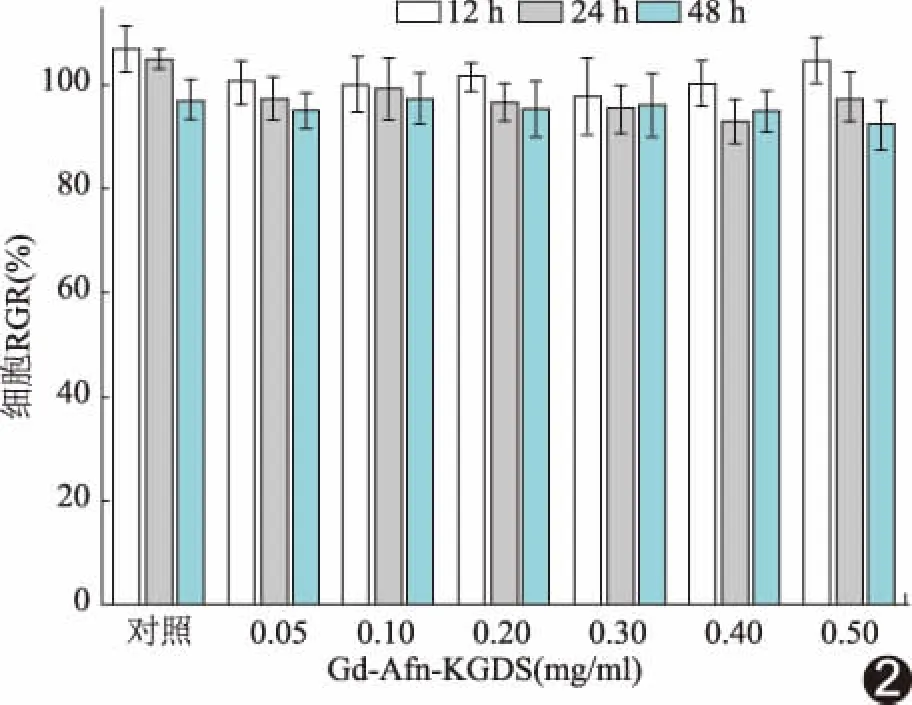
图2 Gd-Afn-KGDS对HUVEC的细胞毒性图
2.3 Gd-Afn-KGDS血小板靶向能力 白光条件下,实验组和对照组均未出现荧光;实验组绝大多数血小板经活化后发生团聚形成微小斑块,而对照组血小板形态正常、分散均匀,团聚率低。488 nm激光激发下,实验组可见大量绿色荧光集中于活化血小板聚集而成的微小斑块上;对照组可见部分微弱荧光点,为制备过程中少量血小板被活化而团聚形成的微小斑块。见图3。
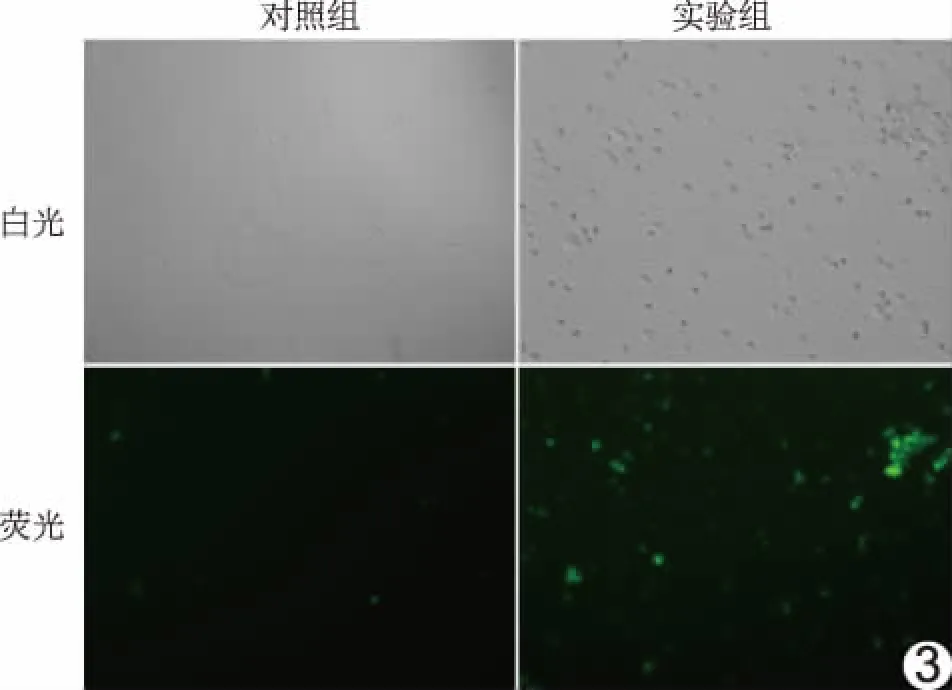
图3 Gd-Afn-KGDS特异性靶向活化血小板能力显微成像图
2.4 Gd-Afn-KGDS体外血栓靶向能力 荧光显微镜下,实验组可见凝血块发出强烈荧光信号,范围与凝血块形态基本一致;对照组凝血块未见明显荧光信号。见图4。
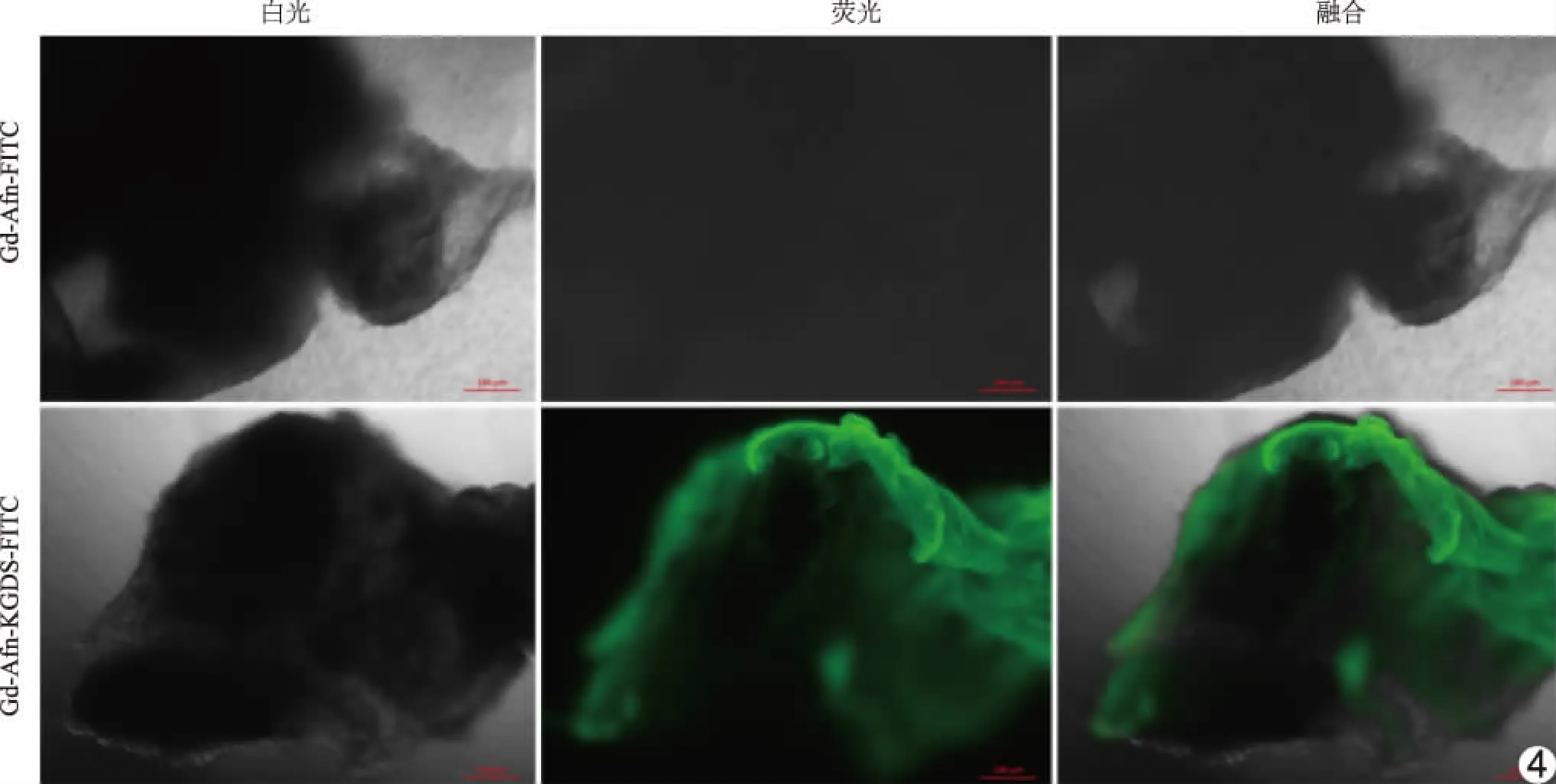
图4 Gd-Afn-KGDS体外特异性靶向血栓模型能力分析图
3 讨论
动脉粥样硬化斑块血栓形成对人类健康的严重危害日益凸显,但迄今仍缺乏能够客观量化评价血栓的指标,使现有诊疗措施带有很大盲目性。目前影像学主要通过间接方法检测血栓,并不能直接检测血块。利用分子影像学方法,可特异性以血栓为靶向,于存在粥样硬化斑块处检测血凝块。正常血液循环中,血小板处于静息状态;血管内皮损伤或粥样斑块破裂时,血小板由静息状态转化为活化状态,此为血栓发生、发展
的中心环节。对活化血小板进行成像是诊断早期血栓形成的有效途径。GPⅡb/Ⅲa是活化血小板特异分子靶点,而KGDS能特异性结合GPⅡb/Ⅲa;设想通过该受体可实现靶向显像活化血小板。
本研究成功制备出特异性靶向活化血小板表面受体GPⅡb/Ⅲa的MR纳米对比剂Gd-Afn-KGDS,呈球形结构,粒径(11.0±1.2)nm,粒径均一,与去铁铁蛋白无明显差异。体外T1WI显示,随Gd-Afn-KGDS溶液浓度增加,T1WI信号逐渐增强,且其信号增强程度与同等浓度钆喷酸葡胺无明显差异。进一步细胞实验表明,Gd-Afn-KGDS无细胞毒性,生物相容性良好,且能特异性与活化血小板结合。
本研究利用Gd-Afn-KGDS实现了体外靶向显像活化血小板,俟其成功用于临床,将有利于提高对早期血栓的诊断能力。后续研究将致力于证实Gd-Afn-KGDS对活化血小板的体内靶向性,并监测其靶向显像效果;在纳米载体内进一步包裹溶栓药物,赋予其溶栓特性,从而构建诊疗一体化的纳米药物体系,实现通过分子成像实时了解治疗过程药物分布及吸收情况。

