腮腺米库利兹病CT表现
王安然,李泉江,黄钟馨,谷金铭,彭 娟,罗天友,吕发金
(重庆医科大学附属第一医院放射科,重庆 400016)
米库利兹病(Mikulicz disease, MD)以腮腺、下颌下腺和泪腺特发性无痛性肿胀为特征,既往将其归为IgG4相关性疾病(immunoglobulin G4-related disease, IgG4-RD)[1],临床相对少见,有关其影像学表现相关研究报道较少。本研究回顾性分析腮腺MD的CT表现,旨在观察其CT特征,以提高临床对本病的认识及诊疗水平。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月—2019年12月于重庆医科大学附属第一医院手术病理证实的14例腮腺MD患者,男3例,女11例,年龄21~75岁,平均(51.9±18.0)岁;病程10天~4年。14例均因腮腺区肿块就诊,10例表现为无痛性肿块、4例伴不同程度疼痛;8例局部病灶有缓慢增大趋势,2例伴口干症状,查体腮腺区触及包块,质稍硬,1例邻近皮肤大量色素沉着。
1.2 仪器与方法 采用GE LightSpeed 64/128排螺旋CT行CT检查,扫描范围自颅底至胸廓入口,管电压120 kV、管电流180 mA,层厚5 mm,间距5 mm,矩阵512×512,FOV 22 cm×22 cm。完成平扫后,以流率3~4 ml/s注射对比剂碘海醇(300 mgI/ml)1.5 ml/kg体质量,跟注30 ml生理盐水,行三期增强扫描,分别延迟35、60、120 s采集动脉期、静脉期及平衡期图像。
由2名具有5年以上头颈部影像诊断经验的主治医师阅读图像,意见不一致时经协商决定。以下颌后静脉与胸锁乳突肌的内侧为界,将腮腺分为深叶和浅叶,观察病灶部位、数目、大小、边界、密度、强化程度和方式,同时观察颈部淋巴结是否肿大(淋巴结短径>1 cm为淋巴结肿大)。根据增强后肿瘤实性部分CT值增加值评估强化程度:增加值<20 HU为轻度强化,20 HU≤增加值<40 HU为中度强化,增加值≥40 HU为明显强化。记录术后病理结果。
2 结果
2.1 CT表现 14例腮腺MD中,6例为单侧腮腺单发结节,均位于浅叶,呈圆形或椭圆形,最大径0.40~2.30 cm;7例为多发病灶,其中3例为单侧多发、4例为双侧多发结节,呈椭圆形分布于浅叶或深叶,最大径0.21~2.72 cm;1例双侧腮腺弥漫性肿大,内见多发小结节,最大径0.22~2.17 cm,累及浅叶和深叶。12例病灶边界模糊,其中1例病灶与周围组织粘连;2例边界较清晰。10例等密度结节病灶密度均匀,增强后中度均匀强化或明显持续强化(图1、2),其中8例于静脉期、2例于延迟期达到强化峰值;3例病灶伴囊变,其中1例为单囊直径1.73 cm(图3),增强后环形明显强化,于静脉期达到强化峰值,另外2例为多发小囊变,直径0.12~0.83 cm(图4、5),囊壁及分隔菲薄光滑,增强后中度强化,并于静脉期达到强化峰值;1例病灶伴多发小囊变及“砂砾样”钙化(图6),囊变直径0.24~1.31 cm,增强后腮腺整体持续强化,其内小结节强化更明显。14例腮腺邻近皮肤未见增厚,皮下脂肪间隙显示清晰,颈部未见肿大淋巴结。
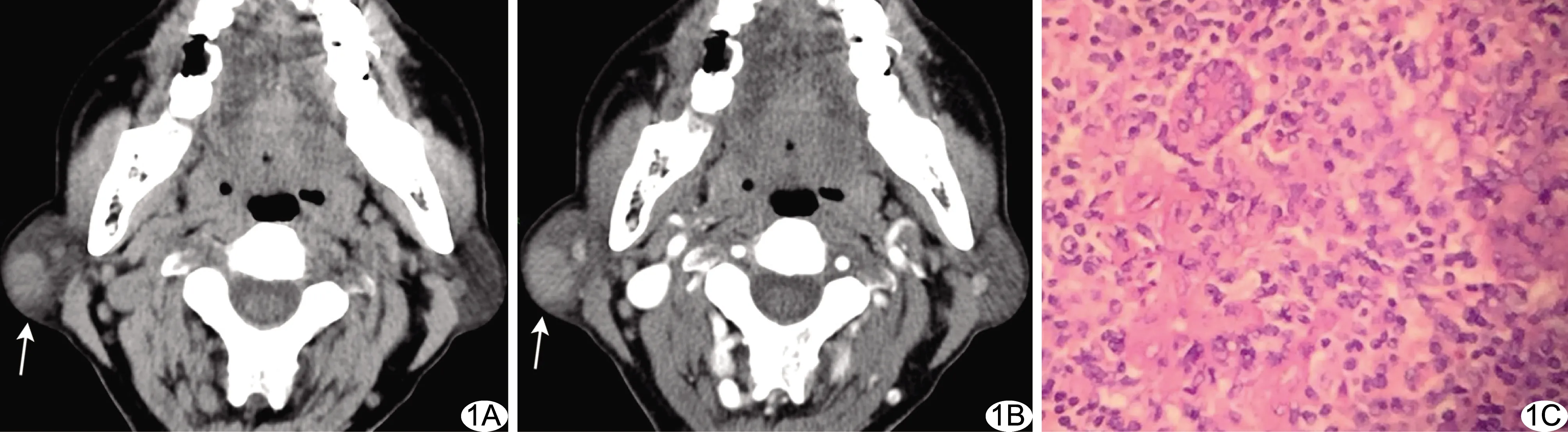
图1 患者男,21岁,右侧腮腺单发MD A、B.CT平扫(A)及增强图像(B)示右侧腮腺单发结节(箭),密度均匀,边界欠清,增强后病灶持续性中度强化; C.病理图(HE,×400)示涎腺小叶内腺泡萎缩或消失,被淋巴细胞和组织细胞替代,小叶内导管上皮、肌上皮增生,部分形成实性上皮团块
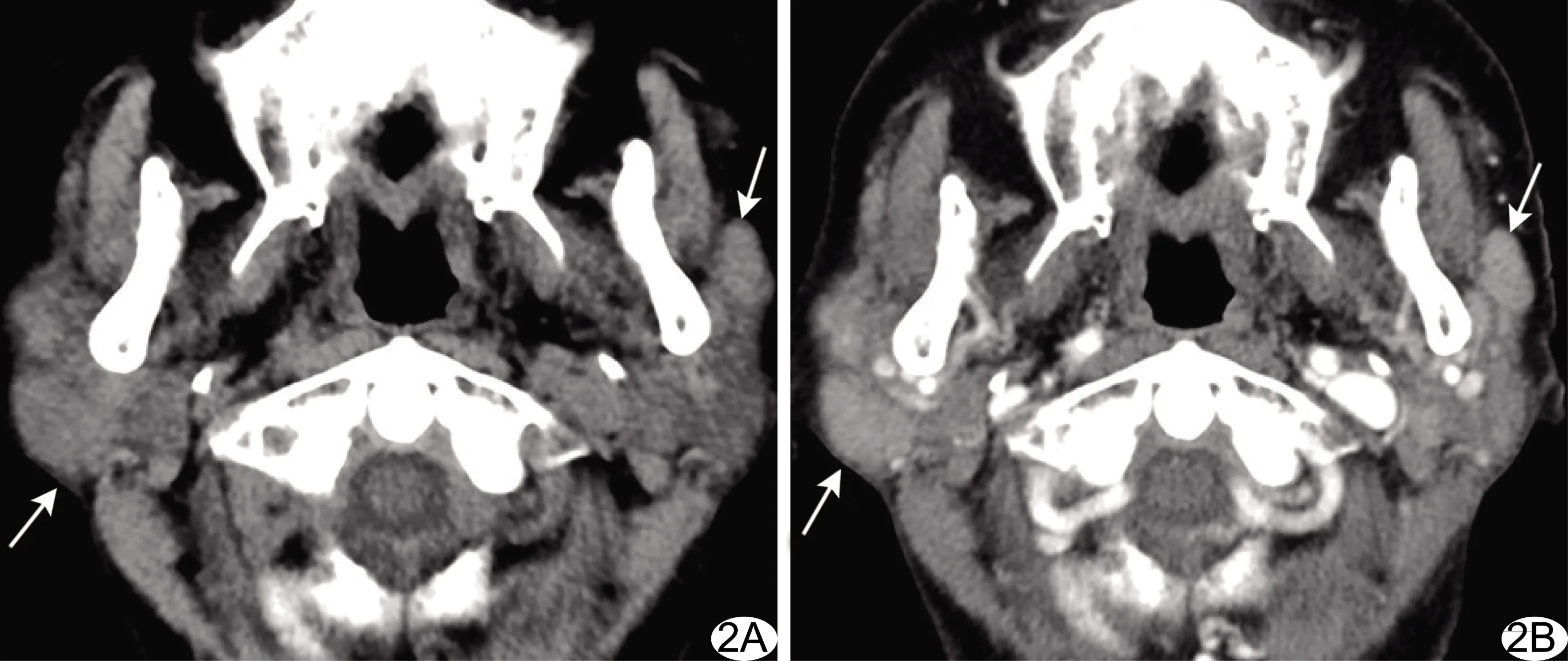
图2 患者女,63岁,双侧腮腺多发MD A、B.CT平扫(A)及增强(B)示双侧腮腺多发结节,密度均匀,部分病灶边界欠清,增强后病灶持续性明显强化(箭示病灶)

图3 患者女,32岁,右侧腮腺单发MD A、B.CT平扫(A)及增强(B)示右侧腮腺单发囊状病灶,密度不均匀,增强后呈薄壁环形强化(箭)
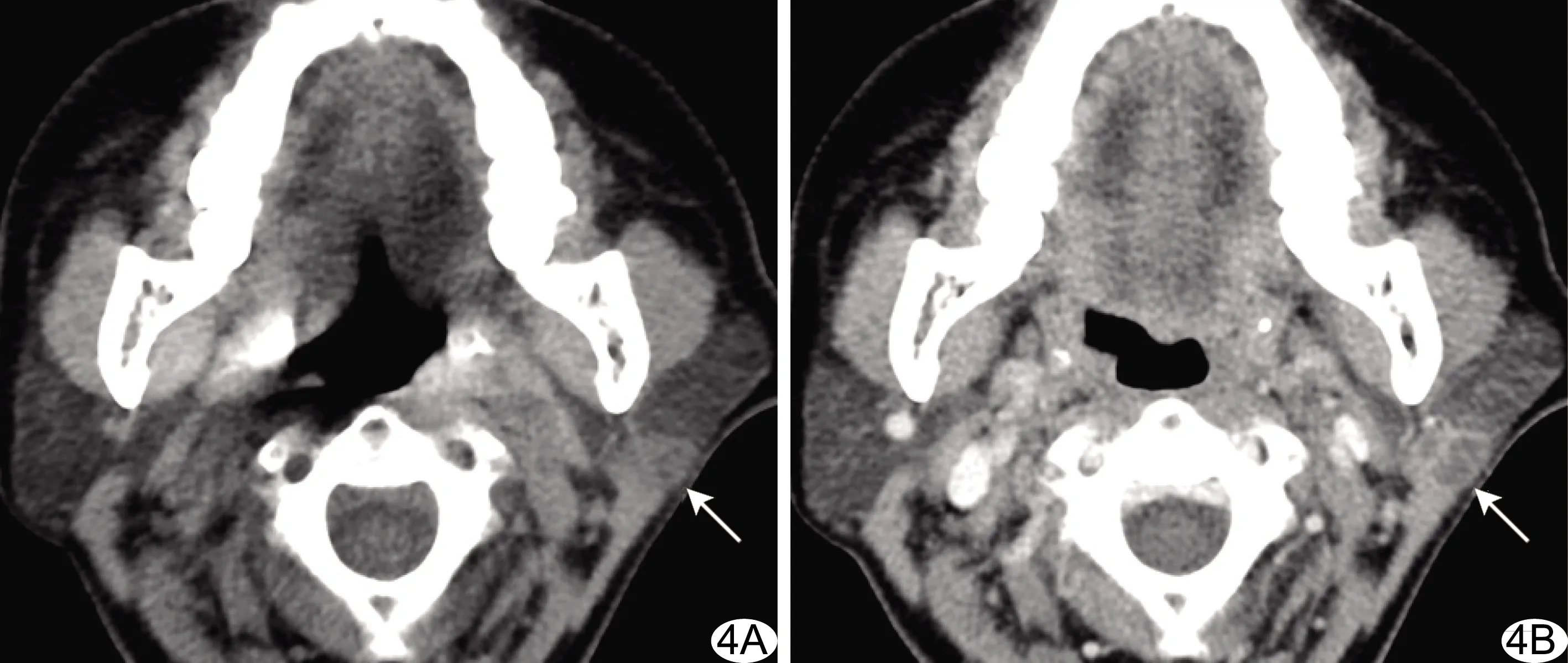
图4 患者女,62岁,左侧腮腺单发MD A、B.CT平扫(A)及增强(B)示左侧腮腺单发病灶伴多发小囊变,增强后呈分隔样持续性强化(箭)
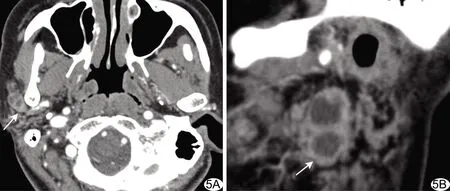
图5 患者女,57岁,右侧腮腺多发MD A、B.轴位(A)及矢状位(B)CT增强示右侧腮腺内多发结节,部分囊变,增强后呈分隔样持续性强化,囊壁及分隔较光滑(箭)

图6 患者女,47岁,双侧腮腺MD(弥漫浸润型,右侧已切除) A、B.CT平扫(A)及增强(B)示右侧腮腺缺如;左侧腮腺密度不均匀增高,其内散在小结节,伴多发小囊变及“砂砾样”钙化(短箭),增强后病灶不均匀强化(长箭)
2.2 术后病理学表现 大体标本显示病变腺体多呈灰白、灰红或灰褐色,质地较软,少数伴灰白色结节;光镜下见唾液腺腺泡萎缩、席纹状硬化及淋巴滤泡形成,大量淋巴细胞和浆细胞浸润于小叶间隔、腺泡间质及导管周围(图1C)。
3 讨论
IgG4-RD为可累及多器官、临床表现多样的慢性炎症性自身免疫性疾病,其病理学特征是IgG4阳性浆细胞浸润,导致炎性病变及纤维化[2];MD属于IgG4-RD的一种。除胰腺外,头颈部是IgG4-RD常见发病部位,而唾液腺(如腮腺)是IgG4-RD在头颈部最易累及的器官[3-4]。
MD临床表现:①好发于中老年女性,受累腺体持续肿胀;②唾液分泌功能多正常,少数轻度障碍;③使用糖皮质激素后唾液腺功能恢复或改善;④血清IgG4明显升高,且抗核抗体、抗SSA抗体、抗SSB抗体检测阴性[5-6]。其基本病理特征为涎腺腺泡、导管萎缩,并可见淋巴组织不同程度增生,以B淋巴细胞增生为主,萎缩的腺泡可形成上皮肌上皮岛;免疫组织化学EMA、S-100及CK19为阳性,CEA为阴性[7];受累腺体无明显破坏,细胞凋亡频率较低,免疫染色见大量IgG4阳性浆细胞浸润组织。
腮腺MD可单侧或双侧发病,根据CT表现分为单发结节或肿块型、多发结节型及弥漫浸润型,后者少见[8-11]。本组6例单发单侧结节型,均位于浅叶,呈圆形或椭圆形,CT平扫呈等或稍高密度,边界模糊,可伴囊变,增强后无囊变病灶呈均匀持续性中度至明显强化,合并囊变时呈环形及分隔样强化,囊壁及分隔较菲薄光滑;7例为多发结节型,其中3例单侧多发、4例双侧多发,病灶分布于浅叶和深叶,CT平扫呈等或稍高密度,边界模糊,可伴囊变,增强后强化表现与单发型相似;1例弥漫浸润型可见多发小囊变及“砂砾样”钙化,具有特征性。部分MD病灶发生囊变与自身免疫反应导致腮腺小叶内和小叶间导管扩张形成囊腔有关[12]。本组14例病灶邻近皮肤未见增厚,周围脂肪间隙清晰,颈部未见肿大淋巴结,仅1例病灶与皮下组织粘连,有助于与腮腺感染性病变(如急性炎症,脓肿或结核)相鉴别。腮腺是MD最常见累及部位,可合并其他腺体,如颌下腺异常[11];本组未见合并颌下腺病变的病例。
单发结节或肿块型MD需与腮腺常见肿瘤相鉴别:①多形性腺瘤,多为单侧单发类圆形肿块,边界清楚,可见分叶、囊变,增强后实质部分呈“慢进慢出”的缓慢延迟强化;②腺淋巴瘤,好发于中老年男性,与吸烟密切相关,多分布于腮腺浅叶后下部,边缘清楚,易发生裂隙样小囊变,增强后呈“快进快出”式强化;而MD多发于中老年女性,增强后肿块持续性强化,于静脉期或延迟期达到强化峰值,伴囊变时呈单发大囊或多发斑片状小囊。
多发结节型MD需与以下疾病相鉴别:①腺淋巴瘤,10%腺淋巴瘤可双侧发病,呈多发,病灶形态、密度、强化形式同前;②腮腺淋巴瘤,继发性相对多见,单侧或双侧发病,表现为腮腺单发或多发结节及弥漫性肿块,密度均匀,增强后呈中度至明显强化,少见坏死,无钙化,可伴颈部淋巴结肿大[13],而多发结节型MD可伴囊变及钙化,少见颈部淋巴结肿大。值得注意的是,IgG4-RD患者患淋巴瘤的风险高于正常人群[14],因此,对IgG4-RD患者需长期随访,必要时活检确诊;③木村病(又称血管淋巴样增生伴嗜酸性粒细胞增多、嗜酸性粒细胞增生性淋巴肉芽肿),临床少见,可单侧或双侧发病,分为界限清晰的多发结节型和界限不清的弥漫肿块型,无坏死及囊变,增强后病灶多呈持续性中至重度均匀强化,少部分呈轻度强化,病灶常累及皮肤及皮下脂肪间隙,伴颈面部皮肤增厚,腮腺周围及颈部常见多发肿大淋巴结,实验室检查血清嗜酸性粒细胞及IgE明显升高[15];而MD可伴囊变及钙化,少见皮肤增厚或淋巴结肿大。弥漫浸润型MD则需与腮腺炎症相鉴别,后者表现为腮腺密度均匀增高,增强后较均匀强化;另外,急性腮腺炎一般单侧发病,伴发热、疼痛等临床表现,有助于鉴别诊断。
综上所述,腮腺MD的CT表现具有一定特征性,结合血清IgG4检测结果有助于诊断。本研究的主要局限性在于样本量较少,且因术前多考虑为腮腺肿瘤而未检测血清IgG4,有待增加样本量进一步观察。

