红景天苷调控KLF4/eNOS信号抑制Hcy诱导内皮-间质转分化的作用
何 丽,涂梦欣,黄 梅,彭剑青,姜 丰,沈祥春,张彦燕
(贵州医科大学 1.药学院临床药学教研室、2.天然药物资源优效利用重点实验室,贵州 贵阳 550025)
研究表明,血管内皮功能损伤介导血管内皮细胞生物学功能的改变,其中内皮-间质转分化(endothelial-mesenchymal transition,EndMT)是影响其生物学功能的主要环节[1]。内皮细胞在特殊生理或病理条件下,可逐渐丢失原有的内皮表型,表现为内皮标志物如CD31、血管内皮黏蛋白(VE-cadherin)等的表达减少,同时获得间充质细胞表型,表达如α-平滑肌肌动蛋白(α-SMA)等标志物的上调,细胞的增殖、迁移与分泌能力进一步增强,此过程称之为EndMT[2],是动脉粥样硬化(atherosclerosis,AS)病情推进演变的重要病理过程[3]。内皮型一氧化氮合酶(eNOS)的活性降低及一氧化氮(NO)生物利用度的下调,已成为内皮功能损伤的显著特征[4]。eNOS为内皮细胞合成NO的关键酶,在EndMT介导的AS疾病中涉及内皮型一氧化氮合酶(eNOS)的表达变化[5],故eNOS/NO信号轴参与EndMT过程中对血管功能的调节。转录因子(transcription factor,TF)通过与特定DNA序列特异性结合,对细胞生命活动的各个过程起到调节作用。近年来发现,Krüpple样因子(Krüpple like factors,KLFs)为参与调节重要生命过程的锌指转录因子,其中Krüpple样因子4(Krüpple like factor 4,KLF4)具有调控细胞增殖、表型差异及重塑细胞骨架等作用[6,7]。因此,本研究拟基于KLF4/eNOS信号开展内皮-间质转分化的研究工作。
红景天苷(salidroside,SAL)是景天科(Crassulaceae)红景天属植物红景天的主要有效成分。研究表明,SAL可抑制血管内皮细胞氧化应激、炎症和内质网应激,并延缓内皮细胞衰老,具有明确保护心血管系统的药理作用[8-10]。前期研究表明,红景天苷可上调Hcy 诱导的内皮细胞抗氧化信号Nrf2 的表达,改善内皮细胞氧化应激损伤,提示SAL具有潜在保护内皮细胞的作用[11]。本研究基于KLF4/eNOS信号途径,分析SAL对Hcy诱导内皮-间质转分化的作用,以期为中药药效成分红景天苷的血管药理学活性提供实验依据。
1 材料
1.1 细胞人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于美国Sciencell公司,批号19195。
1.2 试剂红景天苷购自西亚化学工业有限公司(纯度≥98%,批号:B19208);内皮细胞培养基、细胞冻存液购自美国Sciencell公司(批号:26219、19671);VE-cadherin、α-SMA、KLF4、eNOS抗体均购自美国Cell Signaling Technology公司(批号分别为:#2500、#19245、#4038、#9572);GAPDH抗体购自Bioworld公司(批号:MB001);BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限责任公司(批号:P0010);电化学发光(ECL)检测试剂盒购自美国Millpore公司(批号:1829501);siRNA由上海吉玛基因科技有限公司提供(对照siRNA正义:5′-UUCUCCGAACGUGUCACGUTT-3′,反义:5′-ACGUGACACGUUCGGAGAATT-3′。KLF4 siRNA正义:5′-GGACUUUAUUCUCUCCAAUTT-3′,反义:5′-AUUGGAGAGAAUAAAGUCCTT-3′)。
1.3 仪器DMi1倒置荧光显微镜(德国Leica公司);170-3930型垂直电泳系统(美国Bio-Rad公司);CFX型凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 细胞培养HUVECs培养于含5%胎牛血清、1%青霉素-链霉素的双抗、1%内皮细胞生长因子的DMEM培养基,置于37 ℃、5 % CO2恒温培养箱中,视细胞生长情况换液及传代。
2.2 细胞转染采用siRNA技术实现内皮细胞KLF4的沉默。待细胞生长融合至60%左右进行转染,以无血清培养基稀释Lipofectamine 2000,配制siRNA-lipofectamin复合物,细胞转染6 h后转为正常条件培养24 h,采用蛋白免疫印迹法检测转染效率。
2.3 细胞处理与分组第一部分实验研究SAL对Hcy诱导内皮-间质转分化的作用,分为正常对照组(Control)、模型组(Model,1 mmol·L-1Hcy)、SAL低剂量组(1 mmol·L-1Hcy +10 μmol·L-1SAL)、SAL高剂量组(1 mmol·L-1Hcy +50 μmol·L-1SAL)。各给药组以SAL预孵育2 h后,加入Hcy共孵育48 h诱导EndMT。第二部分实验通过siRNA技术实现内皮细胞KLF4的沉默,基于KLF4/eNOS信号分析SAL抑制EndMT的分子机制。分为正常对照组(Control)、模型组(Model,1 mmol·L-1Hcy)、SAL组(1 mmol·L-1Hcy +50 μmol·L-1SAL)、siKLF4组(1 mmol·L-1Hcy+siKLF4)、siKLF4+SAL共给药组(1 mmol·L-1Hcy+siKLF4+50 μmol·L-1SAL)。转染处理方法按2.2项下方法进行,各处理组预孵育2 h后给予Hcy共孵育48 h复制EndMT。
2.4 Western blot检测相关信号的蛋白表达收集各实验组细胞,加入细胞裂解液(PMSF ∶RIPA=1 ∶99)于冰浴提取总蛋白,BCA蛋白定量试剂盒测定蛋白质浓度,以30 μg的蛋白样品行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳。湿转至0.45 μm的PVDF膜,5%脱脂牛奶室温封闭2 h。分别加入一抗于4 ℃孵育过夜,洗膜后加入稀释的二抗(1 ∶10 000)室温孵育2 h。1×TBST洗膜后,增强型ECL液暗室显影。Image Lab 5.1 软件分析目的蛋白相对表达量。
2.5 划痕实验检测细胞迁移能力将细胞接种于六孔板,按2.3项下第一部分实验分组处理细胞,采用10 μL移液枪垂直划痕,PBS洗涤后采用无血清培养基给药处理,倒置显微镜下拍照。随机选取5个点,分析SAL对细胞迁移力的影响。迁移率/%=(0 h划痕距离平均值-12 h划痕距离平均值)/0 h划痕距离平均值×100%。
2.6 试剂盒检测NO的含量将HUVECs接种于培养板,按2.3项下第一部分实验分组处理细胞,依试剂盒说明书方法检测细胞培养上清液中NO的含量。
2.7 KLF4 siRNA干扰实验将HUVECs接种于六孔板培养,待细胞生长密度约为60%左右,按2.2项下内容分组处理,采用Western blot检测KLF4的蛋白表达。
2.8 细胞免疫荧光技术检测KLF4的表达采用细胞免疫荧光技术分析KLF4的表达。按2.3项下第二部分实验方法分组处理细胞至观察终点,细胞经PBS 洗涤,以4%的多聚甲醛固定15 min,PBS洗涤,加入Triton-X 100透化10 min,PBS洗涤,加入山羊血清封闭1 h。分别加入特异性荧光标记的一抗(稀释比例1 ∶50),4 ℃孵育过夜,PBS洗涤后加入对应的荧光二抗(稀释比例1 ∶1 000),孵育1h,PBS洗涤,然后加入DAPI染核5 min,PBS洗涤后加入抗荧光淬灭剂,于倒置荧光显微镜下拍照,观察KLF4的表达情况。

3 结果
3.1 SAL对Hcy诱导EndMT表型标志物表达的影响Western blot 结果表明,Hcy诱导HUVECs内皮标志物VE-cadherin的表达减少(P<0.05),间充质标志物α-SMA 表达显著增加(P<0.01);SAL低、高剂量预孵育可上调内皮细胞VE-Cadherin的水平(P<0.05),下调α-SMA的水平(P<0.05,P<0.01),如Fig 1所示。结果表明,SAL预处理可抑制Hcy诱导内皮细胞表型标志物的变化。

Fig 1 Effects of SAL on expression of EndMT-related *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group
3.2 SAL对Hcy诱导细胞迁移能力的影响划痕修复实验结果表明,与正常对照组比较,Hcy显著诱导细胞迁移率增加为(150.69±21.97)%(P<0.01);经SAL低、高剂量预处理后,细胞的迁移率分别为(137.79±11.42)%和(105.58±10.44)%(P<0.01),提示SAL预处理可降低Hcy诱导的细胞迁移能力,如Fig 2所示。
3.3 SAL对Hcy诱导的细胞eNOS/NO信号轴的影响采用Western blot检测各实验组eNOS的蛋白水平,硝酸还原酶法检测细胞培养上清液NO的含量。Hcy诱导内皮细胞eNOS的蛋白表达降低(P<0.01),NO的水平减少(P<0.05)。SAL预孵育可上调eNOS的表达,提高内皮舒张因子NO的含量,如Fig 3和Tab 1所示。结果提示,SAL预给药可上调eNOS/NO信号轴的水平,改善内皮功能损伤。
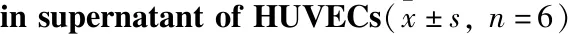
Tab 1 Effect of SAL on Hcy-induced NO

Fig 2 Effect of SAL on migration of **P<0.01 vs control group;##P<0.01,ns vs model group
3.4 SAL对Hcy诱导的细胞KLF4表达的影响Western blot结果表明,SAL低、高剂量组预给药可明显降低Hcy诱导的内皮细胞KLF4的表达水平。细胞免疫荧光分析结果进一步表明,与正常对照组比较,Hcy可诱导核转录因子KLF4由胞质向胞核转位,50 μmol·L-1的SAL预处理可降低KLF4的荧光强度,抑制KLF4的核转位,如Fig 4所示。结果证实,SAL有效降低核转录因子KLF4的表达水平,并抑制KLF4的核转位。
3.5 SAL和沉默KLF4对Hcy诱导的EndMT表型标志物及KLF4/eNOS信号表达的影响为明确KLF4能否作为上游信号调节eNOS的水平,参与调控Hcy诱导的EndMT,实验采用siRNA技术实现血管内皮细胞KLF4的敲低表达。结果表明,与正常组比较,sicontrol组KLF4的表达没有发生变化(P>0.05);与sicontrol组相比,siKLF4转染组显著抑制核转录因子KLF4的表达水平(P<0.01),证实本实验体系成功实现内皮细胞KLF4的沉默,见Fig 5A。Western blot 结果表明,Hcy诱导内皮细胞KLF4和间充质标志物α-SMA 表达增加(P<0.01),eNOS及内皮标志物VE-cadherin的表达减少(P<0.01,P<0.05);SAL组和siKLF4组均可上调Hcy诱导的HUVECs中eNOS和VE-Cadherin的表达,抑制KLF4和α-SMA的表达,见Fig 5B-C。与SAL+siKLF4的共处理组比较,SAL组及siKLF4组对表型标志物的作用无明显差异,结果提示,KLF4可能为SAL抑制Hcy诱导EndMT的重要信号,且KLF4可作为上游信号调节eNOS的表达。结果证实,红景天苷可通过调节KLF4/eNOS信号途径的表达水平,抑制Hcy诱导的EndMT。
Fig 3 Effect of SAL on eNOS expression in HUVECs induced by n=3)**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.

Fig 4 Effect of SAL on expression of KLF4 in HUVECs induced by n=3)**P<0.01 vs control group;#P<0.05 vs model group.

Fig 5 Effects of SAL and KLF4 silencing on expression of EndMT-related markers,KLF4 and eNOS induced by Hcy n=3)*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group;ns vs siKLF4 group or SAL group.
4 讨论
EndMT是内皮细胞在内、外损伤因素的作用下向间充质细胞转分化的特殊状态,其可通过影响内皮细胞的屏障及分泌功能恶化内皮微环境,加剧内皮功能障碍[12]。大量研究显示,内皮功能障碍伴随eNOS/NO信号通路的表达变化,在高同型半胱氨酸血症导致内皮功能障碍中起到关键作用[13-14]。NO为强效的内皮舒张因子,主要由L-精氨酸在一氧化氮合酶eNOS的催化下生成,内皮细胞生成释放的NO经扩散至血管中层平滑肌细胞后,经激活鸟苷酸环化酶介导血管平滑肌的舒张效应,从而调节血管舒张功能,故eNOS/NO信号轴已成为血管药理学研究的重要分子信号[15-16]。课题组前期研究表明,沉默内皮细胞KLF4的表达可抑制TGF-β诱导的细胞增殖、迁移及表型差异,有效抑制EndMT,证实KLF4为EndMT的关键调节因子[17]。目前,虽然开展了大量eNOS/NO信号途径的研究工作,但基于转录因子KLF4调节eNOS/NO信号轴的研究鲜见报道,因此本研究基于KLF4/eNOS信号途径,开展EndMT介导血管内皮功能损伤的研究。
研究表明,内皮细胞功能损伤为动脉粥样硬化的始动环节,积极寻找以保护血管内皮细胞功能为靶标,逆转内皮细胞生物学功能障碍的创新药物,对防治动脉粥样硬化具有重要意义。前期研究中,我们已证实红景天苷可上调抗氧化信号Nrf2 的表达,改善Hcy诱导的内皮细胞氧化应激损伤,初步明确了其血管药理学活性[11]。本研究以Hcy诱导的内皮-间质转分化为切入点,围绕转录因子KLF4对eNOS/NO通路的影响,分析红景天苷对EndMT的作用及分子机制,明确药物的血管药理学活性。结果表明,与正常对照组相比,Hcy诱导孵育48h明显降低了内皮特异性标志物VE-cadherin的水平、上调间充质细胞标志物α-SMA的表达,增强细胞迁移力,表明Hcy显著诱导EndMT。经低、高剂量SAL预处理,可抑制细胞表型标志物的变化,降低细胞迁移能力,证实SAL有效抑制EndMT,且作用与上调eNOS/NO信号通路的水平,下调KLF4的蛋白表达有一定关系。采用细胞免疫荧光实验观察KLF4在内皮细胞的表达定位,揭示SAL可抑制KLF4由细胞质向胞核转位,由此表明SAL干预EndMT的作用机制与抑制转录因子KLF4的活性相关。为进一步研究转录因子KLF4对eNOS/NO信号的调节作用,系统分析SAL抑制EndMT的分子机制,我们采用siRNA干扰技术实现内皮细胞KLF4的沉默。实验结果显示,沉默KLF4可上调细胞eNOS/NO信号的水平,提示KLF4可能为调节eNOS的上游分子信号参与调节血管舒张功能。经组间比较,SAL组、siKLF4组及SAL+siKLF4共给药组对细胞表型标志物VE-cadherin及α-SMA的表达水平无明显差异,表明KLF4可为SAL抑制EndMT的关键分子靶点。因此,本研究首次报道了红景天苷通过调节KLF4/eNOS信号途径,抑制Hcy诱导EndMT的作用,但其确切信号转导机制还有待深入研究。

