mTGase 交联蛋白质的安全性评价及相关检测研究进展
王稳航, 师小婷, 孙孟娇, 郝艳杰, 李 玉
(1. 天津科技大学 食品科学与工程学院,天津300457;2. 天津科技大学 生物工程学院,天津300457)
近几十年来,研究者通过酶促反应来改变食品蛋白质的功能特性以提高最终产品的感官质量和营养品质。 因此,酶促修饰的方法是改善和开发新功能特性产品的有效途径[1]。 由于酶具有反应温和、特异性强、安全性强、效率高等特点,因而成为食品蛋白质改性的重要途径。 微生物谷氨酰胺转氨酶(mTGase) 是目前惟一商业化的蛋白质交联酶,已广泛应用于众多食品领域。 它可以催化蛋白质或多肽链上谷氨酰胺残基与赖氨酸ε-氨基之间的酰基转移反应,形成ε-(γ-谷氨酰胺基)赖氨酸交联键,实现蛋白质或多肽之间共价交联并形成共价化合物,达到改善蛋白质结构和功能的目的[2]。 另外,mTGase 能够在有水且不存在赖氨酸底物的条件下进行蛋白质脱酰胺反应。 一般认为,在基于蛋白质的食品系统中,mTGase 催化异肽键的交联反应比酰基转移和脱酰胺反应要快[3]。
作为食品加工助剂,mTGase 在食品工业中的需求与日俱增,其年消费量增长了21.9%[4],已广泛用于肉制品、乳制品、植物蛋白制品和焙烤食品中。据报道,西方国家的饮食中含有大量的mTGase,以mTGase 处理的食品加酶量约50~100 mg/kg 计算,其每日最大摄入量可达15 mg[4-5]。目前,人们着重研究由mTGase 交联引起蛋白质加工性能的变化以及食品品质的影响,而对其交联导致营养价值的变化以及相关健康性的影响关注较少。 有研究表明,mTGase 诱导的异肽键(ε-(γ-谷氨酰胺)-赖氨酸二肽,G-L 二肽) 抑制胃蛋白酶消化并降低蛋白质的体外消化率[6]。 mTGase 交联也会产生积极的影响,它可以改变原有蛋白质的免疫原性,从而降低过敏症的产生。 但不可忽略的是,mTGase 被初步证明可能与乳糜泻的产生有关,它会与tTGase 一样作为乳糜泻患者的自身抗原,引发自身免疫疾病[4]。 乳糜泻是一种越来越常见的疾病, 影响多达1%的北美人口。 由于近几年乳糜泻的患病率大幅度增加,有必要考虑触发因素(如食品中的麸质蛋白和mTGase)带来的影响[7]。
在mTGase 对蛋白质的营养功能造成潜在影响的情况下, 食品中mTGase 及其交联产物的检测显得至关重要。 食品中mTGase 的检测可以用酶联免疫法(ELISA) 或高效液相色谱法(HPLC) 来完成,但是原有食品(如肉制品) 所含的tTGase 以及食品体系的复杂性成为检测的重大挑战。 同时,mTGase交联产物中异肽键的检测需经过多种酶顺序水解,以及由于异肽键的丰寡度而显得困难重重。 但是,一些先进的液相色谱-质谱联用(LC-MS) 技术可能会为异肽键的检测提供很大帮助[8-9]。
针对mTGase 交联蛋白质带来的食物安全性影响以及相关检测技术的挑战性,作者总结了近些年国内外mTGase 交联蛋白质消化率、 过敏性的影响以及可能引发乳糜泻发病机制的相关研究,探讨了mTGase 交联相关检测技术的可行性, 旨在为推动mTGase 的科学研究和安全应用提供参考。
1 微生物谷氨酰胺转氨酶
1.1 来源
谷氨酰胺转移酶 (TGase,EC 2.3.2.13) 是一类广泛存在于多种结构组织,包括动物、植物和微生物组织中的转移酶[10]。 在微生物中,mTGase 的一级结构是由331 个氨基酸残基组成的一条多肽链。 它是一种不依赖Ca2+,相对分子质量约为40 000,在较宽的pH 和温度范围内有活性的酶[1,10-11]。Kanaji 等[12]从 Streptoverticillium sp 菌 株 S -8112 建 立 了mTGase 完整的氨基酸序列和相对分子质量。Washizu 等[13-14]将产生mTGase 的菌株S-8112 鉴定为Streptoverticillium mobaraense 的 变 种。 商 业mTGase (商标ActivaTM) 是通过茂源链霉菌有氧发酵产生的细胞外酶,可从发酵液分离固体物质来回收,其回收率约为42%[15]。 一般商业mTGase 中仅存1%的蛋白质, 其添加了99%的麦芽糖糊精来稳定mTGase 的活性[3]。 现阶段,利用生物技术手段为mTGase 的异源表达提供了很大的可能性。 重组mTGase 的表达水平显著提高, 为进一步研究和开发低成本高产率的产品提供了帮助,同时创造了更高的商业价值[16]。
1.2 酶的同源性和活性位点
尽管tTGase 与mTGase 的氨基酸序列组成无同源性,但它们表现出了相似的催化活性和生化特性[17-18]。 tTGase 和mTGase 都能够脱/转酰胺,这取决于底物序列、酶对底物的亲和力及反应条件,例如pH、伯胺的存在和酶浓度。
不同来源的转谷氨酰胺酶的交联位点也不同。tTGase 和mTGase 都含有Cys-His-Asp 催化三联体,但它们之间的结构取向不同[19]。 在TGase 因子XIII 的三维结构中,Ca2+和酰基供体的结合引起构象变化, 其中Tyr 残基催化Cys 残基释放并形成酰基-酶中间体。与TGase 因子XIII 活性位点的底物空间结构可及性受限和复杂活化过程相反,mTGase的Cys64 充分暴露于溶剂中并与底物快速反应。 mTGase三级结构具有中心凹槽,该凹槽的Cys-His-Asp 活性中心有宽的活性位点裂隙,可容纳α-螺旋,降低酶和底物之间的空间位阻,从而导致底物特异性更广,反应速率更高[3]。 mTGase 和TGase 因子XIII 之间的这些结构差异决定了它们底物特异性和反应速率的差异[18]。 Gundersen 等[20]研究表明,mTGase 对酰基供体的反应速率高于TGase 因子XIII 和豚鼠肝脏TGase,而其对底物特异性的要求较低。
1.3 催化反应和对蛋白质功能的影响
转谷氨酰胺酶催化3 个反应: 酰基转移反应、蛋白质或肽的Gln 和Lys 残基之间的交联反应和脱酰胺反应[21]。 Gundersen 提出mTGase 具有广泛的酰基-受体底物特异性, 即短链的烷基氨基酸 (甘氨酸), 酯化的α-氨基酸、Thr、Ser、Cys、Trp 均可作为受体底物[20]。
同一种底物的不同状态经mTGase 处理后表现出不同的交联效果。 Stachel 等[22]研究了mTGase 对I 型胶原的交联反应,在热变性胶原中,发现每个胶原单体的最大掺入的异肽键数为5.4 mol。在胶原的非变性条件下, 由于天然三螺旋结构高度有序,mTGase 不能接近谷氨酰胺残基, 导致交联效果很差。 此外,非球状蛋白比球状蛋白更容易接近酶的活性位点[23]。 因此,通过化学还原(破坏二硫键) 、高温、 高压处理使分子完全或部分变性可增加mTGase 酶促交联程度[2]。
mTGase 交联会引起蛋白质功能的变化: 如溶解性、凝胶化、乳化性、发泡性和持水性等[2,24],以具有改善或创新产品的特征。 例如,胶原蛋白制成的膜可作为生物可降解和食用包装材料[25],也可将热稳定性强的蛋白质和热稳定性差的胶原蛋白通过mTGase 交联,改善复合物的热稳定性,并增强其机械性能[26]。
2 安全性评价
近年来,随着mTGase 广泛地应用于肉制品、乳制品、豆制品等不同食品领域中[27],人们对其安全性的关注与日俱增。 首先,mTGase 催化的异肽键不能被肠道酶水解,可能会对蛋白质的消化吸收产生一定影响。其次,乳糜泻患者摄取经mTGase 处理后的产品,mTGase 可能会作为触发自身免疫反应的抗原,诱导乳糜泻的产生[28]。另外,mTGase 酶促交联可以产生具有更高饱腹感效果和低致敏性的食物结构,便于控制食物的能量摄入并降低蛋白质的致敏性[3]。 因此,mTGase 处理食品所带来的安全性问题值得关注,应进一步了解其在消化后对人体营养和生理特性产生的影响,为消费者提供更多的健康保障。
2.1 对蛋白质消化的影响
摄入交联蛋白质后,正常哺乳动物的胃肠道消化酶将它们裂解成氨基酸, 但保留完整的G-L 二肽。 顽固的G-L 经小肠吸收并转运至肾脏。 已发现两种酶在体内降解G-L 键。 一种是γ-谷氨酰胺环转移酶,其切割G-L 二肽,产生游离的赖氨酸和5-氧代-脯氨酸(焦谷氨酸)[29]。由于赖氨酸是必需氨基酸,所以这条途径有助于满足人体的营养需求。 然而,由于5-氧代-脯氨酸被ATP 依赖性酶(5-氧代-脯氨酸酶) 转化为谷氨酸, 摄入大量交联蛋白质会导致肾脏消耗大量的ATP,增加肾脏的负担。 另一种在体内降解G-L 键的酶是γ-谷氨酰转移酶,主要存在于肠道刷状缘膜、肾脏和血液中。 它将G-L二肽切割成赖氨酸和谷氨酸而不消耗ATP[30]。因此,部分G-L 键可通过这两种有效途径代谢成赖氨酸,产生的赖氨酸对人体营养有益[18]。
Romeih[31]研究表明,人胃蛋白酶和胰蛋白酶可以消化含有异肽键的乳制品, 并且mTGase 被认为是可摄入人体的安全物质,不会对消费者造成健康风险。 Seguro[32]用mTGase 处理的酪蛋白喂养大鼠,与对照组相比,大鼠的食物摄入和总体健康没有显著差异。 对这些大鼠的粪便和尿液进行色谱分析,发现其体内对部分异肽的吸收约为99%。 Yu 等[6]通过胃蛋白酶体外消化鱼糜凝胶, 随着mTGase 添加量的增加,鱼糜凝胶的交联度增加,表面疏水性逐渐降低,达到最大消化率的时间延长。 这些结果表明,虽然异肽键降低了蛋白质的体外消化率,但添加适量mTGase 有利于营养物质的酶解持续释放。Xing 等[33]认为mTGase 酶促修饰豆腐中的蛋白质后,会导致其基质更牢固,同时降低其消化程度,有助于控制能量摄入并减少食物过敏的机会。 因此,mTGase 催化的交联产物消化得更慢, 但与未处理的蛋白质相比,氨基酸的营养价值和生物利用度相似,对于消费者来说是安全可靠的[2]。
2.2 引起乳糜泻等疾病
乳糜泻是易感染患者通过摄入小麦、大麦或黑麦中的麦胶蛋白(俗称麸质)在小肠中引发的自身免疫炎症性疾病[34]。 麸质中的特定氨基酸序列可以激活肠T 细胞来诱导乳糜泻的产生。 这些具有免疫原性的肽抵抗肠道蛋白酶的消化,肠上皮细胞通过细胞旁转运途径(包括紧密连接)将其完全吸收,通过跨细胞途径进入固有层并与tTGase(乳糜泻的自身抗原)相互作用。这些毒性肽脱/转酰胺后,由抗原呈递细胞处理并暴露于免疫效应细胞[35]。所以,乳糜泻主要由细胞介导免疫,并仅限于通过人的白细胞抗原DQ2 和DQ8 将麸质衍生的毒性肽呈递给T 细胞。 遗传易感染是引起乳糜泻的主要危险因素,并且麸质是有害的营养环境因素。 所以,乳糜泻患者只能食用无麸质的食品[34,36]。
长期以来,tTGase 被认为是乳糜泻的自身抗原, 因此食品中的mTGase 可能会影响乳糜泻患者的健康,并且西方国家乳糜泻发病率的增加与从烘焙食品摄取mTGase 的较高消耗量之间有直接的相关性。 同时烘焙食品中的麸质是tTGase 和mTGase作用的优良底物,该问题引起了人们的关注。 食品制造商声称mTGase 的使用是安全的, 但并不意味着该酶对麸质的免疫原性没有任何影响或者酶本身具有免疫性或致病性[36]。mTGase 交联麸质可能对乳糜泻患者有害,因为酶可使麸质脱酰胺,从而模拟内源tTGase 交联。 另一方面, 许多研究表明,mTGase 与一些神经退行性疾病有关, 如阿尔茨海默病和亨廷顿病[37]。
食品行业中使用的食品添加剂(mTGase) 是诱导自身免疫病(AD) 的主要环境因素。 它可能会消除肠上皮层的屏障功能并通过打开细胞间的紧密连接(TJ)来增加肠粘膜的通透性,导致外来免疫原性抗原的进入和自身免疫级联的激活。 mTGase 可通过交联氨基酸或蛋白质来增加肠粘膜通透性,其研究结果及相关机制如下[5]:
1)如果mTGase 模仿tTGase 对感染因子进行保护和营养功能,并促进其在肠道中生存,那么由于感染增加了肠粘膜的通透性,可能会破坏TJ。
2)谷氨酰胺和含硫氨基酸调节Caco-2 细胞紧密连接蛋白质。 从细胞培养基中剥夺谷氨酰胺(Gln) 和使用蛋氨酸亚砜亚胺抑制Gln 合成酶,导致Caco-2 细胞的跨上皮耐药性显著降低, 同时其通透性增加。 可以推测,mTGase 修饰这些氨基酸与其它分子的非特异性连接可以诱导肠上皮层水平的匮乏/过剩状态,从而间接影响TJ 表象。
3)mTGase 与不同蛋白质之间的交联作为主要修饰物连接复合物之间的物理和化学性质、二级和三级结构、 抗原性和免疫表位 (抗原决定部位)。mTGase 交联的潜在结果是产生新的营养免疫原性表位,可能使TJ 呈现畸变现象。
4)mTGase 通过交联不同的蛋白质产生乳化特性。许多合成的表面活性剂(食品添加剂) 已证明可以通过细胞旁转运或跨细胞转移机制增加肠粘膜通透性,其中一些添加剂可以抑制P-糖蛋白。此外,表面活性剂会降低黏液层的疏水性,与增加肠粘膜通透性有关[38]。
5)mTGase 具有催化蛋白质脂质化的能力,从而为它们提供乳化性能[39]。mTGase 可诱导来自酪蛋白、猪肉肌原纤维、花生和鱼类的各种膳食蛋白质的交联,提高其乳化能力[40-41]。
6)mTGase 应用的新领域是纳米粒子交联或用其设计新的细胞腔传递系统。 mTGase 在纳米技术中的应用几乎没有限制[42]。
7)mTGase 连接的多种蛋白质,包括烘焙产品,对乳糜泻患者具有免疫原性。 仅在乳糜泻患者的血清中观察到特异性抗-mTGase 和mTGase-醇溶蛋白新复合物抗体,而健康对照组中没有观察到[36]。
Palma[43]研究表明,mTGase 是乳糜泻的一种新环境增强剂。 首先,mTGase 像内源性tTGase 一样,将麸质脱/转酰胺。它能够使具有免疫原性的蛋白质和其它大分子交联, 从而增加免疫系统的抗原负荷。 其次,它降低腹腔蛋白酶活性,导致腹腔疾病患者免疫原性肽的清除能力下降。 交联的营养成分麸质和mTGase 增加了肠粘膜的通透性, 由此破坏肠道屏障, 允许更多的外来免疫原性分子诱发乳糜泻,见图1。mTGase 在食品加工中的应用大量增加,触发了乳糜泻的发病机制,这可能解释了乳糜泻发病率激增的现象[4,44]。

图1 mTGase 和麸质诱发自身免疫疾病的步骤示意图Fig. 1 A schematic representation of steps through which mTGase and gluten induce autoimmune diseases
显然,治疗乳糜泻需要从患者的饮食中消除有害的麸质肽或钝化它们的免疫刺激作用,最传统且安全的方法就是摄取无麸质的产品。 还可以用mTGase 处理麸质来降低面包中免疫刺激性麸质肽的含量。 尽管多项研究表明,mTGase 可以使麸质转酰胺基化,在体外解毒麸质肽,抑制麦醇溶蛋白对肠道的反应,减少T 细胞诱导INF-γ 的产生而又不影响其主要工艺性能,但还是建议谨慎使用。 因为Lerner 等[45]研究发现,成年乳糜泻患者口服mTGase转酰胺面粉仅部分有效, 未达到预期治疗效果,并且观察多个结果表明,mTGase 转酰胺的面粉对麸质敏感人群可能存在危险。
2.3 降低蛋白质致敏性
mTGase 可以降低某些蛋白质的致敏性已经得到证实。 Yamauch 等[15]开发了一种减少酪蛋白致敏性的方法:将αs1-酪蛋白(23 000) 用mTGase 在25℃水浴下处理20 h,以制备致敏性降低的交联酪蛋白(90 000)。 Yuan 等[46]研究结果表明,mTGase 催化糖基化的温和方法具有降低虾类产品致敏性的潜力。 mTGase 催化的糖基化反应可诱导虾的原肌球蛋白结构变化, 这些修饰使IgG/IgE (免疫球蛋白)结合能力降低。 线性和构象结构的改变破坏了致敏性表位,从而降低虾类产品的致敏性。Li 等[47]提出可以通过mTGase 修饰蛋白质异源聚合来生产低变应原性蛋白质产品。 结果表明,mTGase 修饰异源聚合物的分支链可有效地掩盖和破坏了SPI (大豆分离蛋白) 构象以及线性抗原表位。 因此, 虽然SPI 对WPI(乳清分离蛋白) 和CN(酪蛋白) 的异源聚合并没有完全消除它们的IgE 反应活性, 但低活性的IgE 异源蛋白聚合物可适用于对牛奶蛋白质过敏的儿童。
3 分析检测技术
美国食品药品监督管理局认为mTGase 作为蛋白质交联剂用于食品加工是安全的,并且欧洲法律允许在产品成分标签上不标明它的存在[3]。 但是,目前也有讨论使用mTGase 重组食品的一些安全方面的影响:成分标签上没有明确标明对消费者的欺骗行为;mTGase 作为过敏原对乳糜泻患者可能存在健康损害;潜在的微生物(酶的来源)污染风险;食品中残留酶的安全性影响。 正常肉制品的加工条件(温度65~73 ℃)[48], 酶灭活的温度至少80 ℃以上,所以食品中肯定会残留部分mTGase。 另外,mTGase修饰蛋白质交联所得的异肽键不易被普通的蛋白酶水解。 因此,通常将交联蛋白质进行彻底蛋白酶解, 然后对异肽键进行色谱纯化来完成分离和检测。 近年来食品中残留酶含量,以及异肽键的作用位点、交联机制引起格外关注,其中最重要的就是酶和异肽键的监控和技术手段。 一些追踪技术可以有效、灵敏地检测酶和异肽键,比如ELISA 和LCMS 分析方法备受青睐[28,49]。 所以,这些检测技术的发展对于mTGase 的进一步研究十分重要。
3.1 酶的检测
最初, 主要采用经典的组织学技术来检测mTGase 处理的肉制品。 然而,这些方法仅用于检测肉的结构变化,并没有提供关于结合剂是否使用及其类型(如纤维蛋白原-凝血酶,mTGase)的具体信息。之后经过技术的发展,Kaufmann[28]使用多克隆兔或小鼠抗体进行ELISA 检测mTGase。 Schloegl 等[8]也使用ELISA 检测来自茂源链霉菌的mTGase,通过胶原酶降解后直接定量显示,最初使用的酶中约40%保留在mTGase 处理的胶原材料中。
除了酶联免疫的测定方法外, 液相色谱-质谱联用也受到了广泛的关注,见图2。 Jira 等[49]开发了一种灵敏的HPLC-MS/MS 方法,用于同时检测重组肉中的mTGase 和纤维蛋白原-凝血酶。使用预定的MRM 模式, 检测到32 个mTGase 和纤维蛋白原标记肽段(共96 个质量转变,即每个肽段发生了3 个质量转变)。 即使mTGase 质量分数低于推荐量的1%,也可检测到其在重组肉中的质量分数为50 mg/kg(相当于1.3 μmol/kg)。 Jira 等[50]首次进行了肉交联后在烧烤和油炸处理条件下mTGase 的HPLC-MS/MS检测。 通过选择4 种合适的特征性标记肽段以及使用高温提取蛋白质 (100 ℃) 和短时间的胰蛋白酶消化(3 h),在重组肉中可以明确地检测到mTGase。
3.2 酶产物及异肽键的检测
酶产物和异肽键最先从与tTGase 相关的人或动物中检测, 随后才发展了食品加工中mTGase 的检测技术,这些检测技术经历了由定性到定量的发展。Miller[51]从纯化的人纤维蛋白中分离出含有异肽键的二肽,使用异硫氰酸苯酯(PITC) 将其衍生。 通过反相高效液相色谱 (RP-HPLC) 分离并检测,表明交联程度与之前确定的相似。 从两岁大鼠的肝匀浆中分离出含有异肽键的二肽,表明本方法可用于检测生理学样品中异肽键的存在。 Motonaka 等[52]为了证实γ-谷氨酰-β-丙氨酰组氨酸和相关肽的形成,加热了模型溶液(含酰胺的氨基酸和肌肽),并对产物进行了研究。 蛋白质水解消化产物释放异肽键,使用固相萃取进行分离,经PITC 对含有异肽键的组分衍生后,通过HPLC 进行分离和定量。结果表明,在加热含有肌肽的各种食物时,会形成异肽键。
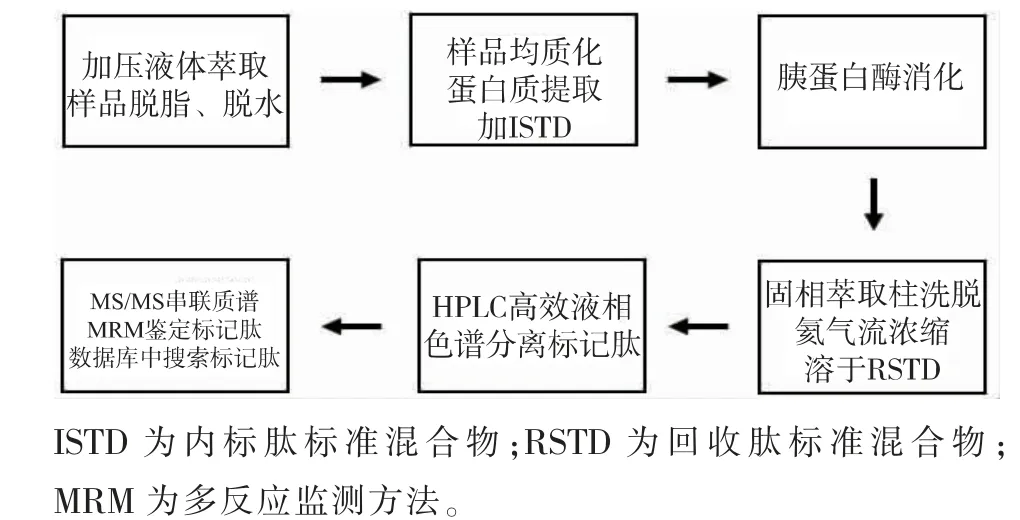
图2 HPLC-MS/MS 方法检测食品中mTGase 的流程图Fig. 2 Flow chart of HPLC-MS/MS method for mTGasedetection in foods
Hoffner 等[53]为检测mTGase 催化蛋白质之间异肽键交联的形成,研究了在HPLC-MS/MS 离子质谱仪上同时定量异肽键和赖氨酸的方法。 该方法已成功应用于tTGase 交联的人的生物样品测试,例如表皮、 纤维蛋白和亨廷顿病脑的角质化包膜。Rombouts 等[54]证实了热诱导麦谷蛋白中异肽键的形成, 即加热HMW-GS 赖氨酸和含谷氨酰胺的多肽可诱导异肽键的形成,同时提出要弄清楚异肽键的形成对面食干燥过程这类应用的影响,就需要精确定量麦谷蛋白中的异肽键。Ahhmed 等[55]通过链霉蛋白酶、亮氨酸氨基肽酶、脯氨酸酶和羧肽酶将所有交联蛋白质进行酶解, 然后使用RP-HPLC 进行检测,见图3。 结果表明,添加1.0 mL mTGase 溶液可使鸡肉和牛肉样品中异肽键的含量分别增加25%和46%。 Stachel 等[22]通过6 种不同蛋白酶的顺序酶解交联样品,确保完全水解并保留酸不稳定的异肽键。 然后用RP-HPLC 分离氨基酸并通过已知量的纯ε-(γ-谷氨酰)赖氨酸校准系统,进行交联产物的定量。 结果表明,胶原蛋白在60 ℃下加热30 min 后进行交联反应,测得异肽键与胶原蛋白的摩尔比为5.4。

图3 HPLC 检测食品中异肽键流程图Fig. 3 Flow chart of isopeptide bonds detection by HPLC in foods
4 展 望
mTGase 因其作用温和、广泛的底物特异性、反应速率快等特点成为一种优质的交联剂。 它能使乳制品、豆类、虾类等蛋白质的致敏性降低,但大量实验表明,mTGase 可能会诱导乳糜泻的产生[44],如果摄入的mTGase 对内源性tTGase 具有累加或增强作用,则可能导致高发病率和不良后果。 因此,为达到降低乳糜泻患者发病率的目的,除了食用无麸质的食物外, 也应避免食用mTGase 处理的食品。 同时,要让消费者从食品标签上知晓mTGase 的存在。研究mTGase 的免疫原性和致病性是评估其健康性的有效手段。 以定量检测异肽键入手,解析酶交联蛋白质的营养性作用, 对于研究mTGase 的健康性具有重要意义。 目前,还需深入了解并研究mTGase的致病机理,从而有效防控其带来的不利影响。 此外,可改进现有LC-MS 的技术手段和方法,进一步优化酶及异肽键的检测。

