营养强化对卵形鲳鲹仔、稚鱼骨骼发育基因表达的影响
杨蕊 周胜杰 方伟 马振华
(1 中国水产科学研究院南海水产研究所热带水产研究开发中心,海南三亚 572018;2 农业农村部南海渔业资源开发利用重点实验室,广东广州 510300;3 三亚热带水产研究院,海南三亚 572018)
卵形鲳鲹(Trachinotusovatus)隶属于鲈形目(Perciformes)、鲹科(Carangidae)、鲳鲹属(Trachinotus),是1种暖水性中上层洄游鱼类,广泛分布在我国、澳大利亚、日本和东南亚如印度尼西亚、新加坡等的热带及亚热带海域[1]。该鱼体高而侧扁,尾柄细短而扁,肉质鲜美细嫩,营养丰富,广受消费者的喜爱[2]。自20世纪90年代,卵形鲳鲹开始在我国广东、福建和海南等地被繁育养殖,现已成为我国南方主要的养殖海水鱼类之一[3-4]。目前对卵形鲳鲹的研究较为广泛,但主要集中于该鱼的人工繁育、发育和病害等方面[5-10]。
骨骼发生是脊椎动物发育过程中重要的组成部分[11]。在这一过程中,不同类型的细胞(如软骨细胞、成骨细胞、骨细胞和破骨细胞)的分化和增殖抑制了骨骼的形状、大小和矿物形成[12]。骨骼发育相关基因的表达能够反映细胞的增殖和分化,而且还受到个体遗传特性、生物和非生物因素的影响[13]。骨骼形态发生蛋白(bone morphogenetic proteins,BMPs)属于转化生长因子-β超家族成员,可诱导骨形成时的异位[14]。BMP 2和BMP 4蛋白是该家族中重要的成员,主要与软骨和硬骨的发育密切相关。sox基因家族是1组转录因子,在脊椎动物早期发育过程中具有十分重要的作用[15]。根据序列比较结果,该基因家族被分为6个亚组(A, B, C, D, E, F),其中sox9基因属于E组,在脊椎动物的发育过程中扮演着重要的角色[16]。
仔、稚鱼在生长发育过程中,其形态和代谢等会发生巨大变化,其中基因表达和调控是1个关键机制。sox8、sox9、bmp2和bmp4基因作为鱼类发育过程中的主要功能基因,了解这些基因在鱼类个体发生过程中的表达将有助于加深对鱼类发育的认识。营养强化是水产育苗过程中十分重要的环节,相关研究表明,营养强化能够促进仔、稚鱼的骨骼发育,并降低骨骼畸形率[17]。本研究采用经强化剂(S.presso、海水拟微球藻)强化后的生物饵料(轮虫和轮虫无节幼体)投喂卵形鲳鲹仔、稚鱼,最后通过荧光定量的方法分析不同强化组卵形鲳鲹的sox8、sox9、bmp2和bmp4等4个基因的表达,以期为卵形鲳鲹仔、稚鱼的发育提供基础数据。
1 材料和方法
1.1 受精卵来源与培养条件
营养强化试验于2020年6月11日—2020年7月5日在中国水产科学研究院南海水产研究所热带水产研究开发中心陵水实验基地进行。试验用卵形鲳鲹受精卵由海南蓝海洋水产养殖有限公司提供。将受精卵运输至基地并置于500 L的孵化桶中进行孵化,孵化期间水温保持在26 ℃。
孵化后第2天,将幼体转移至9个500 mL的培育桶中继续培养,保持密度为60尾/L。进水口位于培育桶底部,进水经孔径为250 μm的网膜过滤。排水口位于培育桶顶部,用孔径为300 μm的滤网套住排水孔以防幼体逃逸。每个培育桶布设2个气石,以保持水中溶解氧(DO)接近饱和水平。幼体培育期间,每天光照处理14 h(光照强度为2 400 lx),黑暗处理10 h,水体盐度保持在33.0±0.8,水温保持在(26.5±1.0)℃,每天换水量为200%。
孵化后第3天开始以10~20个/mL的密度投喂轮虫(Brachionusrotundiformis),孵化后第13天开始添加卤虫无节幼体。其中,S.presso组投喂经强化剂S.presso(INVE Aquaculture,Salt Lake City,UT,USA)强化12 h的轮虫和卤虫无节幼体;海水拟微球藻组投喂经海水拟微球藻(Nannocholoropsissp,青岛宏邦生物技术公司)强化12 h的轮虫和卤虫无节幼体;对照组投喂未经强化的轮虫和卤虫无节幼体。每组均设3个平行,即每组共3个培育桶。
在鱼苗培育阶段,每天添加适量的浓缩小球藻来调节水色,以保证适合于鱼苗培育的浅绿色水体环境。孵化后第18天开始混合投喂配合饲料,每天投喂5~6次,饲料过渡期4~5 d。育苗期间,每日清除残饲和死亡的鱼苗,每2天清理1次排水口滤网。
1.2试验采样
分别于受精卵孵化后第0、5、10、15、20 和25天进行采样,每个组每个平行分别随机选取10尾鱼苗,用滤纸吸干后置于RNA Store中保存备用。
1.3 RNA提取
低温保存的样品经液氮研磨,提取总RNA。使用ND 5000超微量紫外可见分光光度计(北京百泰克生物技术有限公司)测定总RNA的含量。再使用1%琼脂糖凝胶电泳检测RNA的完整性。
1.4实时荧光定量PCR(qPCR)
以提取的RNA为模板,使用PrimeScript RT Master Mix(Perfect Real Time)反转录试剂盒[宝生物工程(大连)有限公司]合成cDNA,并于-20 ℃冰箱中保存备用。反转录体系共10 μL,包含2 μL 5×PrimeScript®RT Master Mix,总RNA 500 ng,用Rnase Freed H2O 补至10 μL。反转录反应条件:37 ℃反转录30 min;85 ℃灭活反转录酶5 s。从NCBI数据库选取卵形鲳鲹sox8、sox9、bmp2和bmp4基因序列,使用Primer Premier 5软件设计引物(见表1)。使用实时荧光定量 PCR仪(杭州朗基科学仪器有限公司)进行qPCR检测。反应体系共20 μL,包括:10 μL 2×Real Universal PreMix,0.6 μL 10 μmol引物,2 μL稀释的cDNA模板,用Rnase Freed H2O 补至20 μL。反应条件为:95 ℃预变性15 min;95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸30 s,共40个循环。每个样品进行3次qPCR,在每个qPCR周期结束时,对引物进行熔解曲线分析,以确保只得到特定的产物,不形成引物二聚体。设置无DNA模板的阴性对照组,以验证qPCR过程未受污染。经验证,qPCR效率在100%左右。

表1 试验所用引物
1.5计算与统计分析
用2-ΔΔCT法测定目的基因mRNA的相对表达量,以β-actin基因作为内参基因进行标准化。试验数据以“平均数±标准差”表示。使用SPSS 19.0软件进行统计分析,采用单因素方差分析和LSD检验进行组间比较,统计显著性水平设为0.05。
2 结果
2.1 不同营养强化组卵形鲳鲹仔、稚鱼sox 8基因的表达
由图1可见,随着试验的进行,S.presso组试验鱼sox8基因的相对表达量呈现先升后降的趋势,其高峰出现在第10天。海水拟微球藻组也呈现相似的变化规律,但其高峰出现在第15~20天。在第5、10天,S.presso组sox8基因的相对表达量显著高于海水拟微球藻组和对照组(P<0.05),但在第10~25天,海水拟微球藻组的相对表达量显著高于其他两组(P<0.05)。试验全程,对照组试验鱼sox8基因的相对表达量几乎都处在较低的水平。
2.2不同营养强化组卵形鲳鲹仔、稚鱼sox9基因的表达
由图2可见,生物饵料强化剂对试验鱼sox9基因的表达有显著影响(P<0.05)。在第0~15天,S.presso组sox9基因的相对表达量处于较高水平,但之后显著下降(P<0.05)。海水拟微球藻组sox9基因的相对表达量在第0~10天差异不显著,在第15 天时达到最高(P<0.05)。总体而言,在第5~20天,S.presso组sox9基因的相对表达量均显著高于其他2组(P<0.05),在第25天,海水拟微球藻组sox9的相对表达量高于其他2组。试验全程,对照组sox9基因的相对表达量呈现显著下降的趋势(P<0.05)。
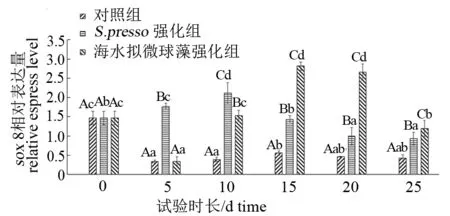
注:不同小写字母表示组内差异显著,不同大写字母表示组间差异显著(P<0.05);下同。
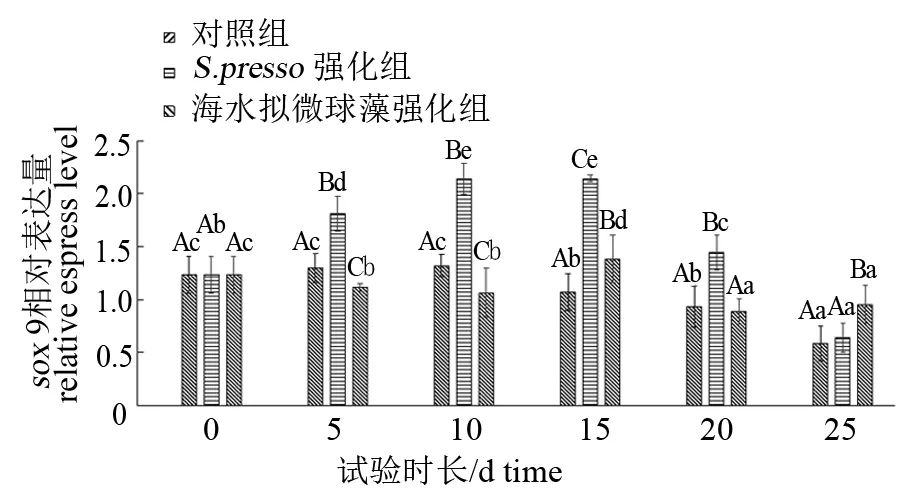
图2 不同强化组卵形鲳鲹仔、稚鱼sox 9基因的表达
2.3 不同营养强化组卵形鲳鲹仔、稚鱼bmp 2基因的表达
由图3可见,生物饵料强化剂对试验鱼bmp2基因的表达有显著影响(P<0.05)。S.presso组试验鱼bmp2基因的相对表达量随着日龄的增加呈现先升后降的趋势,其峰值出现在第10天,最低值出现在第25天。海水拟微球藻组bmp2基因的相对表达量在第10天后显著高于前期(P<0.05),但后期各时间节点差异不显著(P>0.05)。S.presso组bmp2基因的相对表达量在第5~10天显著高于海水拟微球藻组(P<0.05),但在之后则相反。试验全程,对照组bmp2基因的相对表达量表现出显著高于其他2组的趋势(P<0.05)。
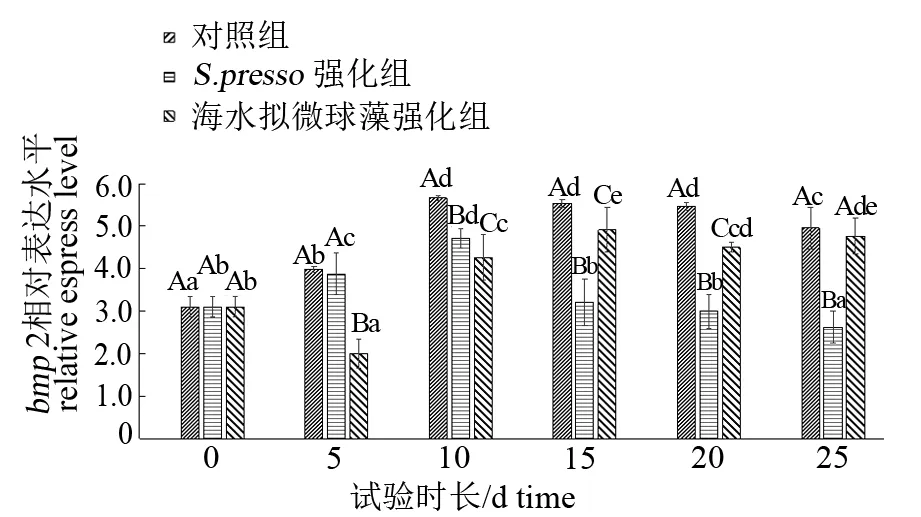
图3 不同强化组卵形鲳鲹仔、稚鱼bmp 2基因的表达
2.4 不同营养强化组卵形鲳鲹仔、稚鱼bmp 4基因的表达
生物饵料强化剂对试验鱼bmp4基因表达的影响情况见图4。S.presso组bmp4基因的相对表达量随试验鱼日龄的增加呈现上升趋势(P<0.05),海水拟微球藻组则呈下降趋势。试验全程,S.presso组bmp4基因的相对表达量几乎都显著高于其他2组(P<0.05)。对照组bmp4基因的相对表达量在第10~20天变化不大,在前期和后期相对表达量较低。
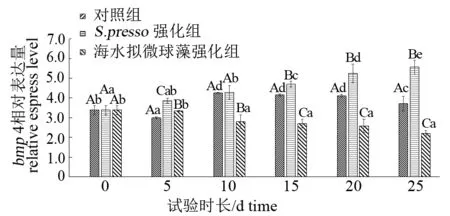
图4 不同强化组卵形鲳鲹仔、稚鱼bmp 4基因的表达
3 讨论
营养强化是指借助轮虫、卤虫无节幼体等生物饵料的非选择性滤食特性,将其作为活的营养载体,将一些含有特殊物质的强化剂填充到其肠道中,并以此投喂水产动物苗种的过程[18],其目的是通过营养强化,满足水产动物苗种对必需氨基酸、脂肪酸和脂溶性维生素等的需求,并有效预防疾病[19]。生物饵料营养强化技术现已广泛应用在海水鱼类苗种繁育过程中。早在20世纪90年代,就有学者开展了轮虫营养强化对大黄鱼生长及成活率影响的研究,结果表明,投喂经海水小球藻强化培养的轮虫后,大黄鱼仔稚鱼的成活率和生长均显著优于对照组[20]。杜涛等[21]对尖吻鲈、卵形鲳鲹和美国红鱼开展了营养强化育苗试验,结果表明,投喂经小球藻和螺旋藻粉强化的轮虫后,仔稚鱼的成活率显著高于酵母组。Ma等[22]发现,投喂经S.presso强化后的轮虫和卤虫无节幼体能够降低卵形鲳鲹仔、稚鱼的畸形率,提高苗种质量。为进一步明确S.presso和海水拟微球藻对生物饵料轮虫和卤虫无节幼体的作用机理,本研究采用经S.presso和海水拟微球藻强化的卤虫无节幼体投喂卵形鲳鲹仔、稚鱼,并对其骨骼发育相关基因的表达进行研究,为卵形鲳鲹的苗种繁育提供参考和指导。
转录因子sox超家族与动物个体发育、机体代谢及性别决定等密切相关。sox8基因是该家族E群体的成员之一[23],该基因广泛存在于动物个体外胚层或中胚层细胞中,其表达主要发生在机体成骨细胞分化过程。本研究中,不同的营养强化剂对卵形鲳鲹仔、稚鱼sox8基因的表达具有显著的影响:S.presso和海水拟微球藻对sox8基因的表达均具有显著的促进作用;S.presso的增强作用主要表现在整个试验阶段,而海水拟微球藻的增强作用表现在第10天之后。sox9也是sox超家族E群体的成员之一,机体软骨细胞发育过程中主要依赖于sox9等基因的表达[24]。研究表明,多数鱼类的精巢和卵巢中sox9基因出现复制现象,该现象在斑马鱼、河鲀、刺鱼、青鳉和卵形鲳鲹等多种鱼类中均被观察到[15-16,25]。在本研究中,S.presso强化使得试验鱼sox9基因的表达在第25天前显著增强,但在之后则没有显著影响。整体来看,海水拟微球藻强化对sox9基因的表达没有显著的影响。
BMP 2和BMP 4是密切相关的蛋白,参与了胚胎背-腹轴发育等关键过程[26]、上皮细胞-间质细胞之间的相互作用[27],还参与了细胞凋亡的过程[28]。Ma等[17]的研究表明,卵形鲳鲹仔、稚鱼在第7天左右发生了骨化过程,到第18天时其骨骼的大部分结构已完全形成并矿化。本研究中,在骨骼发育阶段,S.presso和海水拟微球藻的强化作用并不能增强试验鱼bmp2基因的表达。BMP 4蛋白在脊椎动物发育过程中发挥着多种作用,它不仅参与胚胎轴的形成和胚层的诱导,还调节组织器官的形成[29]。因此,它可被用来评价微营养素对海洋鱼类幼虫骨骼发育的影响[30]。本研究结果显示,在骨骼发育阶段,S.presso的强化作用能够增强试验鱼bmp4基因的表达,但海水拟微球藻的强化作用并不能增强该基因的表达。
——奇妙的蛋

