低氧胁迫对大口黑鲈“优鲈3号”hif-1α、glut-1及caspases基因的影响
陆健 张佳佳 周国勤 王佩佩 庆辉
(南京市水产科学研究所,江苏南京 210036)
溶解氧(DO) 是影响水生生物生长、正常生理功能和生存的重要因素之一。水体中的溶解氧极易受到季节变化、昼夜节律和温度等环境因素的影响,因此普遍具有不稳定性[1]。近年来,由于水体富营养化严重,全球性、季节性水体缺氧的现象愈加频繁发生。特别在沿海地区,过多养分的投入使得海洋中初级生产力提高,从而导致底层有机物沉积增加,当微生物分解底层有机物质所需的氧气超过地表水的再充氧速率时,就会导致水体供氧不足[2]。另一方面,二氧化碳大量排放导致的温室效应也会提高局部缺氧发生的频率。因此,在季节性缺氧的沿海地区,水生生物通常生活在低氧和常氧交替的环境下。尤其是在水体较小水位较低的池塘中,溶解氧受天气、温度、饲养密度等外部环境的影响波动较大,养殖水体中一旦出现缺氧,就会有“泛塘”的危险,甚至会造成巨大的经济损失[3]。
低氧环境已被证明会影响鱼类的行为、生长、生理状态以及疾病抵抗力,甚至导致鱼类死亡[3-4]。一般情况下,水体溶解氧在5 mg/L以上时,鱼类可正常摄食;当溶解氧低于2 mg/L时,鱼类摄食量显著下降;当溶解氧低于1 mg/L时,大部分鱼会浮头甚至窒息死亡[5]。因此,鱼类在进化过程中一直调整着对低氧胁迫的生存策略,而这种生存能力依赖于完整的低氧感受机制和低氧环境下复杂的基因调控机制[6]。例如,攀鲈属鱼类进化出鳃上器官,使之能在缺氧的池水里生存[7];在极度低氧的条件下,鲫将有氧呼吸转化为无氧代谢[8];鲤科鱼类则是通过增加低氧诱导因子基因(hif-1)的拷贝倍数来提高血红蛋白的载氧能力[6,9]。
大口黑鲈“优鲈3号”是近两年推广养殖的大口黑鲈新品种,其幼鱼和成鱼生长速度较快,养殖5~7个月即可达到上市规格,适合在我国淡水水域采用配合饲料进行养殖[10]。高密度精养现已成为池塘养殖的主要方式[11],但随着养殖规模的扩大,养殖密度逐渐增加,也出现了水质恶化及富营养化等问题,因而加大了大口黑鲈“优鲈3号”缺氧的风险。另一方面,鱼类的大脑和肝脏参与能量和氧的代谢,对缺氧特别敏感[12]。为研究低氧胁迫对大口黑鲈“优鲈3号”呼吸代谢和细胞凋亡的影响,本试验以大口黑鲈“优鲈3号”为研究对象,探究其在低氧胁迫下相关基因的表达,旨在为大口黑鲈“优鲈3号”健康高效养殖提供基础数据,防止或减少缺氧“泛塘”所造成的损失。
1 材料和方法
1.1 试验材料
试验所用大口黑鲈“优鲈3号”幼鱼体质量为(10.4±0.8) g,体长为(8.2±0.5) cm,来自江苏南京帅丰饲料有限公司。将试验鱼暂养于有生物过滤水再循环系统(配备有冷却和加热功能,流速为5 L/min,光照时间为14 h)的水族箱中,每日投饲2次(8:00—9:00和20:00—21:00),饲料采用江苏南京帅丰饲料有限公司生产的大口黑鲈配合饲料。暂养期间,水温为(26 ± 1)℃,溶解氧在5 mg/L以上,氨氮和亚硝酸盐氮质量浓度低于0.01 mg/L。试验前停饲24 h,试验期间不投饲。
1.2 低氧胁迫处理
挑选20尾试验鱼放入循环水养殖玻璃缸(长70 cm×宽48 cm×高30 cm)中,用于测试“浮头点”。低氧胁迫开始前,利用LDO101 probe测定仪测得水体溶解氧为7.89 mg/L。低氧胁迫开始后,关闭增氧机和进水阀,用透明保鲜膜将整个玻璃缸密闭,充入氮气,每10 min记录1次水中的溶解氧。试验过程中,观察鱼的活动情况,当试验鱼开始因低氧而浮在水面吞食空气时,则达到“浮头点”。经测试,大口黑鲈“优鲈3号”幼鱼的“浮头点”DO为 0.45 mg/L。因此本试验将低氧胁迫的条件设置为(0.70±0.05) mg/L,此质量浓度使试验鱼处于稳定的低氧胁迫状态同时又不引起死亡。
选择健康无病、体质良好的试验鱼120尾,随机放入6个循环水养殖玻璃缸中,每缸20尾鱼。试验设置DO为(7.50±0.50)mg/L的常氧对照组和(0.70±0.05) mg/L的低氧胁迫组,各3个平行。关闭低氧胁迫组的进水,停止增氧,开始低氧胁迫试验。在充入氮气约40 min时,低氧胁迫组的溶解氧水平下降至(0.70 ± 0.05) mg/L,之后维持此水平8 h。在低氧处理后的1、2、4、6、8 h以及恢复常氧24 h时,于每个时间点在低氧胁迫组和对照组各随机选取1尾鱼,对其肝脏及脑组织进行取样,经液氮处理后置于-80 ℃下保存。
1.3 组织RNA的提取和cDNA的合成
组织RNA的提取采用高纯总RNA快速抽提试剂盒(北京百泰克生物技术有限公司,RP1202),用1%琼脂糖凝胶电泳检测RNA的质量(电压120 V,电流165 mA,时长25 min),用Nanodrop检测RNA的纯度(OD260/OD280)和质量浓度。根据HiScript®Reverse Transcriptase的说明(Vazyme,R123-01)进行第1链cDNA反转录。
1.4 荧光定量PCR
参考樊佳佳等[13]的方法以18 s基因为内参基因,caspases引物序列参考Yu等[14],大口黑鲈转录组序列(hif-1α,NCBI:KY952764.1)、(glut-1,KY952765.1)用Primer Premier 5.0软件设计基因特异性上下游引物,参考引物序列详见表1。引物由生工生物工程(上海)股份有限公司合成。用SYBR qPCR Master Mix(High ROX Premixed)试剂盒(Vazyme,Q341-02/03)在ABI荧光定量PCR仪上扩增。反应体系为:2 μL cDNA模板(5 ng/μL),4 μL的上、下游引物(10 μmol/L),10 μL 2×ChamQ SYBR qPCR Master Mix(High ROX Premixed)。扩增条件为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火60 s,40个循环;熔解曲线60 ℃→95 ℃,每15 s升温0.3 ℃。
1.5 数据处理和分析
实时荧光定量PCR分析后得到的试验结果数据采用2-ΔΔCT法计算目的基因的相对表达量。试验数据以“平均值±标准差”表示,采用 SPSS 19.0软件进行统计分析。利用单因素方差分析(One-Way ANOVA)和LSD多重比较检验对数据进行处理和检验分析,P<0.05表示差异显著,P<0.01表示差异极显著,用Origin 8.6软件绘图。

表1 引物信息
2 结果和分析
2.1 低氧胁迫对大口黑鲈“优鲈3号”hif-1α基因表达的影响
由图1、图2可见,低氧胁迫下大口黑鲈“优鲈3号”脑和肝组织hif-1α的表达量均从1 h后开始显著升高,脑组织的hif-1α表达量在4 h时达到峰值(P<0.01),为对照组的16.84倍,肝组织的hif-1α表达量在6 h时达到峰值(P<0.01),为对照组的6.07倍。复氧24 h后,二者均下降至常氧水平(P>0.05)。
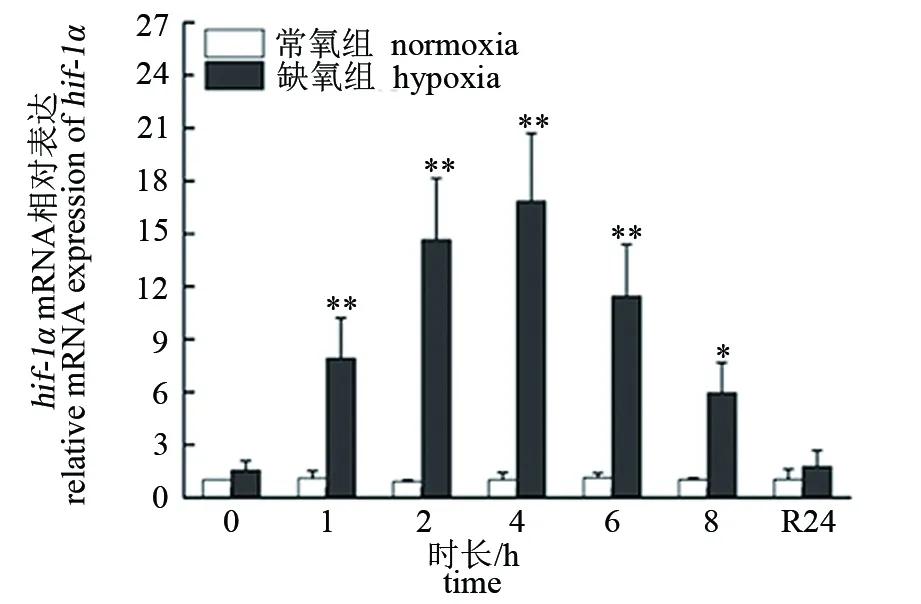
注:*表示组间差异显著(P<0.05),**表示组间差异极显著(P<0.01),下同。)
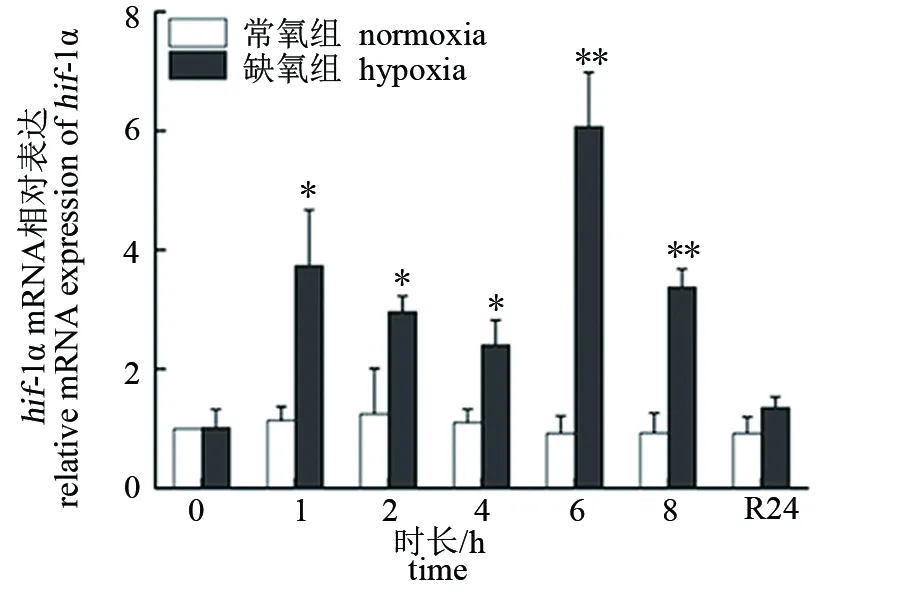
图2 低氧胁迫对大口黑鲈“优鲈3号”肝组织
2.2 低氧胁迫对大口黑鲈“优鲈3号”glut-1基因表达的影响
由图3、图4可见,低氧胁迫下大口黑鲈“优鲈3号”脑和肝组织glut-1的表达量均从1 h后开始显著升高,且均在6 h时达到峰值(P<0.01),分别为对照组的14倍和13.18倍;随后有所下降,但直至8 h时仍极显著高于对照组(P<0.01)。复氧24 h后,脑和肝组织的glut-1表达量均恢复至常氧对照组水平(P>0.05)。
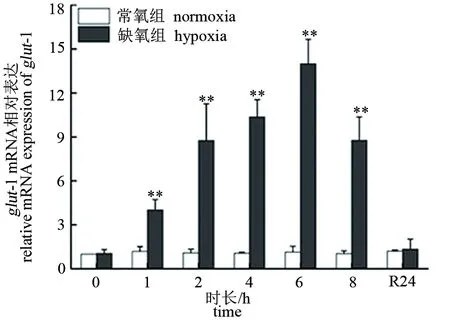
图3 低氧胁迫对大口黑鲈“优鲈3号”脑组织glut-1表达的影响

图4 低氧胁迫对大口黑鲈“优鲈3号”肝组织glut-1表达的影响
2.3 低氧胁迫对大口黑鲈“优鲈3号”caspases(半胱氨酸蛋白酶)基因表达的影响
低氧胁迫下,大口黑鲈“优鲈3号”脑组织caspase3和caspase9的表达量极显著升高,均在8 h时达到峰值(P<0.01),分别为对照组的10.36和11.42倍。复氧24 h后,脑组织caspase3和caspase9的表达量逐渐下降,但仍极显著高于对照组(P<0.01)(见图5、图6)。肝组织caspase3和caspase9的表达量在低氧胁迫2 h后极显著升高(P<0.01),均在8 h时达到峰值(P<0.01),分别为对照组的11.89和9.27倍。复氧24 h后,肝组织caspase3和caspase9的表达量逐渐下降,caspase3仍显著高于对照组(P<0.05),而caspase9则恢复至常氧水平(P>0.05)(见图7、图8)。
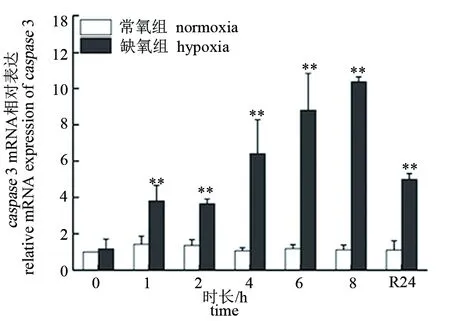
图5 低氧胁迫对大口黑鲈“优鲈3号”脑组织caspase 3表达的影响
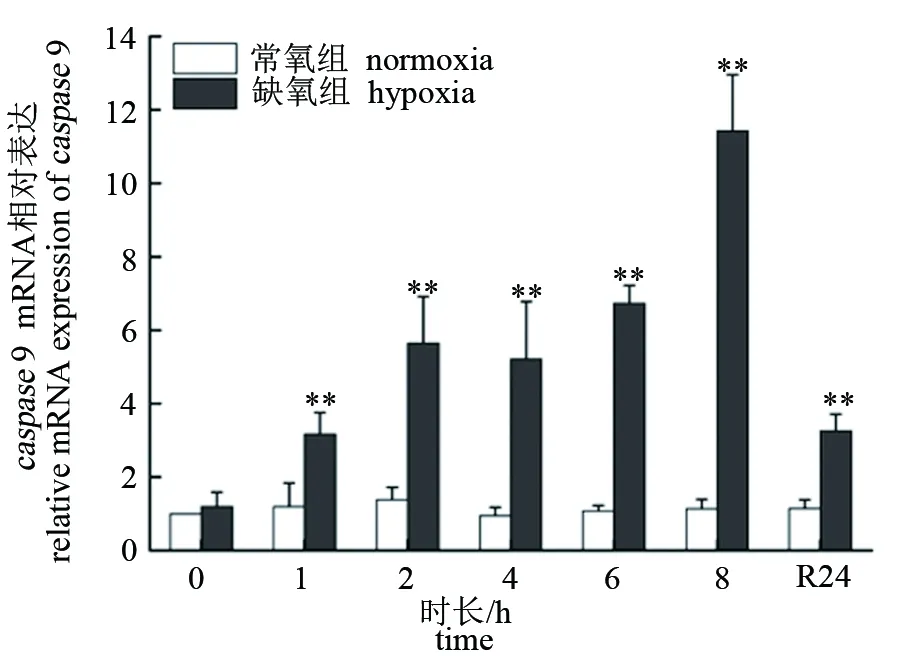
图6 低氧胁迫对大口黑鲈“优鲈3号”脑组织caspase 9表达的影响
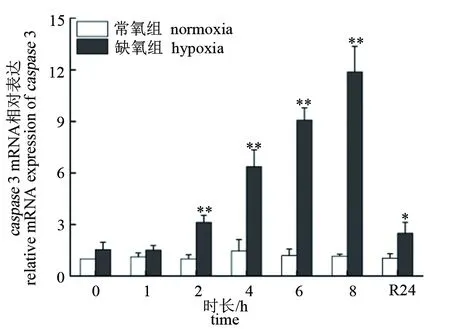
图7 低氧胁迫对大口黑鲈“优鲈3号”肝组织caspase 3表达的影响
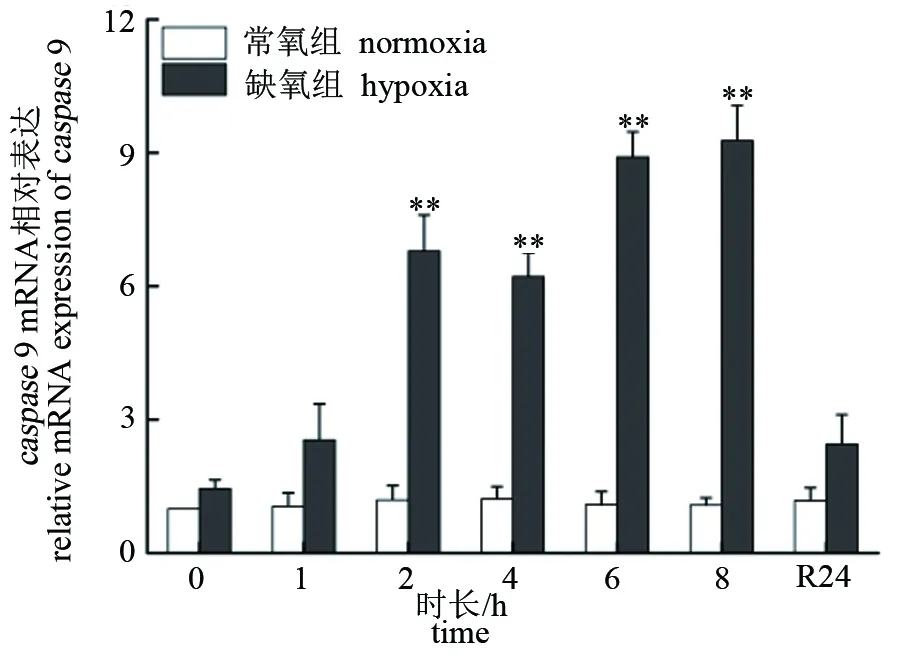
图8 低氧胁迫对大口黑鲈“优鲈3号”肝组织caspase 9表达的影响
3 讨论
在自然水体或渔业生产中,尤其是在较高密度的养殖水体中,由于温度、季节和水质等因素的改变导致鱼类出现急性低氧应激的情况时有发生。低氧诱导因子(HIF)是目前被鉴定到的低氧信号传导途径中最为关键的因子。关于hif-1的低氧诱导机制已被证实,其主要影响氧的传递和利用[15-16]。有研究表明,HIF的调控功能在转录水平和蛋白水平均可发挥作用,例如斑马鱼(Daniorerio)[17]、牙鲆(Paralichthysolivaceus)[18]等。本研究结果显示,急性低氧胁迫后大口黑鲈“优鲈3号”脑和肝组织hif-1α的表达量显著高于对照组。同样的,草鱼[19]hif-1α在低氧胁迫4 h后高度表达,半滑舌鳎(Cynoglossussemilaevis)[16]hif-1α在低氧胁迫初期表达量呈现明显的上调趋势。在正常情况下,hif-1α通过泛素-蛋白酶体途径迅速降解,减少积累[20],但在低氧条件下,羟基化途径被抑制,导致hif-1α蛋白累积,这可能是低氧胁迫下hif-1α表达量上升的原因[20-21]。但是,团头鲂(Megalobramaamblycephala)[22]和虹鳟(Oncorhynchusmykiss)[23]在低氧胁迫下hif-1α的表达量与对照组无显著差异。引起这种不同表达模式的原因,一方面可能是不同鱼种有不同的低氧耐受阈值或者物种特异性的氧气需求[22],另一方面也可能是鱼类hif-1α在低氧胁迫下的表达具有种属特异性[16]。研究表明,上调的hif-1α表达可以有效地激活下游目标基因,例如葡萄糖转运子(Gluts)[24],它们可以编码细胞膜上的葡萄糖转运蛋白。在低氧条件下Gluts被诱导表达,从而加强细胞葡萄糖的转运效率,以增强细胞能量需求[6]。对低氧敏感的欧洲鲈(Dicentrarchuslabrax)在面对低氧刺激后,glut-2 mRNA拷贝数发生了相应变化,这印证了glut与低氧适应性相关的认识[25]。本研究结果也表明,在低氧胁迫后,大口黑鲈“优鲈3号”脑和肝组织中glut-1的表达量显著上升。这种glut-1的增加与先前对小鼠3T3-L1细胞[26]的观察结果一致。在缺氧条件下,水生动物产生多种代谢适应,将新陈代谢从有氧氧化转换到糖酵解途径是1种增加葡萄糖的摄取以促进对低氧张力反应的策略,对葡萄糖的更高需求导致细胞膜上葡萄糖转运蛋白的数量增加[6]。因此,大口黑鲈“优鲈3号”glut-1的上调可有效增加葡萄糖的摄取,并维持低氧条件下的能量补充。值得一提的是,Yang等[24]发现,在1.2 mg/L的低氧胁迫后,大口黑鲈hif-1α和glut-1达到峰值的时间与本研究相比均较晚,主要原因可能是溶解氧水平不同。同样,Sun等[27]的研究也显示,大口黑鲈在不同程度低氧胁迫后,hif-1α和glut-1的表达量在严重低氧组(1.2 mg/L)显著升高的时间早于中度低氧组(3 mg/L)。
研究表明,hif-1可以通过调控Bax(B淋巴细胞瘤-2基因相关的X蛋白质)改变线粒体膜通透性或诱导MPTP(线粒体膜转运通道孔)增加,促进凋亡的发生[28]。吴胜春等[29]发现,低氧条件下,人脐静脉内皮细胞ECV304通过上调hif-1a的表达,进而使Caspase3和Bax的表达上调,Bcl-2(B淋巴细胞瘤-2)的表达下调,促使细胞凋亡的发生。低氧主要通过死亡受体通路以及内源性的线粒体通路这两条途径来诱导细胞发生凋亡,而caspase3则是这两种途径中常见的效应子,被称为凋亡的“执行者”[30],而作为凋亡的“启动者”,caspase9主要参与线粒体凋亡途径[31]。在正常条件下,Caspases以休眠的酶原形式存在于正常细胞中,当其受到凋亡信号刺激后,可以裂解特异性的蛋白质底物,导致细胞凋亡[32]。本试验结果显示,在低氧胁迫后,肝脏和脑组织caspase3和caspase9的表达量均显著升高。与本结果类似的是,鲟鱼(Acipensersinensis)在急性低氧30 min (氧饱和度为15%)时中枢神经系统的各个区域均可检测到细胞凋亡,同时caspase3的表达量显著高于常氧组[33];在0.2 mg/L低氧胁迫下的斑马鱼[34],其caspase3基因表达量显著升高,表明急性低氧胁迫会导致细胞膜和蛋白质受到损伤,触发激活凋亡相关系列基因的变化,从而诱导细胞发生凋亡,通过清除受损的细胞来维持机体内环境的稳定。另一方面,中枢神经系统(CNS)对缺氧最为敏感,而且对低氧的耐受性较差,缺氧可诱导中枢神经系统慢性或急性损伤。在脑缺氧损伤中,不仅存在细胞凋亡,还可能存在细胞坏死,细胞凋亡是脑缺氧后迟发性神经元死亡的重要表现形式[35]。本试验结果显示,在低氧胁迫8 h时脑组织caspases的表达量达到峰值,并且在复氧24 h时caspases的表达量仍高于对照组,这可能是迟发性神经元出现死亡的表现,也可能是复氧时氧化应激带来的损伤致使脑细胞再一次发生凋亡。因此,在日常的养殖中,应做好池塘日常管理和巡查工作,避免因为长时间缺氧导致池鱼死亡,造成经济损失。
4 结论
本研究结果显示,低氧胁迫会引起大口黑鲈“优鲈3号”肝脏和脑组织hif-1α、glut-1和caspases基因表达量显著升高,初步表明hif-1α和glut-1是“优鲈3号”低氧信号传导途径中的重要组成部分。另一方面也表明,低氧胁迫可能会激活线粒体凋亡通路,从而可能会诱导细胞凋亡的发生。

