疟原虫厚血膜改良染色效果研究
吴莲凤,吴程力,王霄霞(.温州医科大学附属第一医院医学检验中心,浙江温州35000;.温州医科大学仁济学院,浙江温州35000)
疟疾是严重危害人类健康的寄生虫病之一,与艾滋病、结核病一起被WHO列为全球三大公共卫生问题。据WHO报道,2019年全球仍有87个国家和地区流行疟疾,有2.29亿新发病例,约40.9万人死于疟疾[1]。随着国际交流及出国旅行等不断增多,导致境外感染输入疟疾较常见。疟疾不仅严重危害我国人民的身体健康和生命安全,也对巩固我国消除疟疾成果构成严重威胁。血涂片镜检法既是WHO推荐的疟原虫检测金标准,也是我国基层医疗机构和疾控部门最直接、最常用的检测方法[2]。特别是在厚血膜上镜检疟原虫,因其疟原虫数量多、分布密集、检出率高成为血涂片镜检疟原虫的重要环节。但是目前使用的厚血膜法操作较繁琐,且经常出现血膜脱落、溶血不彻底、影响虫体形态等问题,在很大程度上影响了临床疟原虫的检出。因此,我们对厚血膜染色法做了一定程度的改良,其操作简单、效果佳,现与同行分享。
1 材料与方法
1.1 实验材料 新鲜EDTA-K2抗凝外周血,疟原虫阳性的新鲜EDTA-K2抗凝外周血,洁净玻片,瑞吉染液(珠海贝索公司),瑞氏染液(自配),吉姆萨染液(自配),蒸馏水、缓冲液(6.64 g/L磷酸二氢钾、6.45 g/L磷酸氢二钠,pH 6.6~6.8)及Nikon ECLIPSE 50i型光学显微镜。
1.2 实验方法
1.2.1 选择最适稀释比例染液 将瑞吉染液和缓冲液按1∶3、1∶5、1∶10、1∶15、1∶20比例配制成待用染液。用加样枪取疟原虫阳性新鲜EDTA-K2抗凝血5μL,滴加在干净玻片上并制成直径约为1 cm左右、厚薄均匀的圆形厚血膜,每组按照不同稀释比例分别制作3张,血膜充分干透后,分别加入上述比例待用染液,染色30 min后用蒸馏水轻轻将染液冲走,晾干玻片待检。在油镜下,通过观察红细胞的溶血程度、背景是否干净、虫体及细胞染色情况进行综合评估,选择最佳染色效果的稀释比例染液。
1.2.2 用3种染色方法染色 取疟原虫阳性的新鲜EDTA-K2抗凝外周血,制作厚血膜方法同1.2.1,制成150张厚血膜片,每50张分为一组,分别按改良染色法(瑞吉染液与缓冲液按1∶15混合,染色30 min)、传统厚血膜染色法[3](先用蒸馏水对厚血膜进行溶血处理,后用缓冲液将吉姆萨染液染色30 min)及文献报道染色法[4](瑞氏染液与蒸馏水按1∶5混合,染色10 min)进行染色,晾干玻片待检。通过肉眼分别观察3种染色方法染色后厚血膜脱膜的数量及程度,在油镜下观察虫体染色后结构清晰度及背景干净程度。
1.3 可重复性和稳定性评价 随机选取5名实验室技术人员和5名实习生接受此染色方法培训后,每人均用已知疟原虫阳性和阴性EDTA-K2抗凝血标本制备厚血膜各2张,并采用改良后染色法进行染色,制得40张厚血膜片,将此40张片改变顺序交由另两位形态学经验丰富的实验室技术人员油镜下检查并评价,以评估此染色方法的稳定性和重复性。
1.4 统计学分析 采用SPSS 16.0软件进行。计量资料结果以百分率表示,两组样本比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同比例瑞吉染液、缓冲液混合染液的染色效果比较 见图1。瑞吉染液与缓冲液按照1∶15比例混合制成待染液进行染色,红细胞溶血效果好、背景清晰,疟原虫虫体结构染色清楚、染色效果最佳,见图1D、E。
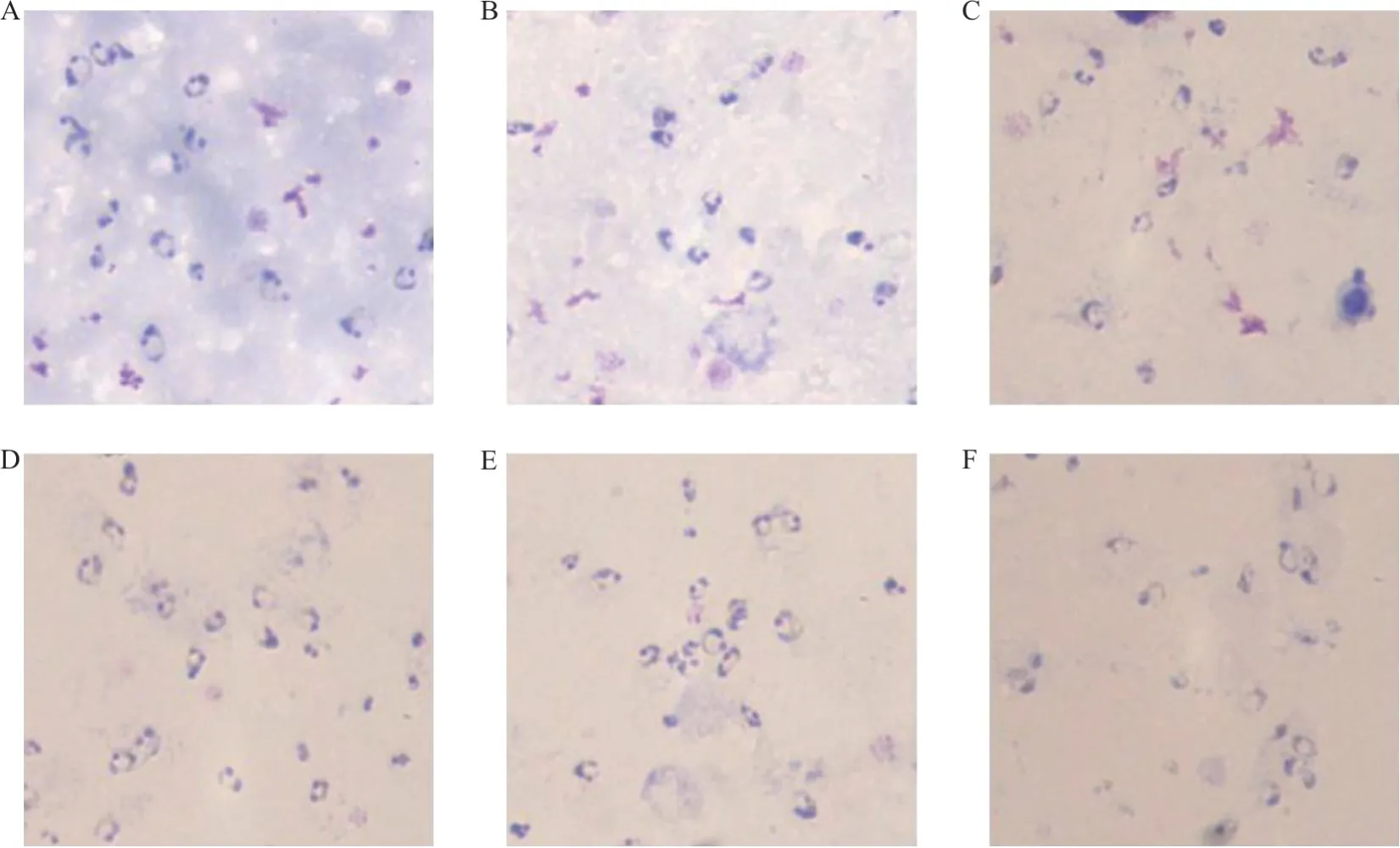
图1 瑞吉染液与缓冲液按不同比例稀释后染色效果(×1 000)
2.2 改良染色方法与传统染色方法、文献报道染色方法的比较
2.2.1 3种染色方法的脱膜实验比较 肉眼观察3种染色方法所染色厚血膜的脱膜情况,见图2,改良染色方法血膜固定效果更好,更不易脱膜,优于其他2种方法。改良染色方法的脱膜率低于传统染色方法(P<0.05),而改良染色方法与文献报道染色方法相比,脱膜率差异无统计学意义(P<0.05)。与传统方法相比,改良染色方法脱膜面积较小,多数为+和2+;而传统染色方法脱膜面积较大,多数为3+和4+,脱膜程度明显,见表1。

图2 3种染色法染色后的脱膜效果

表1 3种染色法染色后脱膜程度及脱膜率比较
2.2.2 3种染色方法的染色效果比较 见图3。传统染色法因采用蒸馏水溶血,造成虫体结构破坏,胞质分散不完整,同时在溶血冲水过程中会导致疟原虫丢失,背景杂质偏多,特别在疟原虫数量不多的情况下,对疟原虫的检出增加难度。文献报道染色法由于采用蒸馏水与瑞氏染液混合后染色,因其染色环境偏碱,虫体特别是疟原虫胞核染色较淡,背景呈蓝色云雾状,干扰疟原虫的检出。改良方法染色效果佳,易于观察,特别对疟原虫感染率较低时,因结构完整、结构清晰更有优势,易于检出。
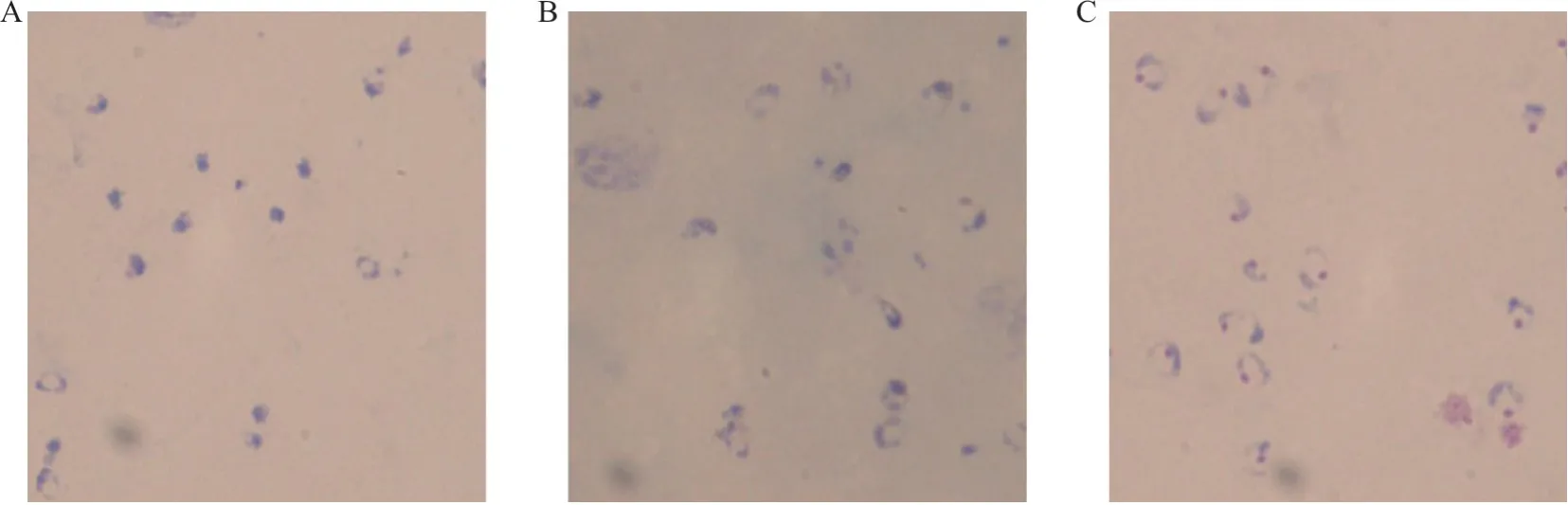
图3 3种染色方法的镜下染色效果(×1 000)
2.3 改良染色方法的重复性、稳定性评估结果 随机选取5名本实验室技术人员和5名实习学生采用此改良方法进行厚血膜染色,阴、阳性标本均染出了背景清晰、易于辨认的合格的厚血膜片;表明此染色方法重复性和稳定性好,易于掌握。
3 讨论
镜检疟原虫是诊断疟疾的金标准,也是目前国内外通用的最直接、最重要的检测方法,特别是厚血膜的镜检[5-7]。但是传统厚血膜染色方法,需要先用蒸馏水溶血再染色,溶血过程容易脱膜从而造成漏检,操作过程复杂费时,对于新手操作要求比较高,较难染出一张背景干净、虫体清晰的厚血膜片。也曾有同行尝试改良染色方法,其中有文献报道[5],先用瑞氏染液与蒸馏水按照患者血红蛋白的量选择合适比例制成待染液,染色后镜检。我们按相应操作重复以上实验发现,该方法脱膜现象不明显但背景不干净,影响虫体辨认;此外,瑞氏染液对胞核染色欠佳,虫体胞核着色普遍偏淡。
鉴于传统染色、文献报道染色法存在不足,以及厚血膜片染色对临床诊断的重要性,我们对厚血膜片的染色做了进一步改良发现,以1∶15的瑞吉染液与缓冲液混合后染色30 min效果最佳。首先,此改良方法优势首先在缓冲液的pH 6.6~6.8环境下,不但可以对红细胞起到很好的溶血作用,而且在一定程度上保持疟原虫虫体完整性,并且结构清晰、背景干净。其次,使用改良染色法省略了蒸馏水溶血的过程,简化了染色步骤,减少溶血及冲水过程中疟原虫的丢失,与传统染色方法比较,脱膜率明显降低。再者,该染色操作过程简单、可重复性强,仅需把瑞吉染液与缓冲液进行简单稀释后染色即可,此改良方法中所用的染液,其本质为瑞吉染液,其对疟原虫染色效果好,染色时间适中,临床上应用广泛,并且为商品化试剂,使用方便。
疟原虫厚血膜改良染色方法在一定程度上简化了染色过程,提高了疟原虫厚血膜的染色效果,但在染色过程中需要注意几个操作关键点:首先,制片时选用的玻片需要清洗后使用,防止脱膜;其次,厚血膜制备好,须做到充分干燥,可借助37℃温箱缩短干燥时间,以防止染色和冲水过程导致脱膜;另外,制备好的厚血膜要在48 h内完成染色,防止放置过久因血红蛋白变性而影响溶血效果。

