1 型自身免疫性胰腺炎的CT 和MRI 表现
余庆华,吴建满,陈少斌,范秋玲
(福建医科大学省立临床医学院/福建省立医院放射科,福建 福州 350001)
1 型自身免疫性胰腺炎(autoimmune pancreatitis,AIP)即免疫球蛋白IgG4 相关性AIP,属IgG4 相关性疾病,指一组可累及全身多个器官或组织的系统性、慢性疾病,以血清IgG4 水平升高、受累组织IgG4 阳性浆细胞或淋巴细胞浸润及纤维化为特征,最常累及胰腺、泪腺和涎腺[1-2]。1 型AIP 多见于亚洲人,好发于老年男性。日本流行病学研究显示,AIP 年发病率约0.9/10 万[3],由于临床表现缺乏特异性,易被误诊,影像检查在其诊断中有重要价值[4-5]。本文回顾性分析我院2012—2018 年收治的22 例1 型AIP 患者的CT 及MRI 表现,以期进一步加深对其影像表现的认识,降低误诊率。
1 资料与方法
1.1 一般资料 本组22 例均符合文献推荐的诊断标准[5],其中男19 例,女3 例;年龄33~76 岁,平均(58.4±13.1)岁。临床表现主要为腹痛(14 例,63.6%)、黄疸(15 例,68.2%)、消瘦(7 例,31.8%)、腹胀(7 例,31.8%)、乏力及纳差(7 例,31.8%)等症状。
1.2 仪器与方法 22 例中12 例行CT 检查,21 例行MRI 检查,11 例均行CT 及MRI 检查,1 例未行增强扫描,20 例行MRCP 检查。
1.2.1 CT 检查 采用Siemens Definition 64 或Force CT 扫描仪。扫描参数:120 kV,120~150 mA 或自动管电流(CARE DOSE 4D),1.5 mm 无间隔薄层扫描,螺距1.2,图像重建层厚均为3 mm。增强扫描使用高压注射器经肘静脉注射碘对比剂碘普罗胺注射液(碘含量300 mg/mL),剂量1.5~2.0 mL/kg 体质量,流率3.0 mL/s。动脉期采用主动脉智能监测触发,延迟60、120 s 行动脉期、延迟期扫描。
1.2.2 MRI 检查 采用Philips Achieva 1.5 T MRI或Siemens Verio 3.0 T MRI 扫描仪。1.5 T MRI 的扫描序列为横断面SPIR T2WI TR 902.7 ms,TE 100 ms;正反相位FFE T1WI TR 175.1 ms,TE 2.3 ms/4.6 ms;冠状面或横断面BTFE T2WI TR 3.4 ms/3.2 ms,TE 1.7 ms/1.6 ms;DWI 的b 值取0、600、1 200 s/mm2;脂肪抑制T1WI THRIVE 增强扫描序列TR 3.95 ms,TE 1.87 ms;以上序列层厚均为6 mm。3.0 T MRI 扫描序列为横断TSE T2WI 脂肪抑制序列TR 5 327.5 ms,TE 78 ms;正反相位T1WI TR 219 ms,TE 2.31 ms/3.69 ms;横断面或冠状面T2WI-Haste TR 1 100 ms/650 ms,TE 91 ms/92 ms;DWI 的b 值取0、800、1 200 s/mm2;脂肪抑制T1WI Vibe 增强扫描序列TR 3.92 ms,TE 1.39 ms;以上序列层厚均为4 mm。
1.2.3 MRCP 检查 采用3D-MRCP 成像。增强扫描经肘静脉注射Gd-DTPA 注射液(0.5 mmol/mL),剂量0.2 mmol/kg 体质量,流率2.0~3.0 mL/s,采用左心室监测触发行动脉期扫描,之后再连续5 次扫描以覆盖门脉期及延迟期。
1.3 观察指标 ①胰腺形态:无改变,弥漫性肿大(肿大>1/3 胰腺),局限性肿大(<1/3 胰腺);②胰腺平扫密度或信号:无改变,密度或信号降低/升高;③胰腺强化程度或方式:无改变,动脉期强化减弱/增强、渐进性强化,均匀/不均匀强化;④胰腺边缘:清楚/毛糙,增强扫描后见相对低密度环/延迟强化环;⑤胰管改变:扩张(均匀/不均匀)/狭窄(均匀/不均匀、串珠状),管径测量(测量最宽处或最窄处的直径);⑥胆管受累情况:胆管狭窄部位单发或多发(位置分为肝内胆管、肝门部胆管、胆总管十二指肠上段、胆总管十二指肠后段、胆总管胰腺段、胆总管壶腹段),胆管壁增厚(均匀/不均匀),管壁强化;⑦胰管或胆管狭窄形态:移行性或截断性、肿块内穿行;⑧胆总管及肝内胆管扩张程度:轻度(胆总管直径8~10 mm)、中度(胆总管直径>10~13 mm)、重度(胆总管直径>13 mm),扩张形态均匀/不均匀;⑨是否合并腹膜后纤维化,以及系膜、腹膜后淋巴结肿大等;⑩治疗后复查:对比观察胰腺形态及信号/密度改变,胰管及胆管形态、强化程度改变。
1.4 图像分析 由2 位高年资医师在不知晓病理结果下独立分析,意见不统一时,讨论达成一致。
2 结果
2.1 临床资料 22 例中,21 例行血清IgG4 检查,其中18 例(85.7%)升高,3.41~61.00 g/L(正常值0.03~2.00 g/L),平均(13.27±14.30)g/L。20 例行糖类抗原19-9(CA19-9)检查,11 例(55.0%)升高,27.85~2 932.00 kU/L(正常值<27.00 kU/L)。4 例累及其他脏器(3 例合并硬化性胆管炎、1 例腹膜后纤维化)。所有患者均接受激素治疗,治疗后临床症状改善、血清学指标均好转。
2.2 影像表现 ①胰腺形态改变:22 例中,弥漫性肿大18 例(81.8%)(图1),局限性肿大4 例(18.2%)(图2)。②胰腺密度/信号改变:CT 平扫胰腺密度降低12 例(100.0%,12/12);T2WI 信号升高17 例(81.0%,17/21);DWI 信号升高、ADC 值降低16 例(76.2%,16/21);动脉期强化减弱、延迟期呈渐进性强化21 例(100.0%,21/21);10 例(47.6%,10/21)胰周可见T2WI 低信号环、腊肠征(图1)。③胰管、胆管形态改变:22 例中,胰管扩张4 例(18.2%);累及胆总管15 例(68.2%),表现为胆管壁均匀增厚、腔内面光整;肝门区肿块样增厚2 例(9.1%)。22 例均合并胆管狭窄,20 例(90.9%)单发,位于胆总管胰腺段(77.3%,17/22),肝门部胆管2 例,胆总管十二指肠上段1 例,肝内肝外均有狭窄1 例,累及肝门部胆管及胆总管胰腺段1 例;移行性狭窄16 例(72.7%)和截断性狭窄6 例(27.3%)(图2);2 例呈导管穿行征。继发肝内外胆管扩张14 例(63.6%),多为轻度扩张;部分胆总管为重度扩张,最大径19.8 mm。④22 例中,12 例(54.5%)出现腹膜后淋巴结肿大。⑤22 例治疗后复查均表现为胰腺形态、T2WI 信号恢复正常(图1g,1h),胆管壁增厚较前改善,胆管扩张较前改善,淋巴结较前减少、缩小。
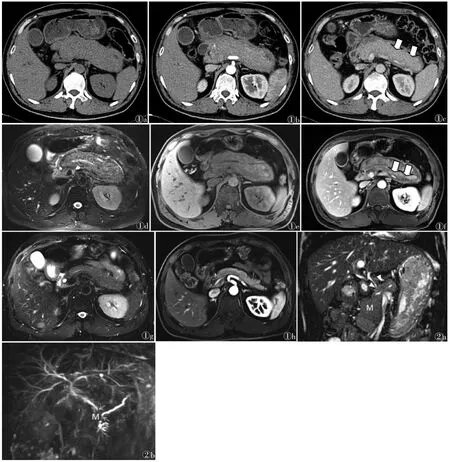
图1 男,48 岁,1 型自身免疫性胰腺炎(AIP),腹痛,IgG4 29.3 g/L,CA19-9 11.12 kU/L 图1a~1c 分别为CT 平扫、动脉期及延迟期图像,可见胰腺弥漫性肿大,平扫密度降低,动脉期明显强化减弱,延迟期呈渐进性均匀强化,病变周围可见典型的腊肠征(箭) 图1d,1f 胰腺T2WI 信号升高及T1WI 信号降低,胰管轻度扩张,胰周见环形T2WI 低信号,形似包膜 图1g,1h 激素治疗1 年后随访MRI 示胰腺形态、信号及血流动力学恢复正常,胰周异常信号完全吸收 图2 男,68 岁,1 型AIP,黄疸、腹痛、腹胀,IgG4 6.03 g/L,CA19-9 98.26 kU/L 图2a T2WI 冠状位示胰头局限性肿大(M),略呈等信号,胰腺体尾部形态正常(箭头) 图2b MRCP 示胆管及胰管胰头处截断(箭头),肝内外胆管及胰管轻度扩张
3 讨论
3.1 AIP 的临床特点 AIP 的概念是由Yoshida 等[6]在1995 年首次提出。由于该病发病率不高,目前很多临床医师对其认识仍不足。AIP 分为1 型AIP(IgG4 相关性胰腺炎)和2 型AIP(特发性导管中心性胰腺炎),1 型AIP 常缺乏特异的临床表现,主要表现为梗阻性黄疸、腹部不适、体质量减轻和血糖升高等,男性患者明显多于女性,好发年龄在60~70 岁[3,7]。我国1 型AIP 最常见[7],本研究也局限于1型AIP。本组22 例临床主要表现为黄疸、腹痛、腹胀、消瘦,男女比例6.3∶1,平均年龄(58.4±13.1)岁,符合既往文献报道。1 型AIP 常累及胰腺外器官,胆道多见,本组继发胆管管壁增厚15 例,占68.2%。
1 型AIP 患者常伴血清IgG4 水平升高,血清IgG4 水平被视为诊断1 型AIP 的标志物[7],其诊断及鉴别诊断1 型AIP 的准确率和特异度均较高,但敏感度稍低。有研究显示,以2 倍的IgG4 正常值上限来诊断1 型AIP,特异度可达99%[8]。本组85.7%(18/21)患者血清IgG4 升高。CA19-9 作为肝胆胰肿瘤的血清标志物,在1 型AIP 患者中也常出现升高。本组20 例行CA19-9 检查,11 例(55.0%)升高,最高达2 932.00 kU/L。CA19-9 辅助鉴别AIP 与胰腺癌的价值有限[9],其显著升高不利于鉴别诊断,尤其在鉴别肿块型AIP 与胰腺癌时,更易误诊为后者。
3.2 AIP 的影像学表现 有学者将AIP 胰腺形态划分为弥漫肿大型、局限肿块型、混合型(弥漫肿大伴局部肿块)及无明显变化[10]。由于临床上少见混合型,且这种形态划分主观性较强,不同观察者评价难以一致,临床意义不显著,所以本研究将AIP 胰腺形态划分为弥漫肿大型和局限肿块型。本组弥漫肿大型占81.8%(18/22),肿块型占18.2%(4/22)。病理上,胰腺肿大主要是由于淋巴细胞及炎性细胞的浸润导致,炎症易引起胰腺边缘渗出、周围脂肪炎症纤维化,影像上易形成病变胰腺周围低密度环或T2WI 低信号环,增厚呈延迟强化,似包膜,又称为腊肠征、晕环征、假包膜征及鞘膜征等,该征象对提示AIP 有重要的参考价值[11]。本组10 例出现此征象。由于胰腺实质细胞的破坏、炎症及水肿,常使胰腺平扫密度或T1WI信号降低,T2WI 信号升高,本组除4 例胰腺信号改变不明显外,其余均表现为密度降低T2WI 信号升高。
AIP 可导致胰腺实质血流动力学改变。在动脉期,病变区胰腺组织灌注明显低正常胰腺组织,表现为强化明显减弱,而3 期动态增强扫描呈渐进性强化。本组21 例MRI 增强扫描患者病变均表现为动脉期强化减弱,延迟期呈渐进性均匀强化。虽然胰腺癌也表现为渐进性强化,但多数强化程度不如AIP,延迟期密度低于胰腺组织,这种差异有一定的鉴别诊断价值[12]。
AIP 的主胰管改变具有一定的特征性,常表现为狭窄,尤其是长的狭窄更具特征性[10,13-14],有别于恶性肿瘤的局限性狭窄。MRCP 易受呼吸运动干扰,影响对主胰管的显示。本组20 例行MRCP 成像,仅显示2 例胰管粗细不均,2 例胰管轻度扩张。MRCP对单发主胰管轻度狭窄的显示能力明显不足。
1 型AIP 除累及胰腺外,易累及胆管,常导致受累胆管壁均匀增厚,少数可见肿块形成,极易误诊为胆管癌。AIP 导致的管壁增厚,病理表现为胆管壁炎性细胞浸润、纤维化;影像上常表现为管壁均匀增厚、受累胆管范围较长,且腔内面光整,与胆管癌不同[10]。AIP 易导致胆管狭窄,狭窄主要是由胰腺肿胀的压迫效应和受累胆管管壁增厚所致。胰腺肿胀易压迫胆总管胰腺段,导致该段胆管狭窄,本组发生率高达77.3%(17/22),与朱捷等[15]研究结果相似。胆管良性狭窄多表现为移行性狭窄或鸟嘴样狭窄,恶性狭窄多表现为截断性狭窄;本组6 例(27.3%)表现为胆管截断性狭窄,高于以往文献报道。其中本组2 例表现为肝门区肿块样增厚伴管腔明显狭窄,术前被误诊为胆管癌。4 例继发性肝内外胆管扩张程度均不如恶性狭窄明显,结合患者胰腺的表现,有助于鉴别诊断。同时,有时还可见狭窄的胆管或胰管穿行于病变胰腺,形成穿行征,有一定的特征性[10],本组仅2 例有此征象。
大多AIP 的胰腺表现为DWI 信号升高,ADC 信号降低,与胰腺癌表现类似。一项Meta 分析显示,定量DWI 有助于鉴别胰腺良恶性肿块,诊断敏感度和特异度高达91%和86%[16]。胰腺癌的ADC 值通常比AIP 低,但部分AIP 也可表现为低ADC 值。
AIP 可引起腹膜后淋巴结肿大,国外文献报道中并不常见。本组淋巴结肿大12 例(54.5%),与国外报道有较明显差异,但与丛冠宁等[17]报道的60%相近。这种反应性淋巴结增生,可能与群体差异及慢性炎症病情时间有关。在临床工作中需注意AIP 患者也易有腹膜后淋巴结肿大。一般来说,反应性淋巴结表现为不融合、边界清楚、均匀强化的结节;而转移性淋巴结表现为易融合、强化不均匀的结节,可侵犯邻近的组织结构。
总之,1 型AIP 有相对特征的影像学表现,常表现为胰腺弥漫性肿大;CT 平扫密度降低或T2WI 信号升高,MRI 增强扫描动脉期强化明显减弱、延迟期呈渐进性延迟均匀强化,可见特征性的腊肠征;易引起邻近的胆管狭窄,多表现为移行性狭窄,部分可见相对特异征象即胆管或胰管穿行征;易累及胆管,表现为胆管壁的长范围的均匀增厚、强化、狭窄,但管壁内面光整,多数继发轻度胆管扩张。熟悉这些征象,有助于减少误诊。

