TA3有限接触动态加压接骨板断口分析与失效机制
郑 靖 ,饶少凯 ,周 均 ,杨 丹 ,沈黎新 ,黄书浩
(1. 西南交通大学材料先进技术教育部重点实验室,四川 成都 610031;2. 浙江省医疗器械检验研究院,浙江 杭州310018)
随着社会的不断发展,车祸、外伤、疾病、人口老龄化等原因导致骨折患者不断增多. 而股骨是人类最大最典型的长管状骨,由于其特有的曲拱状生理特征和强大的承载力,被认为是人体最易发生骨折的骨之一[1]. 接骨板是临床治疗骨折的辅助工具,当骨骼发生断裂时,接骨板可以起到“桥梁”作用,通过外力使骨折处重新连接并愈合. 接骨板作为最典型的医疗植入物之一,它的设计常常受到解剖学和生理学的限制,如尺寸、刚度和生物相容性[2].
纯钛及其合金因其耐腐蚀性能和生物相容性优良、密度小、弹性模量低等特点,被广泛用作接骨板材料[3-5]. 然而,由于人体内复杂的生理环境和力学条件,纯钛接骨板仍然会发生失效,其中,接骨板断裂失效是最恶劣的情况,会给患者带来巨大的生理及心理创伤[6-7]. 失效分析是工程设计过程中的一个重要环节,对骨科植入医疗器械接骨板的失效分析可以更好地推动其发展与应用. 因此,很有必要系统地研究纯钛接骨板的临床断裂失效问题,研究结果将为骨折植入医疗器械的优化设计与制造管理提供理论支撑,对提高接骨板在患者体内服役的可靠性研究具有重大意义.
目前,许多国内外学者[3,4, 6-14]就骨科植入物接骨板的断裂失效做过相关分析研究. 接骨板的材质主要有不锈钢、钛及其合金、钴铬合金等,失效形式主要有异物损伤、疲劳失效、应力腐蚀开裂、腐蚀钝化、微动损伤、蠕变、腐蚀、空穴等. 王荣等[3]分析研究一例断裂失效的人体股骨TA3纯钛接骨板发现,不当的阳极氧化处理会使接骨板表面形成点蚀坑,在应力作用下点蚀坑处产生微裂纹,最后扩展导致接骨板断裂;李荣等[4]研究TA3纯钛板材发现,板材表面富氧形成的硬脆污染层在变形时极易产生微裂纹,从而导致钛合金接骨板在使用过程中发生断裂;周梦林[5]通过体外模拟试验发现,TA3接骨板表面存在一定的加工缺陷是导致接骨板发生断裂的主要原因,其断口表面平整,呈准解理态,疲劳辉纹间距较小且存在二次裂纹. 国外研究学者[6,9-14]通过研究断裂316L不锈钢接骨板发现,植入物中的杂质、相关化学元素成分不达标、加工缺陷、结构稳定性差导致的过载等因素均是导致其发生断裂的主要原因,不过都伴随着疲劳断裂的特征,断口表面有明显的疲劳辉纹和二次裂纹;Azevedo[7]通过分析断裂的纯钛接骨板金相组织发现,等轴α相和沿晶β相在复杂体液环境中,沿晶β相处优先发生失效,进而产生应力集中直至断裂. 另外部分研究[10,13-14]根据接骨板断口表面中的疲劳辉纹间距计算接骨板疲劳循环次数,通过有限元仿真估算接骨板的使用寿命,结果发现过早下地行走使得接骨板过度受载,导致骨折未充分愈合前接骨板发生断裂. 部分研究者[5,11, 15]通过表面氮化处理提高种植体的抗疲劳性能或开发新型镁合金接骨板和高分子材料接骨板,减小植入物的弹性模量,以降低应力遮挡效应,降低接骨板的失效率.
本研究结合实验测试与仿真分析,针对7个在人体股骨中段骨折内固定服役过程中发生断裂的10孔TA3纯钛有限接触动态加压接骨板(LC-DCP),进行断裂失效分析. 为进一步探明接骨板在骨折愈合全阶段的潜在失效原因,基于骨折块愈合理论,通过有限元建模及迭代计算获取接骨板在人体股骨骨折内固定全过程中的应力场,分析不同骨折间隙对接骨板断裂失效的影响规律.
1 试验材料与方法
1.1 试验材料
7个10孔TA3纯钛LC-DCP样品均是从医院收集的,并且均是在治愈人体股骨中段骨折期间发生断裂. 经过杀菌消毒处理后,对这7个样品进行编号,排序为1#、2#、3#、4#、5#、6#、7#,图1为1号接骨板,将所有接骨板螺钉孔由股骨近端往远端依次排序为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅸ、Ⅹ,观察发现,所有接骨板均是在Ⅵ孔右侧发生断裂.
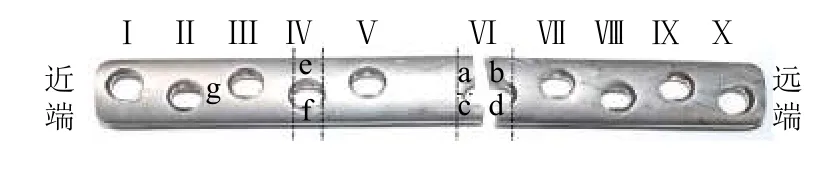
图1 1# TA3纯钛LC-DCPFig. 1 1# TA3 pure titanium LC-DCP
所有样品均按照相同的预处理方法,具体如下:用线切割机沿图1所示黑色虚线对接骨板进行切割,并根据切割位置依次编号为试样a、b、c、d、e、f、g;然后,将所有样品块放入丙酮溶液中浸泡30 min,去除样品表面的有机物;再将样品块放入盛有无水乙醇溶液的烧杯中超声清洗10 min,每个接骨板样品的试样a、c用于断口形貌测试分析;将试样b、d、e、f用冷嵌料亚克力树脂进行包埋,经400#、800#、1500#、2500# 砂纸逐级打磨,然后再依次用3.5、1.5、0.5 μm的金刚石抛光膏在水冷却下抛光至光镜下观察无明显划痕,最后用无水乙醇溶液超声清洗,用于维氏硬度测试和晶粒度测试;试样g用于化学成分测试.
1.2 表征方法
采用碳硫分析仪(德凯HCS-140)、氧氮氢联合测定仪(力可TCH600S)、等离子发射光谱仪(赛默飞ICP6300)分析每个接骨板试样的化学成分;利用HXD-1000TM型显微硬度仪测定试样表面维氏硬度,载荷10 kg,保压15 s,室温25 ℃,每个试样表面测10~20个值;使用氢氟酸、硝酸混合水溶液腐蚀包埋试样,腐蚀时间为30 s,试样腐蚀后用OYLMPUSB201型光学显微镜观测金相组织;使用扫描电镜(FEI,QUANTA200)表征接骨板断口表面形貌,使用其配套的能谱仪(EDAX PV7760/68 ME)表征断口表面微区元素成分.
1.3 有限元仿真计算
为进一步探究接骨板在骨折愈合期间发生非正常失效的原因,本研究通过建立接骨板、接骨螺钉与股骨的三维模型,考虑骨折后不同阶段骨痂的愈合效率变化,获取接骨板在服役期间的最大剪切应力,分析可能断裂部位并与试验样品断裂状态进行对比.
以10孔接骨板为例进行仿真计算,采用一位体重70 kg的青年男子右侧股骨CT数据. 首先,将CT数据导入到Mimics20.0进行三维重建获取人体股骨三维模型;然后将该模型导入Geomagic Studio12.0进行曲面光滑处理;利用3-matic12.0中Hollow命令处理光滑股骨模型生成松质骨与皮质骨模型,并将其导入UG10.0中与已经建好的LCDCP接骨板和简化接骨螺钉进行装配,得到装配模型如图2(a). 最后利用ANSYS Workbench15.0,进一步完善装配模型,得到如图2(b)所示的LCDCP接骨板固定股骨干中段横形骨折的三维有限元模型,其中:F1为轴向压缩力;F2为螺钉固定接骨板的预紧力.
股骨是下肢中主要的负重骨,其主要的受力形式为轴向压缩力F1[16-19]. 术后初期(前8周),患者的行动需借助助步器或拐杖,F1大小为体重的1/10,即70 N;从第9周开始,患者通常可以在没有特殊支持的情况下行走,F1将上升至体重的2倍,即1400 N.正常站立情况下,最大轴向力与体重相等,即700 N.整个内固定系统的约束和加载条件简化为对股骨远端施加完全固定约束. 根据临床实际情况[16-18],本文将螺钉-接骨板、螺钉-股骨的接触方式定义为绑定,将接骨板-股骨的接触定义为有摩擦的接触,摩擦系数为0.4[20-21],且本研究中螺钉固定接骨板的预紧力F2为2000 N.
将股骨、接骨板与接骨螺钉离散为六面体单元,接骨板、接骨螺钉与股骨骨折部分网格尺寸设定为0.5 mm,包含接触部分的股骨网格尺寸为1.0 mm,不包含接触部分的股骨网格尺寸为5.0 mm,网格模型如图2(c)所示.

图2 股骨骨折内固定系统的有限元模型Fig. 2 Finite element model of internal fixation system for femoral fracture
股骨模型包括外围包裹的皮质骨和中心的松质骨部分:皮质骨致密,呈正交各向异性,且纵向弹性模量高于横向和径向;松质骨疏松多孔,呈各向同性,弹性模量较皮质骨低. 接骨板和螺钉材质为TA3纯钛,假定材料均质且各向同性. 各部件的弹性力学参数见表1[2,22],所有部件均为连续材料,假设为小变形.
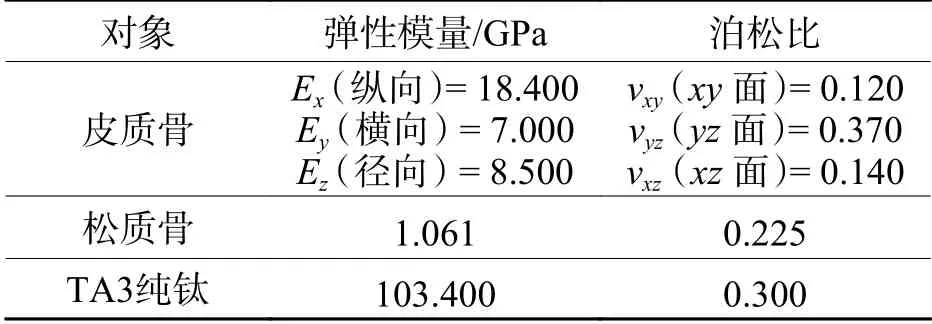
表 1 股骨和TA3纯钛的材料参数Tab. 1 Material parameters of femur and TA3 pure titanium
由于TA3纯钛是一种塑性材料,其屈服破坏准则服从第三强度理论,即最大剪切应力 τmax达到极限值,材料发生破坏[23],如式(1).

式中:σ1和 σ3分别为最大和最小主应力;[τ]为材料许用屈服强度,TA3纯钛材料的屈服强度极限为380 MPa[2].
中间愈伤组织的材料性质跟愈合时间密切相关,在有限元模型中,采用“平均弹性模量”定义其材料属性. 根据骨折块应变理论[18,21,24-25],假定骨折块应变在2%~10%范围的区域内,骨痂的弹性模量将发生更新并达到最佳状态,而应变不在该范围内的区域,骨痂的弹性模量将保持上一阶段的数值不变. 将皮质骨(松质骨)应变ε在 2%~10%范围内的区域面积SCC(SCT)与皮质骨(松质骨)骨折断端截面面积SC(ST)的比值定义为愈合速率λ(μ),如式(2).

为了完成整个迭代过程,将平均弹性模量(式(3))定义为计算模型的输入值,平均弹性模量算法过程如图3,其中:SAT、SAC分别为骨折块应变不在 2%~10%区间时松质骨、皮质骨的截面面积.
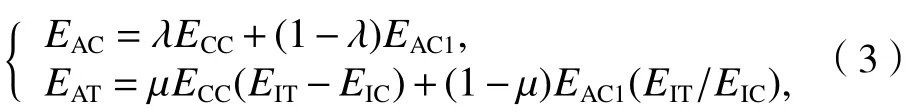
式中:EAC、EAT分别为皮质骨和松质骨的平均弹性模量;EIT、EIC分别为正常的松质骨和皮质骨的弹性模量;EAC1为前一阶段皮质骨的平均弹性模量;ECC为当前愈合阶段皮质骨的弹性模量.
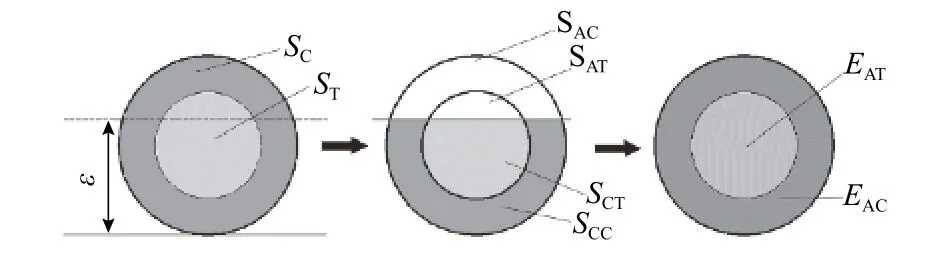
图3 平均弹性模量算法示意Fig. 3 Concept of the averaged callus property.
2 结果与讨论
2.1 化学成分
表2为7个TA3纯钛LC-DCP样品主要化学成分的测定结果,根据GB/T 13810—2007《外科植入物用钛及钛合金加工材》及相关标准的要求对比发现,所有接骨板样品的材质在化学元素组成和含量上符合标准要求[26].
2.2 维氏硬度
表3为7个TA3纯钛LC-DCP样品在10 kg力作用下的表面维氏硬度,根据YY 0017—2016《骨接合植入物 金属接骨板》及相关标准的要求(TA3纯钛材料维氏硬度值(HV10) ≥ 150)对比发现,同一根接骨板靠近断口处的维氏硬度值与基体处的维氏硬度值几乎相等,偏差不超过2.93%,且均符合相关标准规定.
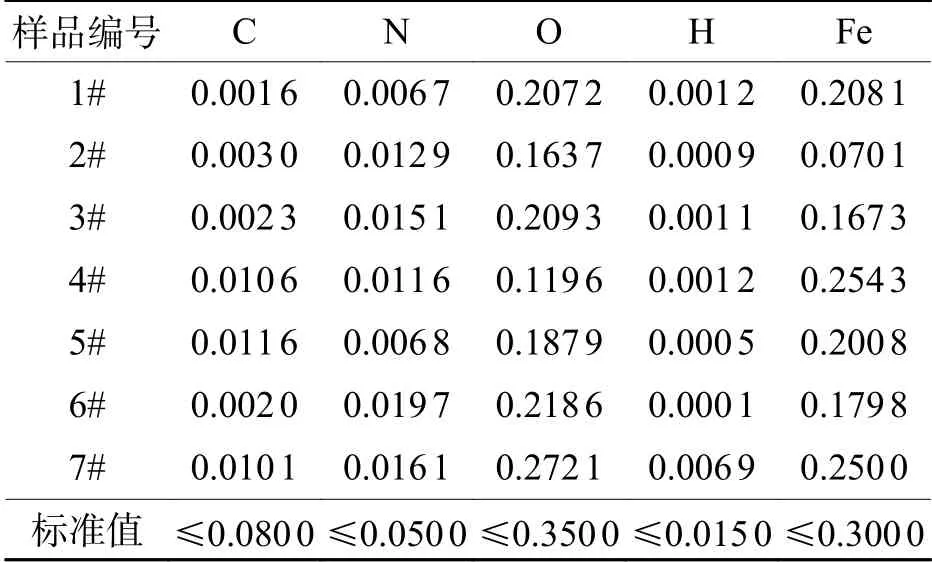
表 2 TA3纯钛LC-DCP的化学成分(质量分数)Tab. 2 Chemical compositions ofTA3 pure titanium LC-DCP (mass) %

表 3 TA3纯钛DCP接骨板的维氏硬度(HV10)Tab. 3 Vickers hardness of TA3 pure titanium DCP bone plates (HV10)
2.3 金相分析
断口附近的金相组织见图4(a),远离断口的基体处金相组织见图4(b),断口附近的金相组织和远离断口的基体处相同,未见组织变形和其它明显异常. 按照GB/T 6394—2002《金属平均晶粒度测定方法》中规定的方法进行评定,表4给出了每根接骨板基体处和断口附近的平均晶粒度,所有接骨板均符合“平均晶粒度不粗于GB/T 6394—2002中5级”的技术要求. 靠近断口处的平均晶粒度与基体处的平均晶粒度几乎相等,偏差不超过1.43%,均符合相关标准规定.
2.4 断口形貌
2.4.1 宏观断口形貌
肉眼观察发现,所有接骨板表面呈深灰色,颜色比较均匀,所有接骨板断口表面均比较平整,与其正面接近垂直.

图4 TA3纯钛LC-DCP接骨板金相组织形貌Fig. 4 Metallographic morphology of TA3 pure titanium DCP bone plates
图5为扫描电子显微镜低倍数下得到的典型接骨板断口表面形貌,可以发现,所有接骨板断口表面均有一定程度的磨损,断口表面周边磨损程度比中间严重,但是仍然能看清裂纹扩展路径,如图5(a)、(b)所示,裂纹的扩展条纹呈放射状,放射状裂纹扩展路径收敛于接骨板外表面与螺钉孔表面交汇处,裂纹源区(CI)、裂纹扩展区(CP)和瞬时断裂区(IF)的位置分布明显. 在人体内复杂的力学环境下,裂纹从CI区慢慢地向CP区扩展再往IF区过度,IF区有明显的折断现象,期间两断裂面会因相互接触而产生轻微磨损现象,部分样品断口表面磨损严重,尤其是在瞬时断裂区,裂纹扩展路径被磨光,裂纹源区及扩展区信息遭到严重破坏(图5(c)).

表 4 TA3纯钛LC-DCP接骨板的平均晶粒度Tab. 4 Averaged grain size of TA3 pure titanium LC-DCP bone plates

图5 典型接骨板断口表面宏观形貌Fig. 5 Macroscopic morphology of fracture surface of typical bone plates
2.4.2 微观断口形貌
图6为1# 样品断口微观形貌,由图6可知:断裂源区有轻微的磨损现象,裂纹形状类似于准解理态,相互平行的疲劳辉纹和二次裂纹是疲劳断裂的明显特征;裂纹扩展区可以发现明显的沿晶扩展裂纹,裂纹扩展路径最清晰,呈解理态,属于脆性断裂,且伴随有相互平行的疲劳辉纹和二次裂纹;瞬时断裂区可以观察到严重的磨损现象,未磨区可以看到类似于准解理态裂纹,与裂纹源区和裂纹扩展区类似,有相互平行的疲劳辉纹和二次裂纹.
进一步对7个接骨板进行宏微观断口分析,并对所有断口表面裂纹源区、裂纹扩展区和瞬时断裂区进行微区面扫能谱检测,结果如图7所示,接骨板1# 样品断口表面3个不同区域均含有Ti、C、O、Ca等元素,并且没有明显差异,其中C、O、Ca均为人体内组织元素,由此可见,在接骨板断口表面并没有腐蚀产物,可以排除腐蚀破坏.


图6 典型接骨板断口微观形貌Fig. 6 Microscopic morphology of fracture surface of typical bone plates
2.5 有限元分析
表5是基于骨折块愈合理论计算得到的手术后4周和8周两个愈合阶段,不同骨折间隙宽度时中间骨痂皮质骨和松质骨平均弹性模量和愈合效率. 由表5可知:不同骨折间隙时,皮质骨与松质骨的愈合效率均不相同;当骨折间隙为3 mm时,皮质骨与松质骨的愈合效率最高,对应的平均弹性模量最高;骨折间隙为1、8、9、10 mm时,皮质骨与松质骨的愈合效率较低,其愈合效果较差;术后8周的与术后4周相比,在不下地行走的情况下,相同骨折间隙宽度时皮质骨与松质骨的愈合效率接近相等.

图7 断口表面不同区域能谱仪(EDS)图谱Fig. 7 Energy dispersive spectrometer spectra of different zones in the fractured surface

表5 术后4周、8周中间骨痂的材料属性Tab. 5 Calculated material properties of the callus 4 and 8 weeks after surgery
断口分析发现接骨板样品的断裂均是始于远骨侧表面,向近骨侧扩展. 图8分别为不同骨折间隙宽度、不同愈合阶段,轴向压缩力为70 、700 、1400 N时接骨板远骨侧表面所受最大剪切应力. 由图8可知:相同轴向载荷时,术后4周时接骨板远骨侧表面最大剪切应力与术后8周时的基本相等,而术后12周时接骨板远骨侧表面最大剪切应力比前两个愈合阶段小得多;当轴向载荷为1400 N时,即患者提早下地行走时,术后4周和术后8周时接骨板远骨侧表面最大剪切应力接近600 MPa,远超过TA3纯钛材料的屈服强度极限;由于术后12周时骨折处骨痂的弹性模量比前两个阶段大,骨痂承载能力增强,减缓应力遮挡程度,使得术后12周接骨板远骨侧表面最大剪切应力比术后8周和术后4周时的小得多. 根据表5中的结果可知,不同骨折间隙宽度时,骨折处骨痂皮质骨与松质骨的愈合效率不同,骨痂皮质骨与松质骨的弹性模量不同,愈合效率越高,弹性模量越大,到9~12周时,接骨板远骨侧表面最大剪切应力也就越小.

图8 接骨板远骨侧表面的最大剪切应力Fig. 8 Maximum shear stress on the distal surface of bone plates
轴向载荷为70、700 N时,不同愈合阶段,接骨板远骨侧表面最大剪切应力均小于TA3纯钛材料的屈服强度极限,不会导致其发生失效破坏;而轴向载荷为1400 N时,由于0~4周和5~8周两个愈合阶段,中间骨痂皮质骨和松质骨的弹性模量太小,承载能力太弱,导致接骨板远骨侧表面最大剪切应力超过TA3纯钛材料的屈服强度极限,而9~12周这一愈合阶段中间骨痂皮质骨和松质骨的弹性模量较前期有所增大,承载能力变强,导致接骨板远骨侧表面最大剪切应力比前两个阶段小得多,只有骨折间隙宽度大于7 mm时,最大剪切应力才超过TA3纯钛材料的屈服强度极限.
图9为有限元计算结果中最大剪切应力的云图(十孔接骨板,骨折间隙为5 mm),图9显示:如最大剪切应力出现在第5和第6螺钉孔右侧边缘处. 其中,只有在9~12周愈合阶段,当轴向载荷为70 N,骨折间隙小于8 mm时,接骨板远骨侧表面最大剪切应力位于第5螺钉孔处右侧边缘,且位置相同;其他情况下,接骨板远骨侧表面最大剪切应力均位于第6螺钉孔处右侧边缘,位置相同.
2.6 讨 论
国内外研究学者通过对金属接骨板的断裂失效分析发现,接骨板中的杂质、化学成分不达标、加工缺陷、结构稳定性差导致过载等因素均有可能导致接骨板发生失效破坏,甚至断裂.
本研究的理化性能检验分析结果显示:7个TA3纯钛LC-DCP接骨板样品的化学元素组成、表面硬度、组织晶粒度均符合GB/T 13810—2007《外科植入物用钛及钛合金加工材》和YY 0017—2016《骨接合植入物 金属接骨板》的要求,说明这7个接骨板的材质合格,接骨板的断裂原因与材质无关.进一步宏微观断口分析及能谱检测结果表明,断口表面没有出现腐蚀性元素,并且不同区域无明显差异,因此,可以认为接骨板断口表面没有腐蚀产物,排除腐蚀破坏. 所有接骨板样品表面颜色均匀,无明显损伤和腐蚀特征,说明接骨板成品库存和运输期间未受到侵害;所有接骨板样品是沿其中段螺钉孔处发生断裂,裂纹是从远骨侧向近骨侧扩展;所有接骨板样品断口表面和轴线方向垂直,比较平整,扩展裂纹呈解理状,表明该断裂具有脆性断裂的特征;所有接骨板样品断口表面相互平行的疲劳辉纹和二次裂纹,且疲劳辉纹之间的间距由裂纹源区到裂纹扩展区和瞬时断裂区,依次增大,可见裂纹扩展速度在3个不同区域依次变快,由此可以认定7个接骨板样品断裂失效均属于疲劳失效.
为了进一步探明7个TA3纯钛LC-DCP接骨板样品的断裂原因,基于骨折块愈合理论,通过有限元仿真模拟不同骨折间隙宽度、不同愈合阶段,在不同轴向载荷作用下骨痂的愈合情况和接骨板的受力情况. 由仿真结果可以推断出,只要术后8周不提早下地行走,即0~4周,轴向载荷为70 N,5~8周,轴向载荷为70 N,接骨板远骨侧表面最大剪切应力就远远小于TA3纯钛材料的屈服强度极限,即不会发生应力破坏;最容易发生失效的位置在第6螺钉孔右边缘处,这与实际临床上接骨板发生断裂的位置一致,由此可以断定接骨板断裂是由于提早下地行走引起的.
骨折间隙较大时(8、9、10 mm),愈合效率较低,即使术后8周不下地行走,骨痂后期仍然不能充分愈合,最终导致接骨板受载超过其材料屈服强度极限,可以认为是骨折固定方式不恰当,应该考虑选用新的愈合固定方式.
综上所述,LC-DCP接骨板在其服役过程中,由于提早下地行走等原因导致过载,使得接骨板远骨侧表面萌生裂纹,随后承受循环疲劳载荷,导致断裂失效.
3 结 论
1) 通过化学成分分析、材料表面硬度分析和平均晶粒度分析,表明这批接骨板的材质符合相关标准要求.
2) 本研究中的接骨板样品均沿中段螺钉孔处发生断裂,裂纹从远骨侧往近骨侧扩展,断口表面呈疲劳辉纹和二次裂纹特征,表明属于疲劳断裂.
3) 有限元仿真模拟结果显示接骨板服役过程中最大剪切应力位于其中段螺钉孔远骨侧表面处,术后提早下地行走将导致最大剪切应力超过TA3纯钛材料的屈服强度极限,显著增加接骨板断裂的可能性. 接骨板失效的主要原因是股骨骨折愈合过程中,过载导致接骨板远骨侧表面萌生裂纹,随后承受循环疲劳载荷,导致断裂失效.

