乌头碱抑制GSK-3β对抗β淀粉样蛋白诱导的神经细胞损伤
卫智权,包传红,陈仪新,阎 莉
1广西中医药大学 广西中医基础研究重点实验室;2广西中医药大学 广西中药药效研究重点实验室;3广西中医药大学壮医药学院,南宁 530200
阿尔茨海默病(Alzheimer’s disease,AD)是最主要的中枢神经退行性疾病之一,以进行性认知功能障碍和行为损害为特征,伴随社会老龄化程度的逐渐加深,已经成为全球性的公共卫生问题[1]。国际阿尔茨海默病协会发布的世界阿尔茨海默病报告的数据显示,全球共有约5 000万AD患者,预计到2030年将达到8 200万,到2050年将达1.52亿。神经组织β淀粉样蛋白(beta-amyloid protein,Aβ)异常增加不仅被认为是AD的主要病理变化之一,也是导致AD神经细胞损伤的重要原因[2]。关于Aβ的神经细胞毒性的研究证据不断累积,然而,已经完成的数个特异性清除Aβ的药物临床试验均以失败告终,使得药物研发人员的注意力重新转向增强神经细胞对Aβ细胞毒作用的耐受能力,但是目前尚未有商品化的相应新药推出[3]。
中医药治疗AD具有较好的改善患者认知能力的效果。对于AD的病因病机的认识,中医扶阳学派认为,“阴化太过,阳化不足,内生浊邪”是AD的主要病因病机,“元阳虚衰”、“阳虚阴实”在AD的发生发展过程中发挥了主导性的作用[4]。附子被誉为中药“回阳救逆第一品”,具有显著的补火助阳功效,为中医扶阳学派广泛用于AD的临床治疗,创制了五脏温阳化瘀汤等一批临床应用疗效较好的复方制剂[5]。乌头碱(aconitine)为附子的重要活性成分,既有的研究发现乌头碱具有强心、镇痛、抗肿瘤、免疫调节等药理作用,其药理作用机制与激活磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)有关[6-8]。糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)是PI3K信号转导途径负调控的重要的下游靶激酶,Tyr216位点磷酸化的GSK-3β为其活化形式,Aβ诱导的GSK-3β过度活化被认为是AD进程中神经细胞损伤的重要原因之一[9]。迄今为止,尚无证据表明乌头碱能够减轻Aβ介导的GSK-3β过磷酸化而导致的神经细胞损伤。
本研究采用Aβ1-40体外诱导SH-SY5Y神经细胞损伤的细胞模型,探讨乌头碱是否基于调控GSK-3β的Tyr216位点磷酸化水平而发挥神经细胞保护作用,有助于在分子水平理解中药附子用于AD临床治疗的分子机制。

图1 乌头碱的结构Fig.1 Structure of aconitine
1 材料
1.1 实验细胞株
人神经母细胞瘤SH-SY5Y细胞株,购自中国科学院昆明细胞库。
1.2 主要试剂
乌头碱(美国Sigma公司,批号16938);Aβ1-40(美国Sigma公司,批号028M4864V);DMEM高糖细胞培养基(美国Gibco公司,批号1896978);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司,批号1828728);磷酸盐缓冲液(phosphate buffered saline,PBS)(美国Gibco公司,批号8117266);Accutase胶原酶细胞解离液(美国eBioscience公司,批号E00023-1662);CCK-8细胞增殖活性检测试剂盒(日本同仁化学研究所,批号DV652)。人乳酸脱氢酶(lactate dehydrogenase,LDH)ELISA检测试剂盒(武汉华美公司,批号H05016505);AnnexinV-Alexa Fluor 488/PI 凋亡检测试剂盒(北京索莱宝公司,批号20181219);组织细胞RIPA裂解液(北京索莱宝公司,批号20190903);BCA蛋白浓度测定试剂盒(北京索莱宝公司,批号20190910);蛋白电泳预制胶(北京索莱宝公司,批号20190923)。兔抗人GSK-3β单抗(美国Abcam公司,批号GR312697-8);兔抗人GSK-3β(phospho Y216)单抗(美国Abcam公司,批号GR258576-24);小鼠抗人GAPDH单抗(美国Abcam公司,批号GR202362-1);HRP标记羊抗兔IgG抗体(上海生工公司,批号F902AA0024);HRP标记羊抗小鼠IgG抗体(上海生工公司,批号E326AA0001)。
1.3 主要仪器
Mini-PROTEAN型垂直电泳仪和Mini Trans-blot型转印仪(美国Bio-Rad公司);ChemiDoc成像系统(美国Bio-Rad公司);5430R型高速冷冻离心机(德国Eppendorf公司);Infinite 200 Pro酶标仪(瑞士Tecan公司);LSR Fortessa多色分析流式细胞仪(美国Becton Dickinson公司)。
2 方法
2.1 SH-SY5Y细胞培养
DMEM高糖培养基,含10% FBS、100 IU/mL的青霉素、100 mg/L的链霉素,初始细胞浓度2×105/mL,置于CO2培养箱(37 ℃,5% CO2,饱和湿度)进行培养。细胞长满约70% 时进行传代。
2.2 乌头碱的细胞安全性测试与Aβ1-40诱导的SH-SY5Y细胞损伤模型的建立
取对数生长期的SH-SY5Y神经细胞接种于96孔细胞培养板,初始细胞浓度1×105/mL。设置无药物处理的正常对照组,以及每孔加入乌头碱终浓度分别为1、2.5、5、10、20 nmol/L的乌头碱各浓度处理组,各设置3个复孔。细胞培养箱孵育24 h,加入CCK8溶液10 μL,继续孵育2 h。收集培养上清液,以酶标仪于450 nm处测定光吸收度。根据细胞安全性测试数据选择后续实验的乌头碱安全浓度。
参考文献报道的方法建立Aβ1-40诱导的SH-SY5Y细胞损伤模型[10]。取对数生长期的SH-SY5Y神经细胞接种于96孔细胞培养板,初始细胞浓度1×105/mL。设置正常对照组(normal)、Aβ1-40细胞损伤模型对照组(model),后者加入终浓度20 μmol/L的Aβ1-40孵育24 h诱导细胞损伤。24 h后收集培养上清液,严格按照试剂盒说明书以ELISA检测培养上清液LDH浓度,收集细胞以AnnexinV-Alexa Fluor 488/PI法流式细胞术分析细胞凋亡情况,评价建模方法的有效性。
2.3 乌头碱干预Aβ1-40诱导的SH-SY5Y细胞损伤
取对数生长期的SH-SY5Y神经细胞接种于96孔细胞培养板,初始细胞浓度1×105/mL。设置正常对照组(normal)、Aβ1-40细胞损伤模型对照组(model)、乌头碱干预组(aconitine),其中的乌头碱干预组以终浓度5 nmol/L的乌头碱预孵育12 h,其它两组不作药物干预。12 h后,Aβ1-40细胞损伤模型对照组与乌头碱干预组加入终浓度20 μmol/L的Aβ1-40,诱导细胞损伤[11]。24 h后收集细胞培养上清液,ELISA检测培养上清液LDH浓度;收集细胞,部分细胞用于AnnexinV-Alexa Fluor 488/PI法流式细胞术分析细胞凋亡情况,其余细胞用于蛋白免疫印迹检测GSK-3β的磷酸化水平。
2.4 流式细胞术分析细胞凋亡与坏死
去除培养容器中的培养基,PBS洗3次,胶原酶细胞解离液消化10 min,加入适量4℃预冷的PBS,1 000 rpm离心5 min。小心去除上清,加入约1 mL 4 ℃预冷的PBS重悬细胞。取100 μL细胞悬液于5 mL 流式管中,加入Annexin V-Alexa Fluor 488溶液5 μL,混匀后于室温避光孵育5 min;加入10 μL PI溶液,并加400 μL PBS,上机进行流式检测。
2.5 Western blotting检测细胞GSK-3β与Tyr216位点磷酸化GSK-3β
去除培养容器中的培养基,PBS洗3次,胶原酶细胞解离液消化10 min,加入适量4 ℃预冷的PBS,1 000 rpm离心5 min。小心去除上清,加入10倍体积裂解液4 ℃ 孵育20 min,12 000 rpm离心5 min,取上清,蛋白定量。准备蛋白电泳预制胶,蛋白上样量20 μg。垂直电泳条件为恒压100 V,指示剂泳动至凝胶中下部时停止。采用湿法转膜,封闭,4 ℃摇床一抗孵育过夜,GSK-3β单抗、GSK-3β(phospho Y 216)单抗、GAPDH单抗稀释倍数均为1∶1 200。一抗孵育结束,二抗(1∶3 000稀释)室温孵育60 min,ECL超敏化学发光液孵育3 min,即以ChemiDoc成像系统测定并计算目的蛋白与内参蛋白GAPDH条带灰度的比值作为蛋白的相对表达水平。
2.6 统计学处理
3 结果
3.1 SH-SY5Y细胞培养与形态观察
细胞在DMEM高糖培养基(含10% FBS)生长速度稍慢,每5~7天可以1∶3传代1次。细胞贴壁生长,具有一定程度聚集生长倾向。镜下可见细胞呈不规则多边形,具有数个明显的尖细突起,部分细胞具有较长的类似神经细胞样突触,如图2。

图2 SH-SY5Y细胞Fig.2 SH-SY5Y cell
3.2 乌头碱对SH-SY5Y细胞的安全性测试
与未经药物处理的正常对照组比较,以终浓度为1、2.5、5 nmol/L的乌头碱孵育SH-SY5Y细胞24 h,对于细胞的增殖活性无明显影响;以终浓度为10、20 nmol/L的乌头碱孵育SH-SY5Y细胞24 h,细胞增殖活性降低,其差异有统计学意义(P<0.01)。结果见图3。
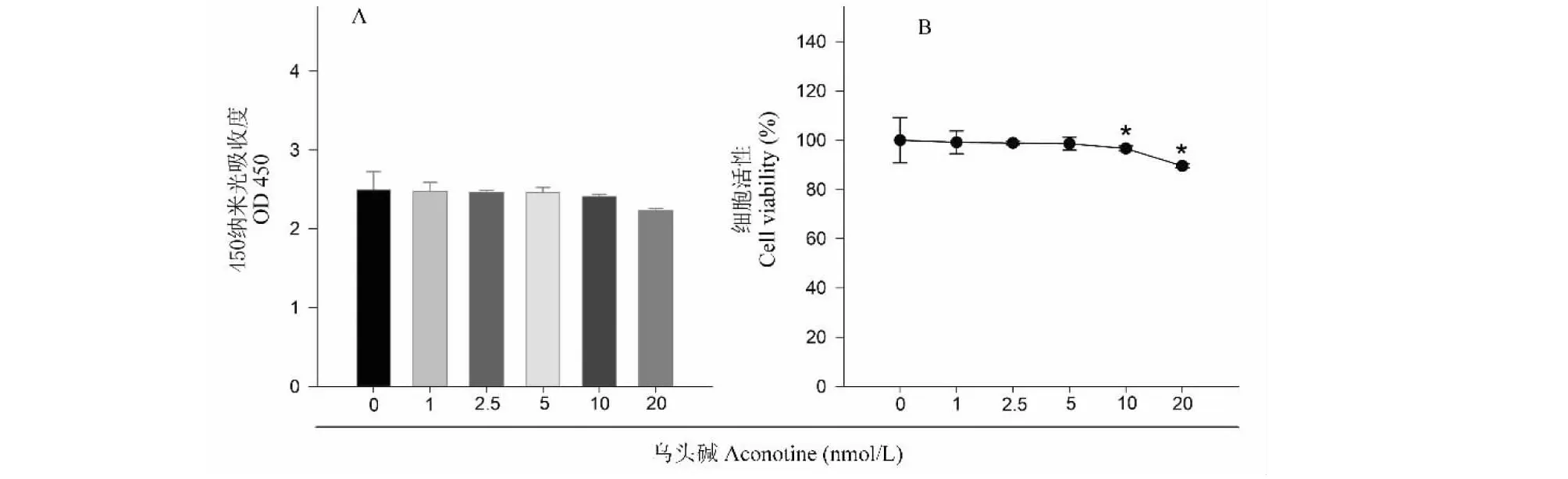
图3 不同浓度乌头碱的细胞安全性Fig.3 Cell safety of aconitine at different concentrations注:与正常对照组比较,*P<0.01。Note:Compared with normal control,*P<0.01.
3.3 Aβ1-40诱导的SH-SY5Y细胞损伤模型的建立
与正常对照组比较,模型对照组细胞培养上清液中的LDH水平显著提升,细胞凋亡率与细胞坏死率亦显著增加,两组间差异具有统计学意义(P<0.01)。结果见图4。
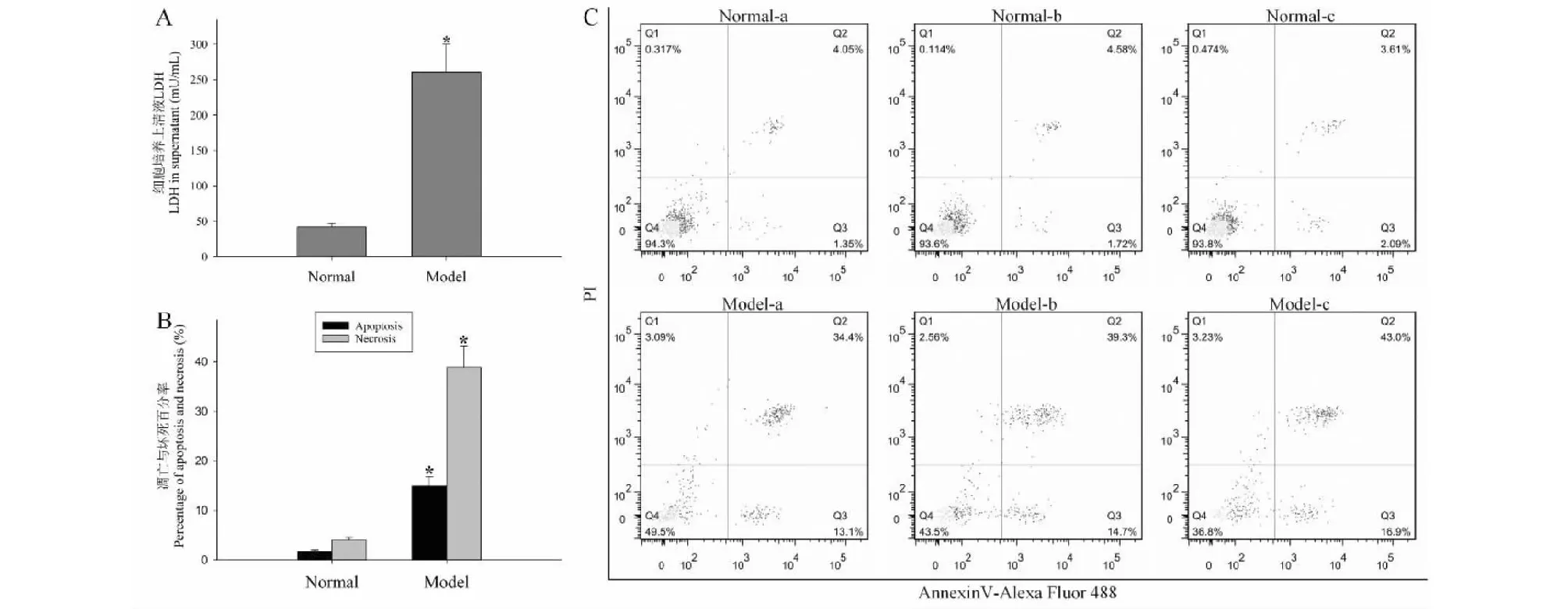
图4 Aβ1-40诱导的SH-SY5Y细胞损伤Fig.4 SH-SY5Y cell damage induced by Aβ1-40注:与正常对照组比较,*P<0.01。Note:Compared with normal control,*P<0.01.
3.4 乌头碱对Aβ1-40诱导损伤的SH-SY5Y细胞培养上清液LDH水平、细胞凋亡与坏死的影响
与正常对照组比较,模型对照组细胞培养上清液中的LDH水平显著提升,细胞凋亡率与坏死率亦明显增加,两组间差异具有统计学意义(P<0.01)。以5 nmol/L的乌头碱预处理之后,与模型对照组比较,乌头碱干预组细胞培养上清液中的LDH水平显著降低,细胞凋亡率与坏死率亦明显下降,两组间差异具有统计学意义(P<0.01)。结果见图5A、B、D。
3.5 乌头碱对Aβ1-40诱导损伤的SH-SY5Y细胞GSK-3β蛋白Tyr216位点磷酸化的影响
与正常对照组比较,模型对照组细胞GSK-3β蛋白磷酸化水平显著提升,两组间差异具有统计学意义(P<0.01)。以5 nmol/L的乌头碱预处理之后,与模型对照组比较,乌头碱干预组细胞GSK-3β蛋白磷酸化水平显著降低,两组间差异具有统计学意义(P<0.01)。结果见图5C、E。

图5 乌头碱减轻Aβ1-40诱导的SH-SY5Y细胞损伤Fig.5 Alleviation of aconitine on SH-SY5Y cell damage induced by Aβ1-40注:与正常对照组比较,*P<0.01。与模型对照组比较,△P<0.01。Note:Compared with normal control,*P<0.01.Compared with model control, △P<0.01.
4 讨论
早在典型的认知功能障碍和行为损害等AD症状出现之前约15~20年,甚至更早的阶段,对神经细胞具有细胞毒作用的Aβ就已经在AD患者大脑中发生了病理性聚集,然而此时并无明显的记忆减退症状。Aβ对神经细胞具有显著的细胞毒性,不仅可以诱导细胞氧化应激与神经炎症,还能够干扰细胞膜离子通道开放进而导致细胞内外离子浓度梯度失衡、细胞膜跨膜电位异常,并直接损伤胆碱能神经传导功能而导致胆碱能神经信号传递障碍,以及直接诱导神经细胞凋亡[12]。当患者表现出典型的认知与行为能力损害的时候,其大脑的神经细胞已经大量丧失,大脑影像检查已经可以观察到明显的脑萎缩,此时再使用药物来清除Aβ,已经很难获得理想的临床疗效,这也是AD自于1907年被正式定义以来AD的临床治疗困难重重的原因之一[13]。寻找能够增强神经细胞对Aβ细胞毒作用的耐受能力的有效药物,并在AD病理进程的早期阶段进行药物干预,是有效阻止AD持续进展的药物治疗综合方案的重要内容之一。早期开始治疗通常意味着患者需要持续时间漫长的药物治疗,必须谨慎权衡药物治疗的获益与药物安全性的风险。考虑到中药及其有效成分普遍具有较好的安全性,并且其多靶点药效的特点契合AD这样的复杂慢性疾病,早期开始中药及其有效成分干预或许是合理的潜在选择[14,15]。
中医扶阳学派重用附子的温阳化瘀治则,在AD的临床治疗中获得了较好的认知与行为能力症状改善的疗效[16,17]。乌头碱既是附子的重要药效物质,也是引起附子中毒的重要原因,因而附子遣方用药的权衡较为复杂,也是选取乌头碱作为研究对象的主导性原因。乌头碱作为附子中的重要生物活性成分,既往研究已经发现其激活PI3K的药理活性,而PI3K的激活能够负调控Tyr216位点磷酸化导致的GSK-3β活化。GSK-3β参与Aβ的生成、聚集以及后续的神经细胞损伤,而Aβ介导的神经炎症和氧化应激也可以诱导GSK-3β的磷酸化激活。此外,过度活化的GSK-3β亦可破坏重要的神经递质乙酰胆碱的活性,并加速神经细胞轴突变性、阻碍轴突运输,进一步加剧认知功能障碍。基于上述研究发现,可以合理推测乌头碱有助于增强神经细胞抵抗Aβ的细胞毒作用,并且此有益的药理作用与其抑制GSK-3β在Tyr216位点磷酸化而激活有关,然而该推测需要实验证据加以证实。
在本研究中,以Aβ1-40孵育SH-SY5Y细胞成功建立细胞损伤模型,表现为细胞培养上清液的LDH水平上升,伴随细胞凋亡与坏死率均显著增加。5 nmol/L的乌头碱并未表现明显的细胞毒性,以其预处理SH-SY5Y细胞则可以显著减轻Aβ1-40导致的细胞损伤,细胞损伤释放的LDH显著减少,细胞凋亡与坏死率均显著降低,与此同时细胞的Tyr216位点GSK-3β磷酸化水平显著降低,提示该浓度下乌头碱的细胞安全性是可接受的,并增强细胞抵抗Aβ细胞毒作用的能力,而且此作用可能与其抑制GSK-3β在Tyr216位点的磷酸化而激活有关。
一般认为,乌头碱具有心脏毒性,因此以净水浸泡、胆巴炮制、反复蒸煮等方法减少附子中的乌头碱,通过久煎的方法促进乌头碱水解,然而仍然有微量的乌头碱进入人体,并产生相应的药理效应[18-20]。关于乌头碱通过血脑屏障进入中枢神经系统的机制,有研究报道,一种质子偶联的有机阳离子反向载体参与乌头生物碱的血脑屏障运输[21]。本研究的结果表明,即使在5 nmol/L的极低浓度水平,乌头碱仍然可以发挥神经细胞保护作用,显著增强神经细胞抵御Aβ的细胞毒性损伤,提示重用附子的温阳化瘀中药复方治疗AD的药效与乌头碱增强神经细胞抵抗Aβ的细胞毒作用密切相关。鉴于乌头碱的固有心脏毒性,显然需要设计严谨的体内实验研究,在不会造成心脏毒性的安全性前提下,验证乌头碱增强神经细胞抵御Aβ的细胞毒性损伤的体内活性。

