癌/睾丸抗原胎盘特异性蛋白1在肿瘤中的研究进展
孟潇妍,孙雪青,刘忠龙,何悦
(1.上海交通大学医学院附属第九人民医院口腔医学院 口腔颌面头颈肿瘤科, 国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海 200011;2.上海交通大学医学院 生物化学和分子细胞生物学系,上海 200025)
癌/睾丸抗原(cancer/testis antigen, CTA)是指表达于正常精子和某些肿瘤细胞的一类抗原,在正常体细胞中不表达。基于CTA的这种表达特征,它们被认为可用于肿瘤标志物和免疫治疗靶点的筛选。目前已知CTA大约由228个密切相关的基因组成,通常分为两类——X染色体编码(52%)和非X染色体编码(48%)的CTA。
胎盘特异性蛋白1(placenta specific protein 1,PLAC1)属于X染色体编码的CTA,最早被发现表达于胎盘组织,具有促进胎盘与胚胎发育的作用,因此得名,后来PLAC1被发现也表达于睾丸组织[1-2]。研究表明,PLAC1在乳腺癌、结直肠癌与肺癌等实体肿瘤中高表达,且与较差的预后相关。近年来,已有一些团队利用PLAC1的抗原特性在肿瘤疫苗和基因改造T细胞等肿瘤免疫治疗领域开展研究,并取得一定的成果。文章拟就PLAC1的结构、组织表达特征、在肿瘤进展中的作用,以及免疫治疗方面的成果进行综述,探讨PLAC1在肿瘤诊疗中的意义。
1 PLAC1基因、蛋白结构及在正常组织的表达
PLAC1位于X染色体(Xq26),包括6个外显子(E1~E6)。然而,这6个外显子中只有E6编码蛋白,因此PLAC1不同转录本的翻译产物是相同的,即PLAC1蛋白[3]。
人与小鼠的PLAC1蛋白高度同源(达60%),人PLAC1蛋白含212个氨基酸残基(图1),小鼠PLAC1编码的蛋白含173个氨基酸残基。在细胞中,PLAC1蛋白属于Ⅱ型整合膜蛋白(integralprotein type Ⅱ),N端位于胞内(图 1);其胞内的信号肽段(signal peptide, SP)非常短,仅含23 个氨基酸残基;胞外段有透明带糖蛋白(zona pellucida,ZP)同源区。ZP结构域与精卵识别、蛋白聚合有关,该结构域亦见于多种胞外受体样蛋白,包括Ⅲ型TGF-β受体、尿调节蛋白、糖蛋白2等。因此,PLAC1可能参与细胞间的相互作用。

图1 人PLAC1蛋白结构模式及其在细胞膜表面的定位
由于PLAC1蛋白含分泌蛋白所需的信号肽结构域,Uniprot(https://www.uniprot.org/uniprot/Q9HBJ0)对其定位的注释是分泌型,但PLAC1的ZP同源段又提示它可能具有受体样蛋白的特征。膜定位的PLAC1最终被分泌至细胞外还是在膜表面行使功能,有待进一步研究。
研究认为,PLAC1的表达可能受到维甲酸X受体α(retinoic acid X receptor alpha,RXRα)、雌激素受体α(estrogen receptor α, ERα)和TP53的调控。RXRα结合肝X受体α/β(liver X receptor alpha/beta, LXRα/β)后形成LXRα/β-RXRα复合体促进PLAC1转录,该过程可以被野生型TP53阻断[3-4](图2A)。而在乳腺癌中ERα可通过CCAAT增强子结合蛋白β(CCAAT/enhancer binding protein β, C/EBPβ)、特异性蛋白1(specificity protein 1, SP1)与核受体辅激活蛋白3(nuclear receptor co-activator 3, NCOA3)形成转录复合体,促进PLAC1转录[5](图2B)。
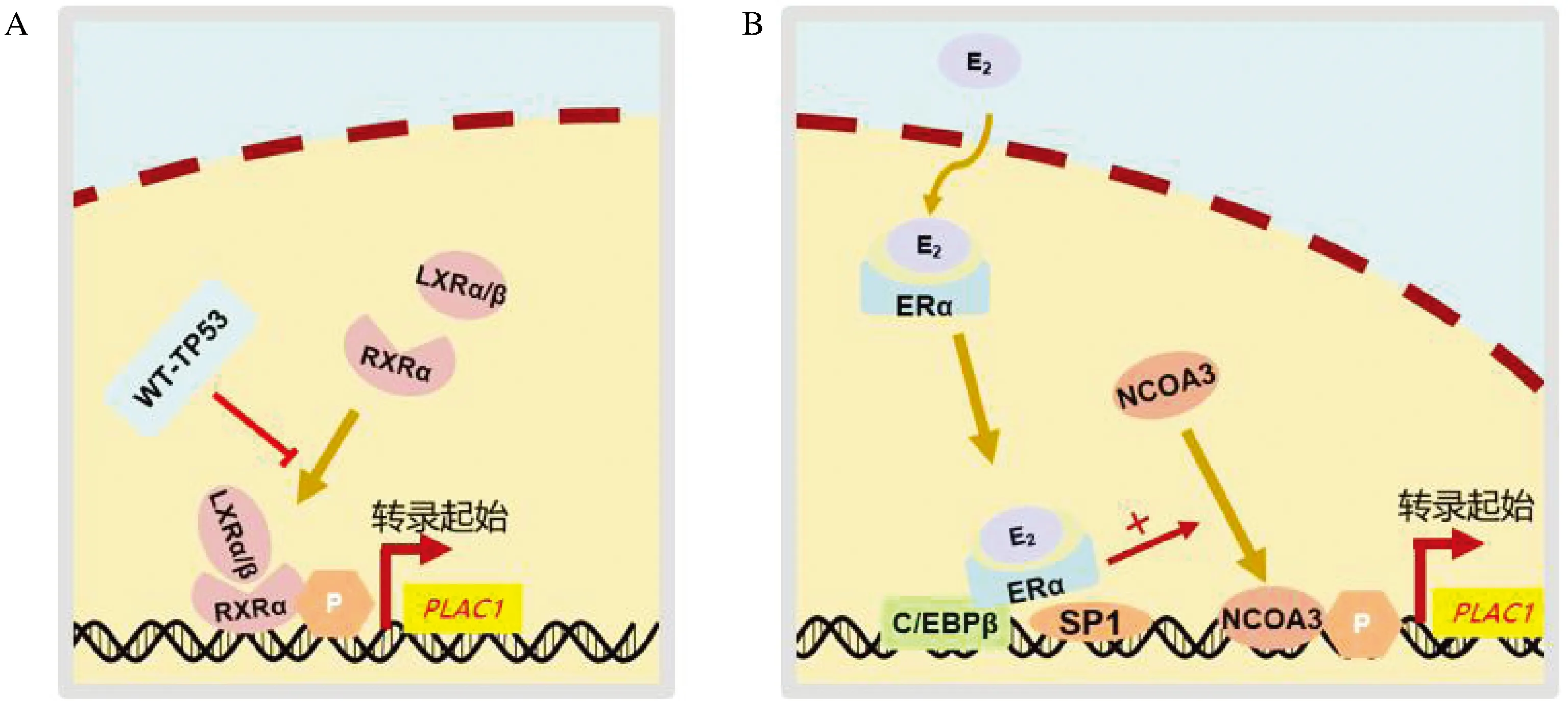
注:A. RXRα、LXRα/β和TP53对PLAC1的调控;B. 乳腺癌中PLAC1的调控。E2,雌二醇(estradiol); ERα, 雌激素受体α(estrogen receptor alpha)。图2 PLAC1表达的调控模式
2 PLAC1在肿瘤组织中的表达及其在临床预后评价中的作用
基于高表达PLAC1的胎盘合体滋养层细胞具有向母体侵袭的能力,越来越多的研究把PLAC1与肿瘤联系起来。已有研究表明,PLAC1在多种肿瘤细胞系(表 1)与临床肿瘤样本(表 2)中高表达,且PLAC1在肿瘤细胞中主要定位于胞膜或胞质(表 3)。部分研究认为PLAC1可能存在核表达,但是它在核内发挥怎样的作用尚缺乏依据[13-18]。

表1 PLAC1高表达的肿瘤细胞系

表2 PLAC1高表达的肿瘤组织

表3 PLAC1在表达阳性肿瘤细胞中的定位(IHC)
此外,肿瘤中PLAC1的表达水平与患者预后存在相关性。非小细胞肺癌[6]、胃癌[18,23]、乳腺癌[21]、肝癌[7,15]、结肠癌[24]和胰腺导管癌[17]中高表达PLAC1的患者较易发生远处转移,且生存率更低。在结直肠癌[13]和胰腺导管癌[17]中,研究发现PLAC1高表达于低分化肿瘤组织。因此,PLAC1在肿瘤中的高表达与肿瘤组织分化程度低和临床预后不良密切相关,这提示PLAC1可能通过一定的调控途径促进肿瘤的进展。
3 PLAC1促进肿瘤进展的机制

注:HES1为发状分裂相关增强子1(hairy and enhancer of split 1);Cyclin D1为G1/S-特异性周期蛋白-D1(G1/S-specific cyclin-D1);E2F为E2F转录因子(E2F transcription factor);Rb为视网膜母细胞瘤抑制蛋白(retinoblastoma tumor suppressor protein)。图3 PLAC1相关信号转导通路
3.1 PLAC1相关信号转导通路一系列细胞水平的研究证明了PLAC1具有促进肿瘤生长和转移的作用(图 3)。在肝癌和乳腺癌细胞系中敲减PLAC1可降低肿瘤细胞的增殖、侵袭和迁移能力[7,21,25],这可能是通过调节AKT信号通路、干扰细胞周期以及调节上皮-间充质转化(epithelial-mesenchymal transition, EMT)过程实现的[6,10,26]。2018年Li等[21]发现,PLAC1与Furin结合,激活Furin的水解活性从而降解Notch1,产生更多的Notch胞内结构域片段(Notch intracellular domain, NICD),通过一系列调控过程最终抑制PTEN表达。PTEN是公认的抑癌基因,可以显著抑制肿瘤细胞的增殖、侵袭和转移。另外,该研究[21]也发现PLAC1的表达能上调基质金属蛋白酶(matrix metalloproteinase,MMP)2和9表达,有利于肿瘤细胞的侵袭与转移。然而,目前的研究结果还远远不能阐明PLAC1在肿瘤中的作用机制,亟需更多的研究全面深入地探讨其作用机制。
3.2 PLAC1通过趋化因子抑制抗肿瘤免疫免疫抑制是胎盘组织的一大特征,也是实体肿瘤的重要特征之一。研究表明,PLAC1与免疫耐受相关。Yuan等[25]发现,将敲减PLAC1的小鼠乳腺癌细胞系EO771植入同系小鼠体内,肿瘤生长受到显著抑制,但这种肿瘤抑制作用在免疫缺陷小鼠中无效,提示PLAC1的表达及其对肿瘤的影响与抗肿瘤免疫有关。进一步研究发现,PLAC1敲减后的EO771细胞中CXCL1、CD274(编码PD-L1)与CD68等编码肿瘤免疫相关分子的基因表达均下调。并且,此文作者在EO771细胞中验证了CXCL1敲减可再现PLAC1敲减的表型,在PLAC1敲减的细胞中过表达CXCL1则部分恢复肿瘤细胞增殖等表型。综上,PLAC1可能通过调控趋化因子分泌影响免疫微环境与肿瘤细胞。
4 PLAC1在肿瘤诊疗中的意义
4.1 PLAC1与肿瘤标志物肿瘤标志物可用于肿瘤的筛查与疗效监测。健康母体血清与胎儿脐带血中均未检测到PLAC1蛋白,但在许多肿瘤组织(表2)与患者血清中可检出PLAC1蛋白/抗PLAC1抗体,这提示它或可用作多种肿瘤的生物标志物。有研究发现,乳腺癌患者(117 例)血清中PLAC1蛋白浓度显著高于健康对照者(51 例)[12]。胃癌患者血清中PLAC1抗体检出率为29%(8/28),占mRNA阳性样本数的57%(8/14)[23];表达PLAC1的结肠癌患者中有30%(6/20)产生了针对PLAC1重组蛋白的抗体[14]。在肝癌中,患者血清样本对PLAC1重组蛋白阳性反应率为4.0%(4/101),健康对照样本(50 例)均无阳性反应[16]。总体而言,血清PLAC1/抗PLAC1抗体在乳腺癌、胃癌和结肠癌中有一定的检出率,如果得到大样本研究的支持,可能作为临床肿瘤筛查的辅助指标。而在非小细胞肺癌、肝癌及其他肿瘤中的检出情况还需要更多的临床调查。
4.2 PLAC1与肿瘤免疫疫苗肿瘤疫苗可以激活人体免疫系统,改善机体针对肿瘤的免疫抑制状态,是一种抗肿瘤主动免疫疗法,具有较高的安全性。PLAC1作为位于X染色体的CTA,其编码的蛋白具有较强的免疫原性。在PLAC1 mRNA检测阳性的结肠癌患者中,有超过50%产生了PLAC1特异性抗体介导的CD4+(58.3%)与CD8+(55.6%)T细胞反应,且产生T细胞应答的患者预后显著优于无应答患者[14]。目前,针对PLAC1的肿瘤疫苗正在研发中(表4)。研制PLAC1多肽疫苗的关键在于抗原表位的预测。肿瘤抗原需要被MHC分子提呈给T细胞,而编码MHC分子的HLA有很高的多态性,HLA的各亚型对不同抗原亲和力不同。HLA-A*0201是高加索与亚洲人群中最常见的HLA-A等位基因,许多肿瘤疫苗都靶向HLA-A*0201限制性抗原。运用新一代测序技术和生物信息学[30]技术发现,Liu等[13-14]在结肠癌患者中筛选出的HLA-A*0201限制性p56~58、p31~39、p41~50以及p69~77肽段可能是有效的疫苗靶点。在乳腺癌中,翟文杰等[28]预测并在体内外实验中均验证了p42~64肽段具有较强的免疫原性;Liu等[29]发现p28~36肽段可诱导出效能最强的特异性肿瘤杀伤性T细胞。在制备肿瘤疫苗时,表达跨膜型重组蛋白有一定难度,因为其跨膜片段的疏水性往往会导致蛋白发生错误折叠。Nazari等[30]开发了一种使用原核表达系统制备并纯化人PLAC1蛋白的方法,以此种方式制备的重组蛋白能够被PLAC1抗体检测到,其亚结构也通过光谱得到了验证。

表4 围绕PLAC1免疫治疗的相关研究
虽然针对PLAC1的肿瘤疫苗的研究已取得一些成果,然而,目前仍存在抗肿瘤效应弱、发生自身免疫反应等缺点。如何优化PLAC1肿瘤疫苗的疗效,使其能真正应用于肿瘤治疗依然是一项艰巨的任务。
4.3 PLAC1与抗体靶向药物基于PLAC1在肿瘤组织中的特异性和强免疫原性,人们认为它可作为药物靶点用于开发抗PLAC1抗体或ADC。2017年,Nejadmoghaddam等[8]将PLAC1特异性ADC应用于前列腺癌的治疗。该课题组将抗肿瘤药物SN38与PLAC1单抗偶联,发现相比单独使用抗体,ADC产生了更强的肿瘤细胞杀伤效果,半数抑制浓度是非偶联SN38的1/15。而且,在药物安全性试验中没有观察到小鼠肝、脾、肾、睾丸、膀胱、肺、皮肤和胃组织的明显病理改变。
因此,利用PLAC1的抗原性,采用PLAC1抗体联合多种抗肿瘤药物研发偶联药物,提高肿瘤治疗的特异性,降低抗肿瘤药物对非肿瘤组织的毒性也是重要的研究方向。
4.4 PLAC1与基因改造T细胞基因改造T细胞回输属于肿瘤的被动免疫疗法,或称过继细胞免疫治疗。具体来说,是从患者血液或肿瘤组织中分离出T细胞,编辑这些T细胞的特异性受体基因序列,使其能够更特异地识别肿瘤抗原。随后,体外扩增编辑后的T细胞并回输至患者体内,使其发挥免疫杀伤作用,清除肿瘤细胞。
Li等[27]基于多肽疫苗的研究,使用识别p28~36多肽的PLAC1特异性TCR改造T细胞, 形成嵌合抗原受体T细胞(chimeric antigen receptor-modified T cell, CAR-T),并通过细胞共培养与裸鼠乳腺癌移植瘤模型证明了经TCR改造后的T细胞具有抗肿瘤作用。虽然针对PLAC1靶点的T细胞疗法在动物模型中疗效良好,但其在临床上应用的可靠性和安全性还需更多的实验验证。
5 结语
PLAC1是X染色体连锁基因,限制性表达于胎盘、睾丸及肿瘤细胞,PLAC1的表达水平可以作为判断肿瘤患者预后的一项指标。另外,PLAC1具有较强的免疫原性,这种特性使它可以作为靶点用于抗体和疫苗的研发。但目前对于PLAC1促肿瘤的分子机制以及它在肿瘤免疫中的作用尚缺乏深入研究。
PLAC1对肿瘤的预防与诊疗具有潜在的重要意义,后续研究可以进一步关注:(1)PLAC1在肿瘤细胞中的作用——PLAC1是通过哪些信号通路调控肿瘤细胞增殖、侵袭与转移的;(2)PLAC1在肿瘤微环境中的作用——作为受体样蛋白,PLAC1是否参与肿瘤与微环境中其他细胞的交互对话;(3)针对PLAC1的药物研发——包括抗PLAC1抗体与其他靶向药物的联合疗法、ADC以及PLAC1疫苗和CAR-T细胞的研发与应用等。相信随着人们对PLAC1在肿瘤中作用机制的全面了解,基于PLAC1的临床应用会给相关肿瘤的治疗带来更大的益处。

