不同剂量瑞舒伐他汀钙对脑梗死合并高脂血症患者血脂水平、血管内皮功能及神经功能的影响
刘 成
(黄河三门峡医院神经内科,河南 三门峡 472000)
脑梗死是临床常见的脑血管疾病,高脂血症是其主要危险因素之一[1]。研究显示,我国脑梗死患者血脂达标率不足20%,明显低于国外报道的38.4%,高脂血症已成为影响脑梗死治疗效果及复发的重要因素,因此,降血脂治疗尤为重要[2-3]。近年来,随着强化降血脂观点的提出,他汀类药物在临床得以广泛应用,其不仅具有降血脂效能,亦可发挥一定的抗炎、抗氧化作用[4]。瑞舒伐他汀钙属于他汀类药物的一种,在脑梗死、心肌梗死、高脂血症等疾病的临床治疗中发挥重要作用,当前国内瑞舒伐他汀钙的起始剂量主要以10 mg·d-1、20 mg·d-1常见,用于心脑血管疾病中的临床报道亦并不鲜见,虽均取得满意获益,但尚未形成统一剂量标准[5-6]。鉴于此,本研究探讨不同剂量瑞舒伐他汀钙对脑梗死合并高脂血症患者血脂水平、血管内皮功能及神经功能的影响,以期为瑞舒伐他汀钙在脑梗死合并高脂血症患者中的应用提供依据。
1 资料与方法
1.1 一般资料选择2018年1月至2018年12月黄河三门峡医院收治的脑梗死合并高脂血症患者为研究对象。病例纳入标准:(1)符合脑梗死诊断标准[7];(2)符合高脂血症诊断标准[8];(3)脑梗死病程<3 d;(4)入院前30 d内无降血脂药物使用史。排除标准:(1)合并出血性脑血管疾病;(2)合并颅脑外伤、颅内肿瘤;(3)患者治疗依从性不佳;(4)有心血管意外病史;(5)合并凝血功能障碍;(6)对他汀类药物过敏或对瑞舒伐他汀钙有禁忌证。本研究共纳入脑梗死合并高脂血症患者220例,所有患者给予瑞舒伐他汀钙治疗,根据瑞舒伐他汀钙使用剂量将患者分为A组和B组。A组117例,男72例,女45例;年龄41~69(49.12±6.87)岁;体质量指数18.5~29.0(25.27±3.14)kg·m-2;脑梗死病程5~72(42.64±10.81)h;脑梗死部位:基底节区42例,脑叶33例,脑干21例,小脑21例;梗死病灶直径1.1~3.4(2.27±0.94)cm;合并症:糖尿病8例,高血压19例;高脂血症类型:Ⅱa型高脂血症60例,Ⅱb型高脂血症57例。B组103例,男69例,女34例;年龄39~70(50.14±6.95)岁;体质量指数18.0~28.8(25.01±2.99)kg·m-2;脑梗死病程5~72(43.01±9.49)h;脑梗死部位:基底节区42例,脑叶30例,脑干16例,小脑15例;梗死病灶直径1.0~3.5(2.19±1.01)cm;合并症:糖尿病10例,高血压16例;高脂血症类型:Ⅱa型高脂血症56例,Ⅱb型高脂血症47例。2组患者性别、年龄、体质量指数、脑梗死病程、脑梗死部位、梗死病灶直径、合并症及高脂血症类型比较差异均无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会批准,所有患者和(或)家属签订知情同意书。
1.2 治疗方法2组患者均给予控制颅内压、血糖、血压及抗血小板聚集、改善脑微循环等综合治疗措施,在此基础上,A组患者给予瑞舒伐他汀钙(鲁南贝特制药有限公司,国药准字H20080237)10 mg,口服,每日1次;B组患者给予瑞舒伐他汀钙20 mg,口服,每日1次;疗程均为1个月。
1.3 观察指标
1.3.1 血脂及血管内皮功能相关指标分别于治疗前和治疗1个月后采集患者晨起空腹肘静脉血10 mL,3 000 r·min-1离心10 min,取上层血清待测。使用贝克曼DXC800全自动生物化学分析仪(美国贝克曼库尔特公司)检测血清中总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平;血清TC、TG水平检测采用氧化酶法,试剂盒购自深圳迈瑞生物医疗电子股份有限公司;血清HDL-C水平检测采用沉淀法,血清LDL-C水平检测采用Frieddewald法,试剂盒购自美国Helena公司。采用酶联免疫吸附试验检测血清中血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)水平,试剂盒购自武汉新启迪生物科技有限公司;采用放射免疫法检测血清中内皮素-1(endothelin-1,ET-1)水平,试剂盒购自上海研卉生物科技有限公司;采用硝酸还原酶法检测血清中一氧化氮(nitricoxide,NO)水平,试剂盒购自上海恪敏生物科技有限公司。所有检测过程严格按照试剂盒说明书进行操作。
1.3.2 神经功能缺损情况及生活活动能力分别于治疗前和治疗1个月后采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估患者神经功能缺损情况,采用Barthel指数(Barthel index,BI)评估患者生活活动能力;NIHSS评分越高,提示神经功能缺损越严重;BI评分越高,提示生活活动能力越强。
1.3.3 临床疗效治疗1个月后评估患者临床疗效。(1)显效:脑梗死临床症状、体征显著改善或完全消失,且血脂水平改善满足下列条件之一:血清TC水平降低≥20%、血清TG水平降低≥40%、血清HDL-C水平升高≥0.26 mmol·L-1、血清LDL-C水平降低≥20%。(2)有效:脑梗死临床症状、体征有改善,但未达显效标准,且血脂水平改善满足下列条件之一:10%≤血清TC水平降低<20%、20%≤血清TG水平降低<40%、0.10 mmol·L-1≤血清HDL-C水平升高<0.26 mmol·L-1、10%≤血清LDL-C水平降低<20%。(3)无效:未达显效及有效标准[9]。总有效率=(显效例数+有效例数)/总例数×100%。
1.3.4 不良反应观察治疗期间患者不良反应发生情况。
1.4 统计学处理应用SPSS 19.0软件进行数据统计分析。计量资料以均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以例数和百分率表示,组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 2组患者血脂水平比较结果见表1。治疗前2组患者血清TC、TG、HDL-C、LDL-C水平比较差异均无统计学意义(P>0.05);与治疗前比较,治疗后2组患者血清TC、TG、LDL-C水平显著降低,血清HDL-C水平显著升高,差异均有统计学意义(P<0.05);治疗后,B组患者血清TC、TG、LDL-C水平显著低于A组,血清HDL-C水平显著高于A组,差异均有统计学意义(P<0.05)。
表1 2组患者血脂水平比较Tab.1 Comparison of the blood lipid levels of patients between the two groups(±s)

表1 2组患者血脂水平比较Tab.1 Comparison of the blood lipid levels of patients between the two groups(±s)
注:与治疗前比较a P<0.05;与A组比较b P<0.05。
组别n TC/(mmol·L-1)TG/(mmol·L-1)HDL-C/(mmol·L-1)LDL-C/(mmol·L-1)A组117治疗前6.92±0.75 2.88±0.60 1.03±0.44 5.40±0.76治疗后6.78±0.64a 2.82±0.78a 1.13±0.56a 5.23±0.94a B组103治疗前6.90±0.63 3.02±0.71 0.99±0.53 5.51±0.66治疗后6.41±0.48ab 2.48±0.63ab 1.35±0.52ab 4.86±0.55 ab
2.2 2组患者血清VEGF、ET-1及NO水平比较结果见表2。治疗前2组患者血清VEGF、ET-1、NO水平比较差异均无统计学意义(P>0.05);与治疗前比较,治疗后2组患者血清VEGF、NO水平显著升高,血清ET-1水平显著降低,差异均有统计学意义(P<0.05);治疗后,B组患者血清VEGF、NO水平显著高于A组,血清ET-1水平低于A组,差异均有统计学意义(P<0.05)。
表2 2组患者血清VEGF、ET-1及NO水平比较Tab.2 Comparison of the levels of serum VEGF,ET-1 and NO of patients between the two groups(±s)
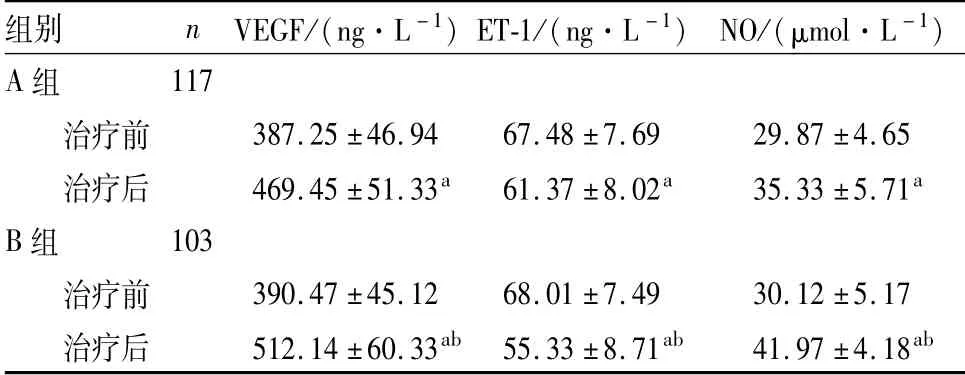
表2 2组患者血清VEGF、ET-1及NO水平比较Tab.2 Comparison of the levels of serum VEGF,ET-1 and NO of patients between the two groups(±s)
注:与治疗前比较a P<0.05;与A组比较b P<0.05。
组别n VEGF/(ng·L-1)ET-1/(ng·L-1)NO/(μmol·L-1)A组117治疗前387.25±46.94 67.48±7.69 29.87±4.65治疗后469.45±51.33a 61.37±8.02a 35.33±5.71a B组103治疗前390.47±45.12 68.01±7.49 30.12±5.17治疗后512.14±60.33ab 55.33±8.71ab 41.97±4.18 ab
2.3 2组患者神经功能缺损情况比较结果见表3。治疗前2组患者NIHSS评分、BI评分比较差异均无统计学意义(P>0.05);与治疗前比较,治疗后2组患者NIHSS评分显著降低,BI评分显著升高,差异均有统计学意义(P<0.05);治疗后,B组患者NIHSS评分显著低于A组,BI评分显著高于A组,差异均有统计学意义(P<0.05)。
表3 2组患者NIHSS、BI评分比较Tab.3 Comparison of the NIHSS,BI scores of patients between the two groups(±s)

表3 2组患者NIHSS、BI评分比较Tab.3 Comparison of the NIHSS,BI scores of patients between the two groups(±s)
注:与治疗前比较a P<0.05;与A组比较b P<0.05。
组别n NIHSS评分BI评分A组117治疗前13.47±2.15 44.48±6.12治疗后10.47±2.01a 56.78±11.64a B组103治疗前13.50±2.09 45.01±5.94治疗后7.62±1.98ab 66.28±8.45 ab
2.4 2组患者临床疗效比较A组患者治疗显效89例,有效12例,无效16例,总有效率为86.32%(101/117);B组患者治疗显效84例,有效14例,无效5例,总有效率为95.14%(98/103);B组患者总有效率显著高于A组,差异有统计学意义(χ2=3.967,P<0.05)。
2.5 2组患者不良反应比较A组患者发生头痛2例,恶心呕吐3例,腹痛1例,乏力2例,不良反应发生率为6.83%(8/117);B组患者发生头痛1例,恶心呕吐3例,腹痛2例,乏力1例,不良反应发生率为6.79%(7/103);2组患者不良反应发生率比较差异无统计学意义(χ2=0.001,P>0.05)。2组患者的不良反应均较轻微,未给予特殊治疗,自行缓解。
3 讨论
瑞舒伐他汀钙在发挥良好调血脂作用的同时,安全性更佳,其不良反应较轻微,症状短暂,多数可自行消失,在他汀类药物中临床评价相对较高[10];但瑞舒伐他汀钙的药代动力学研究显示,其药物的生物利用度、峰值浓度因种族呈明显差异,瑞舒伐他汀钙在亚洲人的生物利用度、峰值浓度是西方人的2倍,且严重不良反应风险可随剂量增加而增加[11-12]。目前,国内临床应用瑞舒伐他汀钙时选择的起始剂量多为10、20 mg·d-1[13],但哪种剂量可获得更佳的有效性及安全性仍有待探究。本研究结果显示,B组患者总有效率显著高于A组,提示瑞舒伐他汀钙的临床效果呈一定的剂量依赖性,这与张兰芳等[14]的研究结果相符。
瑞舒伐他汀钙属于高选择性羟甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂,因分子中存在极性甲磺酰胺基,故呈相对亲水性,更易被肝细胞摄入,具有更强的HMG-CoA还原酶抑制作用,可抑制肝脏合成TC、TG,强化肝脏对LDL受体的摄取及分解、代谢,从而下调LDL-C水平,亦可使HDL-C水平升高[15]。本研究结果显示,治疗后2组患者血脂水平显著改善,但B组患者血脂水平改善更显著,提示20 mg·d-1的瑞舒伐他汀钙对血脂的改善作用更显著,这与陆阳等[16]的研究结果相符。但ZHANG等[17]研究显示,10、20 mg·d-1的瑞舒伐他汀钙的调血脂效应相当,并无显著差异。这可能与不同研究的样本数量、研究对象个体差异、疾病差异等多因素有关,这也提示探讨瑞舒伐他汀钙的合适剂量十分必要,仍需大量前瞻性、多中心研究予以持续补充及完善。
VEGF、ET-1、NO是反映血管内皮功能的重要标志物[18]。VEGF、ET-1分别与血管内皮细胞的生长分裂功能、血管内皮血氧供应情况密切相关,而NO则是血管内皮细胞的主要成分[19]。本研究结果显示,治疗后2组患者血清VEGF、NO水平显著升高,ET-1水平显著下降,且B组患者血清VEGF、NO、ET-1水平变化更显著;提示瑞舒伐他汀钙可有效改善血管内皮功能,且呈一定的剂量依赖性。这与AYDIN等[20]的研究结果结论相符。NO水平上升亦可上调VEGF表达,参与VEGF促血管内皮细胞分裂及生长过程,促进神经功能恢复。ET-1下降则可减轻脑梗死患者病灶区及周围缺血半暗带区自由基瀑布连锁反应,抑制神经细胞死亡[21]。本研究进一步比较了2组患者的神经功能缺损情况,结果显示,治疗后2组患者NIHSS评分显著降低,BI评分显著升高,且B组患者神经功能改善更显著;提示瑞舒伐他汀钙可显著改善脑梗死合并高脂血症患者的神经功能,且亦呈一定的剂量依赖性;这与李真等[22]的研究结果相符。但李真等[22]研究显示,观察组(瑞舒伐他汀钙20 mg·d-1)患者的不良反应发生率显著高于对照组,这与本研究结果存在差异。本研究结果显示2组患者不良反应发生率比较差异无统计学意义;与王太昊等[23]的研究结果相符。由此可见,瑞舒伐他汀钙剂量的增加并非一定会显著增加安全性风险。
综上所述,瑞舒伐他汀钙可有效改善脑梗死合并高脂血症患者的血脂水平、血管内皮功能及神经功能,且未发现增加安全性风险。但本研究尚有一定的局限性,样本量小、数据代表性欠缺等可能会造成结果偏倚,因此,尚需设计更严谨的研究思路,尽可能排除混杂因素的影响,开展大样本、多中心研究,持续补充和完善瑞舒伐他汀钙的临床应用资料。

