钛基化合物在锂硫电池中的应用
刘子琛,张 玢,谷思辰,吕 伟
(清华大学深圳国际研究生院,广东深圳518000)
开发新型高性能储能器件是能源及材料领域的研究热点和重点[1-2]。锂离子电池是目前较为成熟的电化学储能体系之一[3],然而受制于正负极材料有限的理论比容量,其能量密度无法继续提升,难以满足风能、太阳能等可再生能源大规模利用和电动汽车产业快速发展的需求[4]。以低成本的硫为正极、锂金属为负极的锂硫电池具有高的理论能量密度(图1),是颇具实用前景的下一代储能器件之一[5],但是其商业化应用仍面临诸多挑战[3,6-7]。单质硫(S8)及其放电产物硫化锂(Li2S)的导电性差,导致正极材料活性物质利用率低[8-9];在充放电过程中产生的中间产物多硫化锂(Li2Sn,4≤n≤8)易溶于醚类液态电解液,在电场和浓度梯度的作用下,多硫化锂会穿过隔膜从正极穿梭到锂负极并与锂金属发生副反应,造成活性物质的不可逆损失、锂金属负极的钝化和电解液的消耗[3];同时,硫转化为硫化锂的体积膨胀高达70%,从而造成电极结构的破坏[10]。此外,溶于电解液的多硫化锂向固相硫化锂的转化动力学较差,在高硫载量和长循环条件下,多硫化锂极易在电解液中累积,从而导致更为严重的穿梭效应。从上可知,多硫化锂的穿梭效应是导致锂硫电池性能差的主要原因之一,也是目前亟待解决的关键科学问题。

图1 不同电池体系的能量密度[2]Fig.1 Practical specific energies for somerechargeable batteries[2]
将高电导率、大比表面积且孔结构丰富的碳材料与硫进行复合可以提高正极导电性,同时可以物理吸附多硫化锂,实现电化学性能的提升[11]。然而,碳材料的非极性表面对极性多硫化锂的吸附能力较弱,并不能有效抑制穿梭效应,且碳材料较低的活性也难以促进多硫化锂的转化,改善反应动力学[7]。与碳材料相比,极性的过渡金属氧化物[12]、氮化物[13]、硫化物[14]和碳化物[15]等材料对多硫化锂具有较强的化学吸附能力,从而可以更为有效地抑制穿梭效应。此外,这些材料也往往都具有较好的催化活性,有利于改善多硫化锂的转化反应动力学[16]。钛基过渡金属化合物具有良好的化学稳定性以及多样的结构,在锂硫电池中得到了广泛研究,其主要优势:1)结构多样且易于调控。通过水热法、化学液相合成以及电化学等简单方法可以制备具有中空结构、花瓣状以及管状等不同形态和结构的钛基化合物,不但可以实现对硫或多硫化锂的物理限域,还可以最大化地暴露活性表面,实现化学吸附能力和催化活性的提升[10];2)大部分钛基化合物(例如碳化钛、氮化钛以及具有空位缺陷的氧化钛等)都具有优异的导电性,有利于多硫化锂转化过程中的快速电子传递,提高活性物质利用率和倍率性能[17];3)对多硫化锂吸附能力适中。如图2所示,与其他过渡金属化合物相比,钛基化合物对多硫化锂的吸附能力较为适中,既能确保多硫化锂的有效吸附,也能保证吸附的多硫化锂或其转化产物向导电基体表面的快速扩散,避免了过强吸附导致的表面钝化[18-19];4)在锂硫电池的电化学窗口范围内,多数钛基化合物具有良好的稳定性以及较低的化学反应活性,确保了其在长循环过程中的稳定性,也可以避免过高化学活性导致的电解液分解等副反应,利于提升电池的长循环稳定性[17,20]。

图2 常见化合物对Li2S6(3 mmol/L)的吸附能力[18]Fig.2 Adsorption capacity of common compounds to Li2S6(3 mmol/L)[18]
本文系统总结了不同钛基化合物抑制多硫化锂穿梭效应的物理限域、化学吸附和催化转化作用,重点讨论并比较了钛基化合物种类、结构及表面化学对锂硫电池容量、倍率性能以及循环稳定性的影响,最后展望了其未来发展方向及促进锂硫电池实用化的可能性。
1 钛基化合物抑制多硫化锂穿梭效应的主要作用方式
如前所述,钛基化合物抑制穿梭效应主要通过物理限域、化学吸附以及其催化转化能力实现。如图3a所示,物理限域主要是通过合成核壳或中空结构将形成的多硫化锂限制在中空结构内,阻止其向电解液中扩散[10],或者通过形成的物理屏障阻止电解液与硫的直接接触,抑制多硫化锂在电解液中的溶解。化学吸附则主要依赖极性化合物中带部分正电荷的金属元素和带部分负电荷的氧、硫、氮等元素分别与多硫化锂中的多硫离子和锂离子形成的化学键[21-22],将多硫化锂锚定在正极附近,从而抑制多硫化锂向负极穿梭。
锂硫电池中,多硫化锂向硫化锂反应的动力学较差(图3 d),是导致多硫化锂在电解液中累积并导致严重穿梭效应的主要原因之一。钛基化合物是一种常用的催化材料,在光催化、电催化以及化学合成等领域都具有非常广泛的应用。因此,钛基化合物在锂硫电池中也可以催化多硫化锂及硫化锂的转化反应,降低反应能垒,改善电池的反应动力学。由于多硫化锂的转化是一个多电子转移过程,快速的电子传输对增强反应动力学具有重要意义。对于导电性相对较差的TiO2而言,虽然其具有较好的吸附能力,但是吸附的多硫化锂往往需要扩散到导电基体完成转化[21],形成的固态硫化锂往往更加倾向于沉积在二氧化钛和导电基体的界面处。因此,如何优化界面数量和结构是改善其促进多硫化锂转化能力的关键。导电性较好的Ti4O7[23]、TiC[24]或TiN[25]可以吸附并向多硫化锂传递电子,使多硫化锂无需扩散就可以在催化剂基体上被还原为硫化锂[26],催化多硫化锂转化所需的能垒更低,但是需要界面改性或构建复合结构提升其对多硫化锂的吸附能力和接触面积,进一步提升其催化效率。

图3 钛基化合物在抑制穿梭效应的作用机理(a)物理限域、(b)化学吸附、(c)催化转化;(d)锂硫电池反应不同阶段的动力学[27]Fig.3 Schematic of titaniumbased compounds in inhibiting shuttle effect(a)physical confinement,(b)chemical adsorption,and(c)catalytic conversion;(d)Reaction kinetics of lithiumsulfur batteries[27]
2 不同钛基化合物在锂硫电池中的应用
常见的钛基化合物主要包括氧化物、氮化物、碳化物和钛基异质结构化合物,表1列出了钛基化合物应用在锂硫电池中的电化学性能。

表1 钛基化合物型锂硫电池的电化学性能Table 1 Electrochemical performance of titanium-based compound lithium-sulfur battery
2.1 氧化物
TiO2是十分稳定的钛基氧化物,由于Ti和O的电负性存在差异,Ti带有部分正电荷可以和带负电的多硫离子发生偶极-偶极相互作用,O带有部分负电荷,可以与多硫化锂中的锂离子相互吸引。因此,TiO2可以通过上述的化学键将多硫化锂吸附在表面,抑制其扩散。
不同晶型的TiO2对多硫化锂的吸附能力不同,研究人员通过实验和理论计算对其进行了探索。2012年,Nazar课题比较了3种不同晶型(α、β、γ)的TiO2的性质及其对锂硫电池电化学性能的影响[31]。通过红外吸收光谱和拉曼光谱可发现α-TiO2与多硫化锂形成了化学键(S—Ti—O),表现出最强的多硫化锂的吸附能力(图4a~4b),可更为有效地抑制多硫化锂的穿梭效应。使用α-TiO2作为添加剂的正极表现出了更好的电化学性能,首次放电容量达到1 200 mA·h/g,在1C的电流密度下循环200次后,仍具有876 mA·h/g的容量,高于添加β-TiO2和γ-TiO2的正极。Xin等[41]通过理论计算研究了不同晶型TiO2与Li2S的结合能,进一步证明多硫化锂与α-TiO2(101)晶面的结合能(2.30 eV)高于β-TiO2(110)晶面的结合能(2.18 eV)。
将TiO2设计成为具有中空结构的纳米纤维[42]、纳米颗粒[43]、纳米管[44]包裹硫,可以最大限度地发挥TiO2对多硫化锂的吸附能力,同时还能缓冲多硫化锂在充放电过程中的体积膨胀。Cui等[10]利用钛酸四丁酯的水解反应在硫颗粒表面生成TiO2球壳结构,再用甲苯将TiO2球壳内部的部分硫溶解,制备了具有“蛋黄-蛋壳”结构(图4d)的锂硫电池正极。其中TiO2可吸附和限域多硫化锂降低活性物质损失,其内部空间可以缓冲硫正极在充放电过程中的体积变化,在0.5C下,上述复合正极材料初始放电容量达到1 030 mA·h/g,在循环1 000次之后仍能维持690 mA·h/g的比容量,库伦效率始终在98.4%以上,每周衰减率仅为0.033%。虽然TiO2对多硫化锂有较强的吸附能力,但其本征导电性较差,电导率低于10-10S/cm,TiO2吸附的多硫化锂需要扩散到导电基体才能完成转化。因此将TiO2与导电基体复合可以提升电极整体导电性,保证多硫化锂转化过程中的快速电子传递[45]。Wu等[32]将TiO2包裹硫负载在导电聚吡咯纳米线上,制备得到了硫@二氧化钛/聚吡咯(S@TiO2/PPy)复合正极。中空的TiO2纳米球壳结构抑制了多硫化锂的扩散,同时导电聚合物吡咯纳米线作为导电网络贯穿于S@TiO2中,提升了电极整体的导电性,这种复合电极在0.2C时有1 385.9 mA·h/g的高初始比容量,循环过程中每周衰减率仅为0.047%。
在TiO2中构建缺陷可提高其自身电导率,常见的缺陷如氧空位可以增加TiO2内的Ti3+和孤对电子,增加TiO2内部载流子密度从而提升其电导率[46-47]。Cui等[28]在氢气氛围下对TiO2进行热处理,得到了含有氧空位和高电导率的TiO2-x核壳结构(图4e),可显著提升正极的容量,使锂硫电池首周比容量达到1 100 mA·h/g,0.5C下循环400次后仍能保有700 mA·h/g的容量。Wang等[29]通过顺序模板法制备了空心多层壳结构的TiO2-x,TiO2-x中少量的Ti3+原子极大提升了材料的导电性,其多层的壳结构提供了多重阻隔抑制多硫化锂穿梭,其多层壳之间的空隙为硫正极的体积膨胀提供了缓冲空间。在0.5C下,使用空心多壳结构的TiO2-x作为硫载体的电池具有903 mA·h/g的比容量,循环1 000次后比容量仍能达到720 mA·h/g,库伦效率保持在97.5%以上。
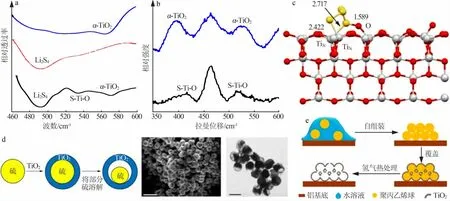
图4 α-TiO2、Li2S4和α-TiO2吸附Li2S4后的红外光谱(a)与拉曼光谱(b)[31];TiO2吸附S42-的分子构型(c)[41];具有“蛋黄-蛋壳”结构的硫-TiO2正极制备示意图与形貌表征(d)[10];具有中空球壳结构的TiO2-x制备过程示意图(e)[28]Fig.4 (a)FTIRspectra and(b)Raman spectra of neatα-TiO2,Li2S4,andα-TiO2/Li2S4[31];Adsorption models of the S42-upon the(001)crystal plane of the anatase TiO2(c)[41];Schematic of the synthetic process and characterization of sulfur-TiO2 yolk-shell nanostructures and SEM images(d)[10];Schematic diagram of the preparation process of TiO2-x with hollow spherical shell structure(e)[28]
进一步提高TiO2中氧空位的比例,当钛氧原子比达到n∶(2n-1)时,钛氧化物材料转变为Magnéli相(TinO2n-1)。TinO2n-1既可有效吸附多硫化锂,又具有良好的导电性,可有效提升锂硫电池的硫利用率和倍率性能。在众多Magnéli相的钛氧化物中,Ti4O7具有最佳的电导率(2×103S/cm)。Nazar等[23]将Ti4O7应用在锂硫电池正极中,见图5a和5b,Ti4O7对多硫化锂有较强的吸附作用,可以使得淡黄色的Li2S4溶液快速变色,X射线光电子能谱(XPS)和X射线近边吸收谱(XANES)(图5c和5d)也表明多硫化锂与Ti4O7存在较强的相互作用。理论计算结果显示钛氧化物中的低配位钛可以稳定硫团簇,促进Ti4O7与多硫化锂形成强化学键[48]。使用Ti4O7的正极复合材料Ti4O7/S-60(硫质量分数为60%)在0.2C下的初始比容量为1 069 mA·h/g,在0.5C下100次循环的容量保持率为88%,每个循环的衰减率为0.08%。

图5 Ti4O7对Li2S4的吸附机制示意图(a);多硫化锂吸附试验:1—Li2S4溶液空白对照组、2—添加石墨、3—添加Vulcan XC-72(VC)碳、4—添加Ti4O7(b);Li2S4、Li2S4/VC碳和Li2S4/Ti4O7的S 2p的XPS光谱图(c);Ti4O7/S-60和VC/S-60的XANES光谱(d)[23];TiO2(110)和Ti4O7(1-21)晶面对不同硫物种吸附能的计算结果(e)[48]Fig.5 Schematic showing the electron density transfer between Li2S4 and TiO x(a);Lithium polysulfide adsorption test:1—Li2S4 solution with nothing;2—with graphite;3—with VC carbon;4—with Ti4O7(b);XPS S 2p spectra of Li2S4,Li2S4/VC carbon and Li2S4/Ti4O7(c);Distribution of sulphur species upon discharge determined by operando XANES(d)[23];DFT analysis of the adsorption of S species on TiO2(110)and Ti4O7(1-21)surfaces(e)[48]
除Ti4O7外,TiO也是常见的Magnéli相钛氧化物。Lou等[30]通过硬模板法逐次在聚苯乙烯纳米球表面包覆二氧化钛和聚多巴胺,碳化后得到了碳包覆TiO的双层壳结构(TiO@C)。极性的TiO对多硫化锂的强吸附能力和TiO@C双层壳层的结构可有效抑制多硫化锂的扩散。使用TiO@C为硫载体的正极在0.1C下具有1 100 mA·h/g的比容量,在0.2C和0.5C可稳定循环500次,每次容量衰减仅为0.08%。高硫负载电极(4 mg/cm2)在0.2C的倍率下,仍能表现出700 mA·h/g的容量。正极经历长循环后表面完整性较好,无开裂和活性物质脱落。
2.2 氮化物
氮化钛(TiN)的晶体结构为面心立方,其中Ti原子占据立方的顶点和面心,氮原子位于钛原子的八面体间隙中。由于同时含有金属键、共价键和离子键,TiN具有较高的电导率(104S/cm)和硬度。Ti—N还具有极性,也可吸附多硫化锂[49]。Manthiram团队比较了介孔TiN、介孔TiO2和Vulcan XC-72碳3种材料复合硫后作为正极的电化学性能[33]。结果表明,TiO2虽然对多硫化锂具有较强的吸附性,但导电性较差,因此TiO2-S电极阻抗大、极化大、初始比容量小。碳材料虽然具有导电性,但与多硫化锂的相互作用力弱,正极容量衰减快。相比于TiO2和碳,TiN与硫复合后的正极展现出最优的电化学性能。对于TiN等本征导电性较好的材料,其改性的主要方向是增大比表面积和非金属杂原子掺杂以提升对多硫化锂的吸附能力。Zhang等[34]则使用氢氟酸刻蚀商业TiN细化其颗粒,增大了其比表面积,紫外可见吸收光谱和XPS测试结果都表明TiN与多硫化锂存在较强的相互作用,因此S/TiN正极表现出更好的电化学性能,0.5C下首次放电比容量为1 012 mA·h/g,即使在5C下,其可逆容量仍能达到550 mA·h/g。在TiN表面引入Ti—O化学键可以提升其对多硫化锂的吸附性能。Wang等[36]对TiN表面进行了可控氧化(TiN—O)。可视化多硫化锂吸附实验显示TiN—O对多硫化锂的吸附能力明显高于未掺杂的TiN。这种氧化过程也可以在TiN上产生电荷极化效应,增强了TiN表面锂离子的传输效率,TiN—O中锂离子传输系数最高可达7.9×10-8cm2/s(图6a)。电荷极化效应也促进了电子传输,使用TiN—O的锂硫电池在5C下循环200次后仍具有600 mA·h/g的比容量,容量几乎无衰减。
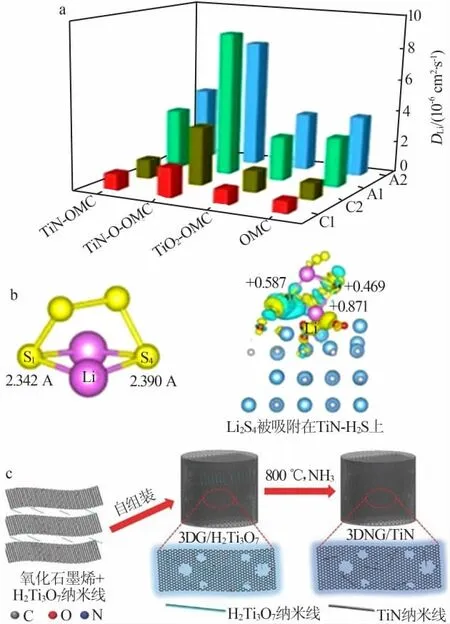
图6 TiN、TiN—O、TiO2负载在OMC上后锂离子的传输速率(a)[36];Li2S4在TiN-H2S表面键长计算结果(b)[35];3DNG/TiN自支撑材料制备示意图(c)[25]Fig.6 Transmission rate of lithium ions after TiN,TiN-O,TiO2 loaded on OMC(a)[36];Li2S4 bond length calculation results on TiN-H2S surface(b)[35];Schematic of the fabrication of the 3DNG/TiN(c)[25]
虽然TiN材料具有良好的导电性,但纳米TiN颗粒表面在空气中容易形成氧化层,这会阻碍TiN和多硫化锂间的电子传输。本课题组使用H2S对TiN表面进行硫掺杂,将氧化层中的部分Ti—O转化为更利于电子转移的Ti—S,得到了具有高活性表面的TiN(TiN-H2S)[35],如图6b所示,表面的Ti—S键提升了TiN的催化多硫化锂转化的活性,使用TiN-H2S作为中间层的锂硫电池在1C下循环500次仍能保持713.5 mA·h/g的比容量。
除了对TiN材料本身进行改性外,TiN还可与其他材料复合制备具有更加丰富形貌和功能的TiN复合材料。Mai等[25]使用了氧化石墨烯(GO)和H2Ti3O7纳米线混合,并引入抗坏血酸钠实现GO的还原和自组装,制备了三维石墨烯/H2Ti3O7材料(3DG/H2Ti3O7),之后将其在氨气氛围下热处理得到三维掺氮石墨烯/TiN(3DNG/TiN)(图6c)。三维石墨烯结构可以提供电子和离子传输通道,均匀分布在石墨烯上的TiN可以吸附多硫化锂,加快了多硫化锂的转化。无需使用添加剂和导电剂,3DNG/TiN直接与硫复合制备的正极即可展现出优异的电化学性能,在1C下循环200次后比容量仍高达957 mA·h/g,在超高硫载量(9.6 mg/cm2)下仍能稳定循环80次,并且比容量始终维持在1 000 mA·h/g以上。
2.3 碳化物
TiC的晶体结构和TiN相同,也具有良好的导电性和对多硫化锂较强的吸附能力,Yu等[37]设计了一种TiC纳米颗粒(TiC-NPs)附着在直径为100 nm的碳纳米纤维(CNFs)上的混合电极TiC-NPs-CNFs,尽管这种复合材料的比表面积(66.52 m2/g)较小,对多硫化锂的物理限域作用有限,但TiC可与多硫化锂形成S—Ti—C键将其紧紧地锚定在正极。复合硫后制备的正极(S/TiC-CNFs)的初始比容量可达1 253 mA·h/g,200次循环后的可逆比容量仍为1 026 mA·h/g。此外,电流密度增至2C时仍表现出634 mA·h/g的可逆容量。TiC也具有较强的催化多硫化锂转化的能力[24],见图7a,由于TiC具有良好的导电性,TiC吸附多硫化锂后,使Li2S可以直接在TiC表面及碳基体的边缘处成核,避免了多硫化锂的表面扩散过程。在高硫载量(3.5 mg/cm2)电极中,使用TiC的硫正极初始比容量接近1 000 mA·h/g,在0.2C下循环100次后仍有700 mA·h/g的比容量(图7b~7c)。

图7 多硫化锂在导电极性化合物TiC上的还原机理图(a);Li2S和Li2S4在TiC(100)和石墨烯上的吸附能计算结果(b);使用TiC@石墨烯作为正极的电池循环数据(c)[24]Fig.7 Diagram of the reduction mechanism of lithium polysulfide on the conductive polar compound TiC(a);Calculation results of adsorption energy of Li2S and Li2S4 on TiC(100)and graphene(b);Cycling performance of cells containing TiC@G as cathode(c)[24]
2.4 异质结构
在锂硫电池正极反应中,催化剂催化多硫化锂的转化过程涉及多硫化锂的吸附、扩散、催化转化以及产物脱附等步骤,但是一种材料往往难以适用于上述所有过程[50]。针对上述问题,本课题组提出了一种TiO2-TiN异质结构[39]。见图8a,TiO2具有对多硫化锂较强的吸附能力,TiN可快速催化多硫化锂转化,二者界面提供了多硫化锂的有效吸附、快速扩散通道。将TiO2-TiN负载到石墨烯后制备中间层应用在锂硫电池中,在硫负载量3.1 mg/cm2和4.3 mg/cm2时,1C下循环2 000次后依然有503 mA·h/g和331 mA·h/g的比容量,容量保持率高达73%和67%。利用石墨烯作为模板和碳源,利用原位化学反应制备出了片状石墨烯-TiC异质结构[40],这种面内异质结构具有大的表面积以及丰富的界面,大大降低了离子/电子的扩散势垒,保证了多硫化锂高效吸附和转化,将其作为锂硫电池的中间层,在1C下循环500次后容量保持率高达84%。
在放电过程中,多硫化锂转化为固相Li2S,在充电过程中,Li2S向多硫化锂的转化势垒高,容易造成其转化不完全形成“死硫”覆盖在催化剂表面,造成催化剂失活,因此构建双向催化剂在锂硫电池中至关重要。通过在Ni3S2表面原位生长TiO2纳米颗粒构建了Ni3S2-TiO2异质结构,实现了锂硫电池中的双向催化转化[38]。如图8b和8c所示,在还原反应中TiO2吸附的多硫化锂扩散到Ni3S2表面,引导Li2S的快速沉积和成核,在氧化反应中TiO2和Ni3S2都可以催化其表面的Li2S氧化,从而实现Li2S的充分转化。因此,Ni3S2-TiO2异质结构与石墨烯复合后作为硫正极的载体,有效提高了正极的循环稳定性,在900次循环中每周的容量衰减仅为0.038%。

图8 多硫化锂在TiO2、TiN和TiO2-TiN异质结构上的转化过程(a)[48];多硫化锂的催化还原过程(b);硫化锂的非催化氧化过程和催化氧化过程(c)[50]Fig.8 Schematic of LiPS conversion processes on TiN,TiO2 and the TiO2-TiN heterostructure surface(a)[48];Catalytic reduction process of lithium polysulfide(b);Non-catalytic oxidation process and catalytic oxidation process of lithium sulfide(c)[50]
3 结论和展望
钛基化合物结构丰富可调,对多硫化锂有适中的吸附能力及良好的催化性能,是一种极具潜力的锂硫电池正极载体材料或功能组分。虽然目前的研究表明,钛基化合物可通过调整结构实现物理限域和化学吸附抑制多硫化锂的穿梭,也可以通过催化加速多硫化锂的氧化还原反应,提升硫正极活性物质的利用率和高硫载量锂硫电池的倍率性能。但是,锂硫电池难以满足实现产业化应用的高硫载量(>5 mg/cm2)、低电解液/硫比(<5μL/mg)和长循环稳定性等指标[51]。因此,通过构建三维导电结构、制造缺陷、掺杂等方式可有效调节钛基化合物的导电性和对多硫化锂的吸附能力,提升钛基化合物在高硫载量、低液固比等条件下抑制多硫化锂穿梭副反应和促进多硫化锂转化的能力,进而提升硫正极的电化学性能。此外,钛基化合物仍存在比面积小、质量大、催化多硫化锂转化的机制不清以及具有催化电解液分解的风险等一系列问题,在未来的研究中需要重点关注和解决。综上所述,在锂硫电池中引入催化剂为解决穿梭效应和提高循环稳定性提供了新的解决思路。

