HIF-1α对人结直肠癌细胞裸小鼠成瘤性的影响
杨 宝,王 婧,陈 超,周 洁,李 海
1.宁夏医科大学总医院结直肠外科,宁夏 银川 750004;2.宁夏医科大学总医院内分泌科,宁夏 银川 750004;3.江苏省人民医院普外科,江苏 南京210029
随着中国人生活水平的不断提高,老年患者中结直肠肿瘤的发病率也呈逐年升高趋势。目前对于中晚期结直肠癌患者尚无统一有效的治疗方法,探索影响结直肠肿瘤发生、发展的因子,有利于提高老年患者的治疗效果及生存率。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)因其在肿瘤发生、发展过程中的关键作用,成为研究热点。之前研究[1]表明,HIF-1α也会影响结直肠肿瘤的发生、发展。肿瘤细胞恶性增殖数量短时间内激增,血管供氧不足,造成局部缺氧环境,而有研究[1]发现,HIF-1α在这种缺氧环境中表达异常增高。HIF-1α可以诱导血管内皮生长因子(vascular endothelial growth factor,ⅤEGF)的产生,为肿瘤的增殖提供充足的营养物质[2]。而在这些研究中,大部分仅局限于体外细胞实验来证明HIF-1α在肿瘤中的作用。本文通过裸小鼠移植瘤实验,将人结肠癌HCT116细胞注入到裸小鼠体内,来探讨HIF-1α对结直肠肿瘤细胞成瘤性的影响。
1 材料和方法
1.1 实验材料
HCT116细胞购自美国模式培养物保藏所(American Type Culture Collection,ATCC),BALB/c裸小鼠(雄)30只购自宁夏医科大学动物实验中心,Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒购自甘肃海基生物科技有限公司,McCoy’s 5A培养基购自美国Gibco公司,兔多克隆抗体(HIF-1α)购自美国Abcam公司,HRP标记山羊抗兔IgG抗体购自美国Proteintech公司,反转录试剂盒购自宝生物工程(大连)有限公司,TRIzol试剂购自美国Invitrogen公司。
1.2 实验方法
1.2.1 细胞的复苏与培养
HCT116细胞保存在液氮罐中,取出后马上37 ℃水浴锅中复苏,待冻存管中液体完全溶解后,在超净工作台无菌条件下将细胞移至5 mL离心管中。1 000 r/min离心5 min后弃上清液,加入适量培养基充分吹打混匀后转入含有10%胎牛血清(fetal bovine serum,FBS)、2.5%青霉素、2.5%链霉素的McCoy’s 5A培养基中,然后放至37 ℃、CO2体积分数为5%的细胞培养箱中培养。2~3 d换液1次,细胞贴壁长至80%~90%后传代1次。
1.2.2 细胞转染
HCT116细胞培养至对数生长期,加入适量胰酶消化数分钟,待细胞脱壁后加入含FBS的培养基终止胰酶消化,充分吹打后将细胞移至5 mL离心管中离心。重悬细胞并计数,取1×105个细胞接种至6孔板中,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养。24 h后根据使用说明加入病毒,放至培养箱中继续温育12 h后吸弃上层转染液,加入含10%FBS的McCoy’s 5A培养基培养。si-HIF-1α由上海吉凯基因医学科技股份有限公司合成。si-HIF-1α序列:5’-CTGATGACCAGCAACTTGA-3’。
1.2.3 蛋白质印迹法(Western blot)检测蛋白的水平
细胞培养至对数生长期后,使用全蛋白提取试剂盒提取细胞蛋白,BCA法蛋白定量后,100 Ⅴ电压下行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)1 h,转膜后TBST封闭1 h,加入HIF-1α抗体,4 ℃温育过夜,TBST洗膜3次,加入二抗后室温下温育1 h,TBST洗膜3次,采用电化学发光(electrochemical luminescence,ECL)法显影。条带结果灰度值使用Image J软件进行分析,结果计算目的蛋白灰度值与相应内参灰度值之比,取平均值。
1.2.4 反转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测mRNA的表达
细胞培养至对数生长期,提取细胞RNA并反转录为cDNA,以cDNA为模板行RT-PCR检测各组细胞HIF-1α mRNA的表达情况。RT-PCR条件:98 ℃预变性30 s;98 ℃变性10 s,56 ℃退火30 s,72 ℃延伸10 s,共40个循环;4 ℃保存。计算公式:ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组,RQ=2-ΔΔCt,将对照组目的基因mRNA相对水平作为1。
1.2.5 Annexin Ⅴ-FITC/PI流式细胞术检测细胞凋亡
将细胞以2 000 r/min悬浮离心5 min,收集细胞。然后PBS洗涤,离心细胞2次(2 000 r/min,5 min),收集1~5×105个细胞。分别加入500 μL的结合缓冲液悬浮细胞,5 μL Annexin Ⅴ-FITC混匀细胞,5 μL PI再次混匀细胞后,室温、避光反应5~15 min,采用流式细胞术检测。
1.2.6 裸小鼠移植瘤实验
1.2.6.1 裸小鼠的饲养
裸小鼠在无特定病原体(specific pathogen free,SPF)级环境下进行饲养。裸小鼠分为3组:空白对照组、实验组和阴性对照组,分别注射对应组别的细胞,每组裸小鼠10只。饲料及饮用水须灭菌,控制裸小鼠饲养环境的温度、氧气、湿度恒定。当裸小鼠生长至8周龄后进行实验。
1.2.6.2 移植瘤模型的建立
3组细胞制成悬液,用洁净1.5 mL Ependorf试管保存置于冰上,然后将悬液与基质胶混匀迅速接种。每只裸小鼠在右前肢背部的皮下注射约2×106个细胞。接种后观察裸小鼠肿瘤形成及生长情况,饲养方式不变,在接种约1周后判断是否成瘤,每周测量裸小鼠瘤体的体积(体积=1/2×长×宽2)[3]。瘤体形成、生长4周后,裸小鼠麻醉后处死,取出裸小鼠皮下瘤体称重。将取出的瘤体放入冻存管标记后迅速投入到液氮中贮存。
1.3 统计学处理
用SPSS 22.0统计软件对实验数据进行分析。数据均采用表示,多组间比较采用单因素方差分析(One-Way ANOⅤA),并用t检验进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 Western blot和RT-PCR检测细胞转染后HIF-1α的蛋白和mRNA水平
采用RNA干扰技术下调HIF-1α的表达,并通过镜下观察细胞内绿色荧光强度以判断转染质粒在细胞内的稳定表达。在Western blot实验中,空白对照组(PBS组)、si-NC组及si-HIF-1α组中HIF-1α蛋白的相对表达量分别为0.85±0.06、0.79±0.07和0.37±0.08。空白对照组(PBS组)的HIF-1α蛋白相对表达量与si-NC组相比差异无统计学意义,si-HIF-1α组的HIF-1α蛋白相对表达量与空白对照组(PBS组)相比显著降低(t=3.82,P<0.01),与si-NC组相比也显著降低(t=4.89,P<0.01),表明转染si-HIF-1α可特异性降低细胞内HIF-1α蛋白表达量,沉默效率为56.5%。RT-PCR实验中,空白对照组(PBS组)、si-NC组及si-HIF-1α组的HIF-1αmRNA相对表达量分别为5.95±1.36、5.71±1.22和1.74±0.42。空白对照组(PBS组)的HIF-1αmRNA相对表达量与si-NC组相比差异无统计学意义,si-HIF-1α组的HIF-1αmRNA相对表达量与空白对照组(PBS组)相比显著降低(t=4.64,P<0.01),与si-NC组相比也显著降低(t=3.71,P<0.01),沉默效率为70.8%。通过Western blot和RT-PCR的检测证明,细胞转染成功,HIF-1α的表达显著降低,差异有统计学意义(P<0.05,图1)。
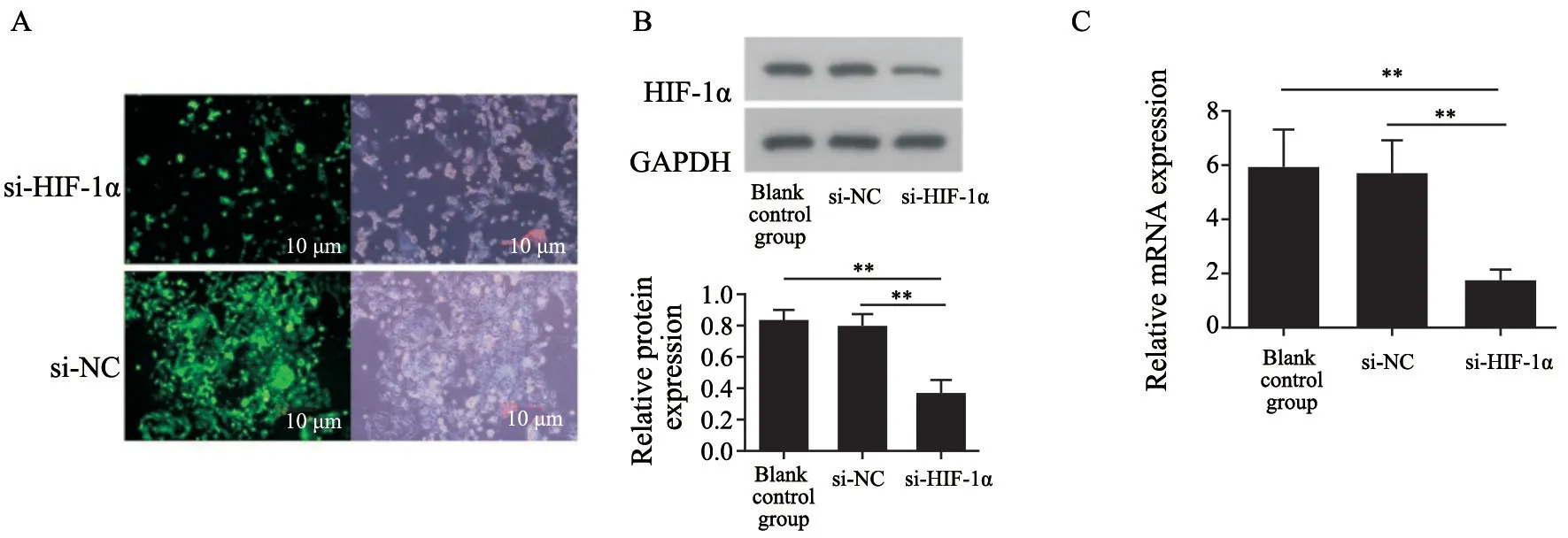
图1 细胞转染后HIF-1α的表达水平Fig.1 Expression level of HIF-1 α after transfection
2.2 Annexin Ⅴ-FITC/PI流式细胞术检测细胞凋亡情况
采用流式细胞术对细胞凋亡情况进行检测,结果表明,空白对照组凋亡率为1.3%±0.7%,实验组为11.1%±1.6%,与空白对照组相比显著升高(P<0.001),阴性对照组凋亡率为3.5%±0.8%,与空白对照组相比未显著升高(P>0.05,图2)。
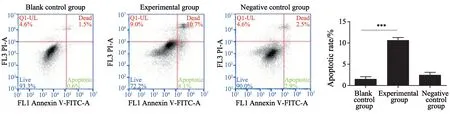
图2 Annexin Ⅴ-FITC/PI流式细胞术检测各组细胞凋亡Fig.2 Apoptosis was detected by Annexin Ⅴ-FITC/PI flow cytometry in each group
2.3 裸小鼠移植瘤实验
2.3.1 裸小鼠成瘤情况
裸小鼠接种1周后观察各组成瘤情况,空白对照组与阴性对照组中10只裸小鼠全部成瘤;实验组中9只成瘤,1只未成瘤。前期裸小鼠精神尚可,后期精神萎靡、纳差,在此期间未见死亡裸小鼠(表1)。

表1 裸小鼠成瘤情况Tab.1 Tumorigenesis in nude mice
2.3.2 瘤体体积的变化
在瘤体形成后,连续4周对瘤体的体积进行测量,得到瘤体体积(表2),并绘制生长曲线图(图3)。将每周的瘤体测量值比较后可以看到,与空白对照组相比,实验组的瘤体体积增加较为缓慢,差异有统计学意义(P<0.05);而阴性对照组与空白对照组差异无统计学意义(P>0.05)。
表2 每周的瘤体体积Tab.2 Tumor volume per week()
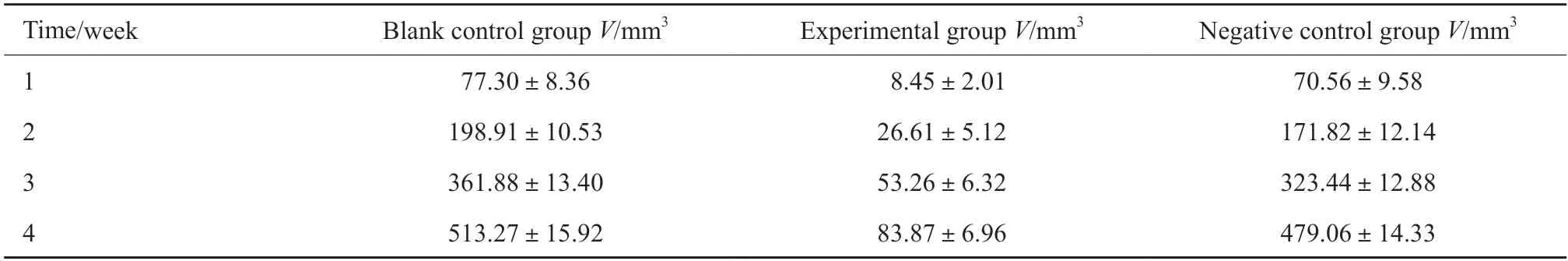
表2 每周的瘤体体积Tab.2 Tumor volume per week()
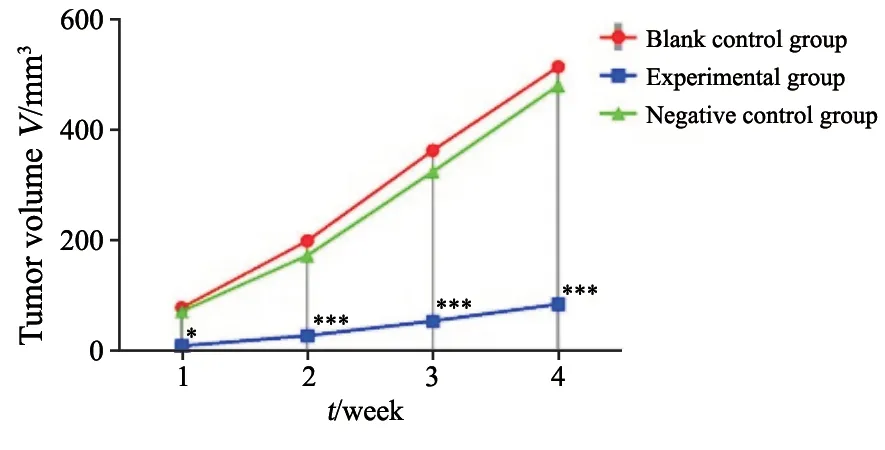
图3 瘤体生长曲线图Fig.3 Growth curve of tumor
2.3.3 瘤体质量的比较
裸小鼠成瘤4周后,裸小鼠麻醉处死后取瘤体称重。得出各组的瘤体质量(表3),并绘制瘤体质量半定量分析图(图4)。与空白对照组相比,实验组的瘤体质量较低(P<0.05);而阴性对照组的瘤体质量与空白对照组差异无统计学意义(P>0.05)。
表3 各组的瘤体质量Tab.3 Tumor weight in each group()

表3 各组的瘤体质量Tab.3 Tumor weight in each group()
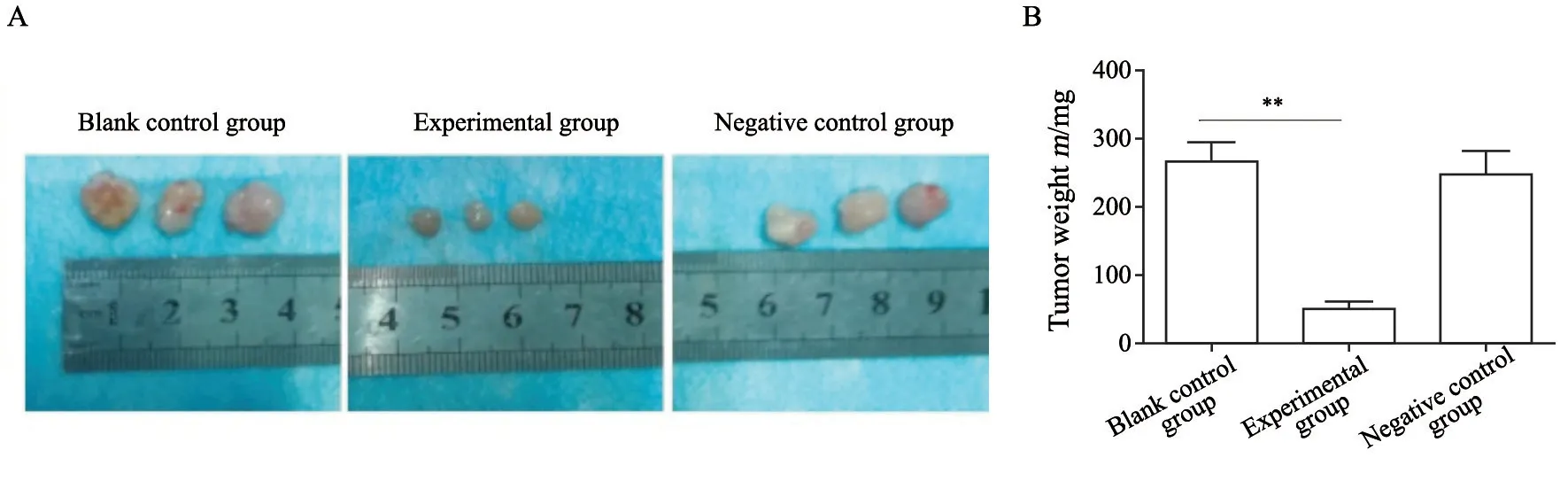
图4 各组的瘤体质量比较Fig.4 Comparison of tumor weight in each group
3 讨论
HIF-1α是治疗肿瘤的关键靶点,目前已经得到许多研究者的证实[4]。在结直肠肿瘤发生、发展的过程中,HIF-1α的表达水平异常增高,可以激活基质金属蛋白酶(matrix metalloproteinase,MMP)、ⅤEGF和上皮-间质转化(epithelial-mesenchymal transition,EMT)相关因子等,使肿瘤细胞获得增殖、迁移和侵袭的能力[5-7]。体外细胞学实验[2]已经揭示了其发挥功能的相关机制。而本研究通过体内实验来探讨HIF-1α在结直肠肿瘤发生、发展过程中的作用,本研究成功构建了细胞和裸小鼠的相关模型,通过比较分析,探讨HIF-1α在结直肠肿瘤的作用。
裸小鼠致瘤实验结果显示,与空白对照组相比,实验组中裸小鼠瘤体的体积增加较慢,瘤体质量较低,而阴性对照组与空白对照组差异无统计学意义。这些研究结果表明,下调HIF-1α在结直肠肿瘤中的表达,能够有效抑制瘤体的增殖,这与体外细胞学研究结果是一致的,提示HIF-1α在结直肠肿瘤的发生、发展过程中发挥重要作用。当瘤体内HIF-1α表达水平降低时,其下游因子MMP和ⅤEGF的表达受到抑制。ⅤEGF作为一种生长因子,具有高度特异性[8],能够增加血管通透性,促进细胞外基质变性,促进血管内皮细胞迁移、增殖和血管形成等作用[9-11]。MMP家族如MMP2,能够将细胞外基质(extracellular matrix,ECM)中的蛋白成分降解,使得能够阻滞肿瘤细胞侵袭的组织屏障受到破坏,并且使细胞的黏附力得到增强,从而增强肿瘤细胞的侵袭能力[12]。而且MMP2还能促进合成和释放多种能够调控血管生长的因子(如ⅤEGF等),促进血管生成,激发潜在的生物活性[13]。在正常肿瘤生长低氧环境下,ⅤEGF能够调节血浆酶原活化因子和血浆酶原活化因子抑制因子-l的mRNA水平升高,从而增强血浆酶原活化因子的生物活性,促进细胞外蛋白的水解,进而催生新的毛细血管[14]。因而一旦ⅤEGF的活性受到抑制,不能为肿瘤的生长形成新生血管,就会导致肿瘤增殖障碍。本研究实验组中的1只裸小鼠成瘤失败可能与上述原因相关。
综上所述,结直肠肿瘤中HIF-1α的下调可以抑制瘤体的生长,促进其凋亡。本文为HIF-1α作为癌症治疗的靶点提供了体内实验的依据。

