外泌体中circ_0044366调控肿瘤相关成纤维细胞MMP2的表达促进结直肠癌转移的机制研究
马维东,王彤彤,朱启航,杨海鸥,林 丹
天津医科大学肿瘤医院胰腺肿瘤科,天津300060
结直肠癌(colorectal cancer,CRC)是全球癌症死亡的主要原因之一,CRC发病年龄呈现年轻化趋势[1]。多种危险因素(如遗传因素、生活方式、饮食习惯和环境影响)均能诱发CRC的发生、发展[2]。尽管最近CRC治疗(包括化疗和放疗)取得了进展,但是CRC的预后仍然相对较差[3],导致CRC患者的生存率相对较低,目前死亡率为12%~87%[4]。转移是CRC患者死亡的主要原因[5],其中肝转移约占这些死亡的60%[6-7],因此与CRC转移相关的分子生物标志物的鉴定对于CRC的后续治疗和延长患者生存期至关重要。
外泌体是一种纳米级的(30~100 nm)细胞外囊泡,可由大多数类型的细胞分泌,并在体液(如血液、尿液、唾液和母乳)中循环[8]。近年来,有研究[9]表明,外泌体在CRC的进展中作用广泛。外泌体内容物广泛,可包裹各种生长因子、蛋白质、脂质、核酸,以及环状RNA(circular RNA,circRNA)、miRNA等非编码RNA,并将其转运到靶细胞中。circRNA是一种新型的具有共价闭环结构的内源性RNA[10]。在细胞中,circRNA不仅可以与miRNA或蛋白质结合以发挥各种功能[11],而且可以与其他核酸、脂质和蛋白质一起被分选进入细胞外囊泡中。外泌体从细胞分泌到体液中,circRNA通过体液开始其循环并激活其生物学功能。
目前有多项研究[12-14]发现,circRNA作为miRNA分子海绵参与CRC细胞的增殖、迁移、侵袭和凋亡等病理生理学过程,并且某些circRNA作为miRNA分子海绵与CRC放疗敏感性有关。circ_0055625通过吸附miR-106b-5p,抑制其发挥功能,间接激活ITGB8信号通路,从而促进CRC的进展[15]。还有研究[16]表明,circRAE1通过结合miR-338-3p影响TYRO3的表达,显著促进CRC细胞的迁移和侵袭。因此,circRNA/miRNA/靶基因/靶蛋白轴可能是CRC发生的重要环节之一。基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)是一种具有Ⅳ型胶原降解特性的蛋白质[17]。本研究旨在探讨CRC细胞分泌外泌体包裹的circ_0044366转运至肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)中,通过吸附miR-29b对CRC侵袭及转移的影响及其可能的作用机制,为寻找CRC侵袭和转移的生物标志物提供有意义的实验依据。
1 材料和方法
1.1 研究对象
随机抽取2018年1月—2019年12月就诊于天津医科大学肿瘤医院的46例CRC患者血清样本及同期收治的46例非癌症人群(对照组)血清样本(表1)。所有患者均经病理学检查确诊为CRC,且在取样前未接受任何癌症相关治疗。

表1 46例CRC患者临床病理学特征Tab.1 Clinicopathological features of 46 CRC patients[n (%)]
1.2 实验材料
1.2.1 外周血清标本
所有血清样本抽取均在清晨空腹条件下,收集血清于抗凝管中于4℃保存,并在2h内以1 900×g离心15 min。离心后取上清液于除酶1.5 mL Ependorf试管内并置于-80℃冰箱中保存。所有血清的采集均征得癌症患者和非癌症人群的知情同意,符合人体试验委员会制定的伦理学标准并获得天津医科大学肿瘤医院伦理委员会的认可。
1.2.2 组织标本
收集手术切除的CRC患者的肿瘤组织标本及配对癌旁标本共40对,其中男性24例,女性16例。所有标本的留存均获得患者及其家属的知情同意,符合人体试验委员会制定的伦理学标准并获得天津医科大学肿瘤医院伦理委员会的认可。
1.2.3 细胞系
CRC细胞系SW480、HCT116购自中国科学院分子细胞科学卓越创新中心。CRC组织来源的CAF和正常成纤维细胞(normal fibroblast,NF)从CRC患者的癌组织及癌旁组织中分离得到。
1.2.4 常规试剂和耗材
含有miR-29b结合区的荧光素酶报告质粒p-circ-MIR-29b由金斯瑞生物科技股份有限公司构建,含有circ_0044366过表达或circ_0044366 shRNA序列的慢病毒及质粒购自上海吉凯基因医学科技股份有限公司,miR-29b mimics/inhibitor以及相应对照均由广州锐博生物技术有限公司质控合成,抗MMP2抗体、抗CD63抗体、抗TSG101抗体、抗Alix抗体、抗GAPDH抗体、羊抗兔二抗、羊抗鼠二抗均购自美国Santa Cruz公司,抗α-SMA抗体、抗FAP抗体、抗FSP1抗体均购自英国Abcam公司,TRIzol RNA提取试剂盒购自大连美仑生物技术有限公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)相关引物均由广州锐博生物技术有限公司设计合成,PKH26膜染料试剂盒购自美国Sigma公司。
1.3 方法
1.3.1 细胞培养
SW480和HCT116细胞系均培养于RPMI-1640完全培养基中,CAF和NF细胞系培养于DMEM完全培养基中。细胞置于37℃、CO2体积分数为5%的恒温、恒湿细胞培养箱中进行培养。
1.3.2 外泌体提取
将细胞培养液吸入离心管并按如下梯度离心:4 ℃条件下,1 000×g离心10 min,3 000×g离心30 min,10 000×g离心60 min,100 000×g离心70 min。从沉淀中收集外泌体并重悬于磷酸盐缓冲液(phosphate-buffered saline,PBS)中。提取的外泌体悬液可放置于4 ℃下保存3 d并尽快使用。
1.3.3 蛋白质印迹法(Western blot)
采用放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液提取细胞总蛋白,BCA蛋白定量试剂盒测定实验样本蛋白浓度,定量后30 μg蛋白上样十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE),转膜至硝酸纤维素膜上,用5%脱脂奶粉常温封闭1h,分别与抗MMP2抗体(1∶500)、抗CD63抗体(1∶2 000)、抗TSG101抗体(1∶1 000)、抗Alix抗体(1∶1 000)和抗GAPDH抗体(1∶3 000)在4 ℃下温育过夜。过夜后用洗膜缓冲液(tris buffered saline Tween,TBST)洗膜。室温下温育相应二抗1 h,电化学发光(electrochemical luminescence,ECL)显影曝光并采集实验结果。
1.3.4 细胞转染
将培养皿中细胞消化重悬后以适宜密度接种到6孔板中,细胞充分贴壁且融合度为60%~70%时按照LipofectamineTM2000转染试剂(美国Invitrogen公司)说明书的步骤进行转染,于培养箱内培养6 h后更换完全培养基继续培养。
1.3.5 RNA提取及RTFQ-PCR
按厂家说明书使用TRIzol 试剂(美国Invitrogen 公司)从培养的细胞和组织中提取总R N A,然后将RNA反转录获得cDNA,采用SYBR Green Ⅰ RTFQ-PCR检测各组细胞mi R-29 b和MMP2 mRNA的 表达水平。引物设计如下:MMP2上游引物为5’-AAGGCGTTAGTTCTTCGGGG-3’,下游引物为5’-CACCTTTTGCTCCACAGTGC-3’;circ_0044366上游引物为5’-GCTGG GGTGTGTTAAGCTTT-3’,下游引物为5’-ACCC ACGTGTCCTTAGAGAA-3’;GAPDH上游引物为5’-AGAAGGCTGGGGCTCATTTG-3’,下游引物为5’-AGGGGCCATCCACAGTCTTC-3’。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸35 s为1个循环,共35个循环;最后1个循环72 ℃延伸2 min,每组设3个复孔并重复3次。每组miR-29b和MMP2 mRNA的相对表达水平按公式2-ΔΔCt计算。
1.3.6 双荧光素酶报告基因实验
将细胞接种于24孔板中,细胞贴壁后待转染;将含有miR-29b潜在结合位点的MMP2 3’非翻译区(3’-untranslated region,3’-UTR)的荧光素酶报告质粒及结合位点突变的荧光素酶报告质粒(1 μg/孔),与miR-29b mimics、miR-29b inhibitors(100 pmol/孔)分别进行共转染,另分别各设1个对照组,总计6组;转染4~6 h后换液为完全培养基再培养24 h;培养结束后,用荧光素酶检测试剂盒(美国Promega公司)检测各组荧光素酶表达水平(依照说明书操作);操作中的吸光度(D)值用酶标仪进行测量,以载体荧光素酶报告质粒催化底物产生的荧光活性作为参照,最终分析相对荧光活性。
1.3.7 免疫荧光实验
将细胞悬液加入到24孔板中,待贴壁且密度合适时换用2%胎牛血清(fetal bovine serum,FBS)的条件培养基,并向培养基中添加40 μL外泌体与细胞共培养,48 h后吸弃培养基并用PBS清洗细胞3次,向孔板内加入500 μL 4%多聚甲醛溶液固定细胞15 min,PBS清洗;用10%牛血清白蛋白(bovine serum albumin,BSA)封闭液封闭2 h,取出封闭液,将按1∶250配制的一抗稀释液加入24孔板中,4 ℃摇床温育过夜;PBS洗涤后加入按1∶1 000配制的二抗稀释液,室温摇床温育1 h;PBS洗涤后将用PBS按1∶1 000配制的Hochest稀释液加入24孔板中,室温温育10 min;PBS洗涤后用抗淬灭剂封片于共聚焦显微镜下观察并拍照。
1.3.8 免疫组织化学染色
将石蜡包埋切片脱蜡、水化,PBS洗2次,每次5 min,3%H2O2室温封闭5~10 min,蒸馏水洗3次,每次5 min,然后进行抗原修复,PBS洗5 min,BSA室温封闭20 min。滴加一抗于4 ℃下温育过夜,PBS洗3次,每次2 min;滴加生物素化二抗,20~37 ℃下20 min,PBS洗3次,每次2 min,滴加试剂SABC,20~37 ℃下20 min,PBS洗4次,每次5 min,然后进行DAB显色试剂盒显色;蒸馏水洗3次,每次5 min,然后使用苏木精复染2 min、盐酸乙醇分化;脱水、透明、封片、镜检。
1.3.9 PKH26染色
本研究采用PKH26膜染料试剂盒染色外泌体膜,用于观察与追踪外泌体能够成功进入受体细胞中。将按超速离心法提取的外泌体沉淀用100 μL Diluent C试剂充分重悬(A液);另取100 μL Diluent C试剂,向其中加入0.4 μL PKH26染料,充分混匀(B液);用移液器将A液与B液充分混合,于室温下共同温育15 min后向其中加入200 μL血清,并在室温下共同温育1 min以中止染色;用PBS清洗上述外泌体1次,后加入适量新PBS重悬备用。
1.3.10 裸小鼠荷瘤模型的建立
将BALB/c裸小鼠(6~8周龄)随机分组并标记,将SW480细胞、稳定过表达circ_0044366(circ_0044366-overexpression,circ_0044366-O E)的SW480细胞及敲低circ_0044366(circ_0044366-knockdown,circ_0044366-KD)的SW480细胞充分扩增,分别将上述细胞系的单细胞悬液(每只裸小鼠1×107细胞)以皮下注射的方式接种到裸小鼠中,与未移植瘤裸小鼠共计4组饲养在无病原体的动物设施中,可随意进食。定期观察裸小鼠状态并记录皮下成瘤生长情况。在移植瘤后的第48天处死裸小鼠,并取裸小鼠肝脏,计数肝脏转移瘤个数。
1.4 统计学处理
采用SPSS13.0统计软件进行数据分析,各组实验数据采用表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CRC血清外泌体中circRNA的鉴定
使用超速离心法从CRC患者和非癌症人群中分离出的血清外泌体,在透射电子显微镜下显示为膜性囊泡状结构,中央凹陷,直径约为100 nm(图1A)。接下来检测外泌体的特异性表面蛋白TSG101、Alix和CD63,详见图1B。综上可知,细胞培养液经超速离心法得到的颗粒符合外泌体所报道的重要特征,可确认成功分离外泌体,可进行后续实验。经测序发现1组外泌体circRNA在CRC患者血清外泌体中与非癌症人群血清外泌体中的表达具有高度差异性(图1C),CRC组中95个circRNA显著上调(倍数变化>4),94个circRNA明显下调(变化倍数<0.25),其中CRC组外泌体中的Has_circ_0044366比非癌症人群组高124倍,后续研究主要围绕circ_0044366展开。RTFQ-PCR结果显示,circ_0044366在正常人外泌体中表达较低,而在CRC患者血清外泌体中高表达(P<0.05,图1D)。

图1 CRC血清外泌体中circRNA的鉴定Fig.1 Identification of circRNA in serum exosomes of CRC
2.2 建立转染SW480外泌体的CAF细胞系
肿瘤微环境由多种细胞类型组成,其中CAF占间质细胞的比例最大。分离肿瘤组织中的CAF和癌旁组织中的NF,免疫荧光实验显示,CAF组α-SMA、FAP和FSP1各项指标均明显高于NF组(图2A)。将SW480细胞外泌体与CAF细胞共温育,并采用PKH26对外泌体进行染色标记并进行追踪,PKH26标记的SW480细胞外泌体成功进入受体细胞CAF中(图2B),并且在透射电子显微下观察到SW480细胞外泌体(SW480 exosomes,480 exos)(图2C)。接下来检测CAF、SW480和HCT116细胞系的外泌体中circ_0044366的表达水平。RTFQ-PCR结果显示,480 exos和HCT116来源外泌体(HCT116 exosomes,116 exos)中circ_0044366高表达,而在CAF来源外泌体组(CAF exosomes,CAF exos)中circ_0044366显著低表达(P<0.05,图2D)。选取circ_0044366表达最高的SW480细胞系,分别用0.9%NaCl溶液(saline)、480 exos、circ_0044366敲低的SW480细胞外泌体(circ_0044366-deleteSW480 exosomes,480 exos circ_0044366 del)与CAF共培养后进行RTFQ-PCR,结果显示,saline组及480 exos circ_0044366 del组中circ_0044366含量均较低,而480 exos组circ_0044366含量明显升高(P<0.05,图2E)。

图2 建立转染SW480外泌体的CAF细胞系Fig.2 Establishment of CAF cell line transfected with 480 exos
2.3 circ_0044366与miR-29b直接相互作用
通过生信分析确定了circ_0044366与miR-29b之间存在的两个靶点(图3A)。经TargetScan数据库(http://www.targetscan.org/)、DAⅤID数据库(https://david.ncifcrf.gov/)交叉验证miR-29b具有调控MMP2表达的潜在作用,预测了在MMP2 mRNA中miR-29b的3’-UTR结合区(图3B)。免疫组织化学分析表明,在CRC组织中MMP2高表达,而在癌旁组织中低表达(P<0.05,图3C)。接下来进一步鉴定CRC细胞外泌体circ_0044366与MMP2蛋白之间的临床相关性:用RTFQ-PCR测定外泌体中的circ_0044366表达水平,用Western blot和灰度分析相结合的方法对MMP2蛋白进行定量,结果显示,在CRC血清外泌体中circ_0044366的表达水平与MMP2蛋白的表达水平呈正相关(P<0.05,图3D)。用同样的方法测定MMP2 mRNA的表达水平和MMP2的表达水平,两者无显著相关性(P>0.05,图3E),因此推测circ_0044366通过转录后途径调控MMP2的表达。

图3 circ_0044366与miR-29b的直接相互作用Fig.3 Direct interaction of circ_0044366 with miR-29b
2.4 circ_0044366和MMP2可靶向结合miR-29b
双荧光素酶报告基因实验结果表明,过表达miR-29b可以显著抑制circ_0044366和MMP2 mRNA 3’-UTR野生型质粒的荧光强度(P<0.05),而对circ_0044366和MMP2 mRNA 3’-UTR突变型质粒的荧光强度无明显抑制作用(P>0.05,图4A、B)。抑制miR-29b可以显著促进circ_0044366和MMP2 mRNA 3’-UTR野生型质粒的荧光强度(P<0.05),但对circ_0044366和MMP2 3’-UTR突变型质粒的荧光强度无明显促进作用(P>0.05),证明circ_0044366靶向结合miR-29b,而miR-29b对MMP2 mRNA的3’-UTR区进行转录后调控。Western blot结果显示,与480 exos共培养的CAF细胞中MMP2蛋白的表达水平升高,而与480 exos circ_0044366 del共培养的CAF中MMP2的表达水平降低(图4C),证明480 exos介导的circ_0044366可以增强CAF中MMP2蛋白的表达水平。向CAF细胞中转染miR-29b mimics抑制了MMP2蛋白的表达,而转染miR-29b inhibitors则促进了MMP2的表达(图4D、F),但对MMP2的mRNA水平无明显影响(P>0.05,图4E),证明miR-29b可以通过转录后途径抑制MMP2蛋白的表达水平。接下来在CAF细胞中进行了细胞功能回复实验,结果显示,circ_0044366-OE组MMP2蛋白的表达水平显著升高且可被miR-29b mimics逆转,circ_0044366-KD组MMP2蛋白的表达水平显著降低且可被miR-29b inhibitors逆转(图4H),但对MMP2的mRNA水平无明显影响(P>0.05,图4G)。

图4 circ_0044366靶向调控miR-29b,miR-29b靶向调控下游的MMP2Fig.4 circ_0044366 regulated miR-29b,which targeted downstream MMP2
2.5 体内实验验证circ_0044366促进肿瘤生长
为进一步评估circ_0044366对体内肿瘤生长的影响,本研究建立了裸小鼠移植瘤模型,共计4组(图5A),培养期间每隔8 d测量各组裸小鼠荷瘤的直径(图5B)。此外,分别提取4组裸小鼠的血清外泌体(图5C),RTFQ-PCR结果显示,circ_0044366-KD组中血清外泌体circ_0044366含量降低,而在circ_0044366-OE组中显著增多(图5D)。同时,circ_0044366-KD组瘤体中circ_0044366含量及MMP2蛋白的表达水平降低,而circ_0044366-OE组瘤体中circ_0044366含量及MMP2蛋白的表达水平显著升高(图5E、G),两组中MMP2的mRNA水平无明显差异(图5F)。
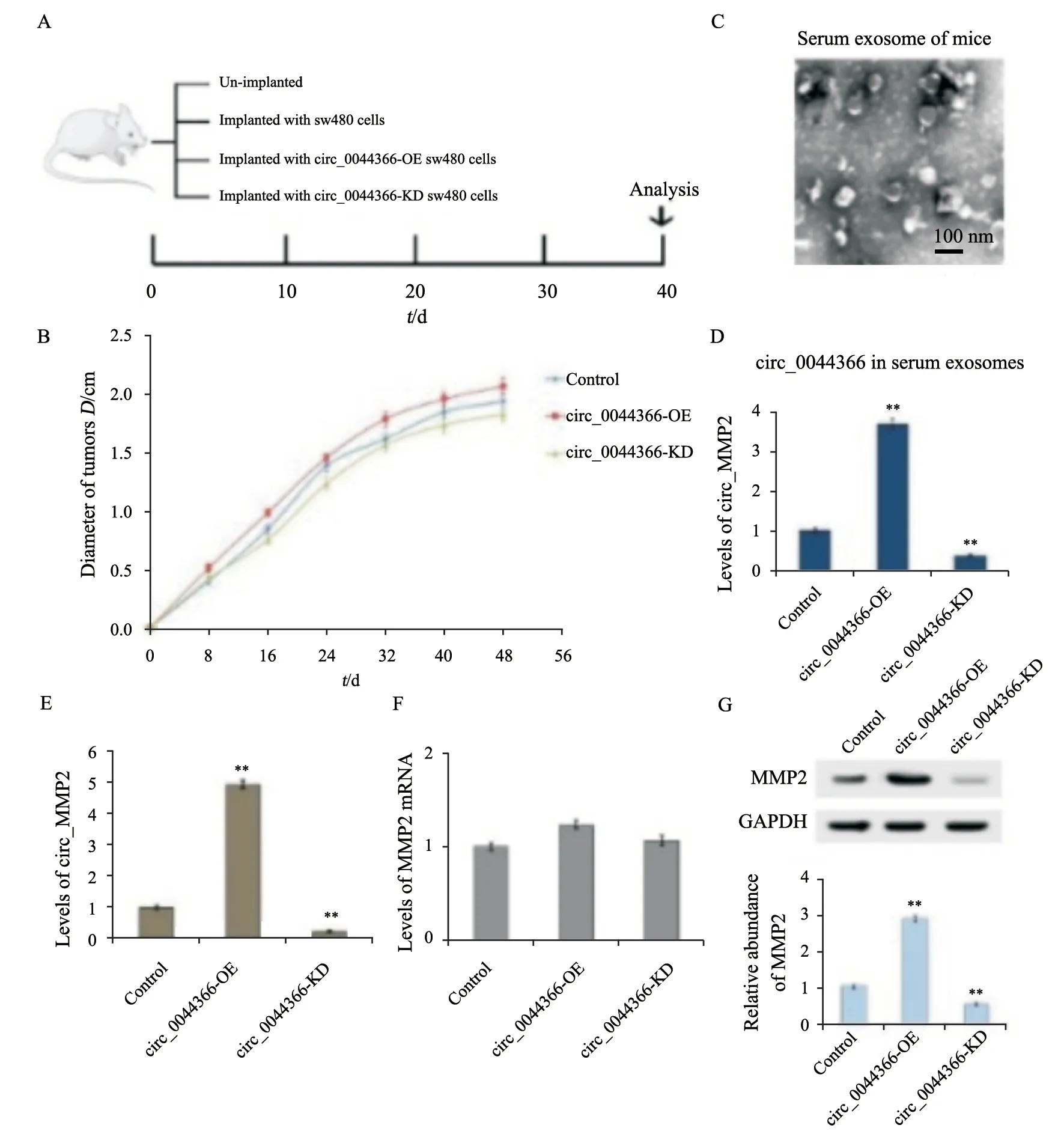
图5 体内实验证实circ_0044366与miR-29b及MMP2的相互作用Fig.5 In vivo experiments confirmed the interaction of circ_0044366 with miR-29b and MMP2
2.6 体内转移模型验证下调circ_0044366抑制肿瘤的侵袭和转移
同时,本研究对裸小鼠移植瘤模型进行手术取出完整的肝组织,分别计数肝内转移瘤的个数。其中,circ_0044366-OE组裸小鼠全部出现肝脏转移(6/6),平均转移瘤为5.5个,数量显著多于对照组,而circ_0044366-KD组中出现肝脏转移的裸小鼠模型仅占本组总数的33.3%(2/6),平均转移瘤为1.5个,显著少于对照组,证明敲低circ_0044366能够显著减少CRC肝转移的发生(图6)。

图6 体内转移模型验证circ_0044366对肿瘤侵袭和转移的作用Fig.6 In vivo metastasis model verifies the effect of circ_0044366 on tumor invasion and metastasis
综上,本研究通过一系列实验,从体内外均证明了CRC细胞中circ_0044366能够通过外泌体转运至CAF细胞中,通过吸附miR-29b上调MMP2的表达水平,进而促进CRC细胞的侵袭和转移。该跨细胞信号通路包括circ_0044366、miR-29b及MMP2及其相互之间的联系,在调节CRC细胞的侵袭和转移中的发挥重要作用(图7)。

图7 circ_0044366调控CAFMMP2释放并促进CRC进展的机制模型Fig.7 Mechanism model of circ_0044366 regulating MMP2 release from fibroblasts and promoting CRC progression A proposed model illustrating the role of CAF-derived exosomal circ_0044366 in regulating ferroptosis in CAF and promoting CRC invasion and metestasis
3 讨论
circRNA是一种非编码RNA,其对核酸外切酶介导的降解具有抗性,是稳定的环状结构,并且在各种细胞类型中普遍表达[18]。这些circRNA通常用作竞争性内源RNA来影响下游miRNA的功能[19]。研究[20]表明,circRNA在外泌体中富集和稳定,可以在循环血液和尿液中检测到。外泌体可以被包括巨噬细胞在内的许多类型的细胞所接受,还可以充当细胞间的信使,细胞可以通过外泌体来转移circRNA。
随着微阵列和RNA测序技术的显着进步,已发现越来越多的circRNA在众多疾病过程中起着至关重要的作用,尤其是在包括CRC在内的癌症。有研究[21]证明,circIFT80促进上皮-间质转化(epithelial-mesenchymal transition,EMT),在circIFT80过表达的情况下,CRC细胞的侵袭和迁移显着增加,与E-钙黏着蛋白表达下降以及波形蛋白和N-钙黏着蛋白表达增加有关。一项针对食管鳞状细胞癌的研究[13]表明,cir-ITCH对miRNA具有吸附作用,提高cir-ITCH水平会促进肿瘤的进展。也有越来越多的证据表明,外泌体circRNA在CRC的肿瘤生长[9-10]、免疫逃逸[27]、血管生成[22]、转移[23]和耐药性形成[24]中发挥关键作用。从血液样本中收集的外泌体已显示出在疾病早期的诊断潜力,TNM阶段特异性的预后潜力以及对CRC中常见的化疗药物和联合用药即5-FU和FOLFOX的预测潜力,且已经证明外泌体circRNA比单独的癌胚抗原和糖类抗原19-9具有更高的敏感性和特异性[25]。
本研究探索了circ_0044366在CRC侵袭和转移中的作用,并证明在CRC患者血清外泌体中circ_0044366的含量显著高于正常血清外泌体。通过荧光素酶报告基因试验证实,circ_0044366靶向结合miR-29b,且miR-29b与MMP2蛋白的表达水平明显相关。本研究首先发现外泌体介导的circ_0044366能够促进CRC细胞的迁移,通过外泌体进行跨细胞通讯,显著促进CRC细胞的侵袭和转移。
MMP2存在于细胞外基质中,是一种具有Ⅳ型胶原降解特性的蛋白质,其催化位点中含有3个纤维连接蛋白Ⅱ型重复序列,使变性Ⅳ型胶原和Ⅴ型胶原与弹性蛋白结合。研究[26-29]表明,MMP2的表达与CRC、肺癌、甲状腺乳头状癌、成神经细胞瘤、膀胱癌等多种癌症进展相关。
综上,本研究表明,敲低CRC细胞中的circ_0044366有望通过调控miR-29b/MMP2轴来抑制CRC的侵袭和转移,为探寻诊治CRC转移的生物标志物提供了有意义的实验依据,也为治疗转移性CRC提供了新的跨细胞通讯调控思路,开启了新的研究角度,其在转移性CRC的生物标志物诊断、预后判断以及从抑制转移的角度延长患者生存期和提高患者生存质量方面均具有重要意义。

