KLK8通过调节EGF对结直肠癌细胞凋亡的影响及其机制
花 晴,申雪芳,许平波
复旦大学附属肿瘤医院麻醉科,复旦大学上海医学院肿瘤学系,上海200032
结直肠癌是全球常见的恶性肿瘤之一。近年来,由于化疗、免疫治疗和靶向治疗的飞速发展,结直肠癌患者的总生存率显著提升。但由于其高发病率,结直肠癌仍是死亡率较高的恶性肿瘤之一[1-2]。人组织激肽释放酶相关肽酶家族(kallikrein-related peptidases,KLKs)由KLK1~KLK15组成,是一组具有胰蛋白酶和糜蛋白酶样活性的丝氨酸蛋白酶[3-4]。KLKs具有多种生物学功能,在血液凝固、补体激活、胚胎发育和伤口愈合等方面具有重要作用[5-7]。作为KLKs家族的重要成员,KLK8是一种突触相关的丝氨酸蛋白酶,可参与多种生物活动如表皮增殖分化、角质形成等[8]。近年来,越来越多的研究[6,9]表明,KLK8与肿瘤的发生、发展密切相关,其在卵巢癌[10]、宫颈癌[11]和肺癌[12]等多种肿瘤中均异常表达。与此同时,越来越多的证据[13-14]证明,KLK8可作为肿瘤生存和预后的生物学标志物。然而,KLK8对结直肠癌细胞凋亡的影响尚未可知。为进一步探索KLK8促进结直肠癌细胞凋亡的机制,本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,通过基因集富集分析法(gene set enrichment analysis,GSEA),对KLK8高表达和低表达的结直肠癌组织进行基因表达分析。结果发现,KLK8高表达与细胞外基质(extracellular matrix,ECM)的分解、表皮发育密切相关。表皮生长因子(epidermal growth factor,EGF)由53个氨基酸残基组成,编码基因位于人类染色体4(4q25-27)上,可在多种正常细胞、人类癌组织中表达。有研究[15-17]表明,EGF可以抑制肿瘤细胞的凋亡。作为一种丝氨酸蛋白酶,KLKs具有水解多种蛋白底物的能力,有研究[18]表明,KLK8可通过剪切激活EGF,促进心肌肥厚。那么,KLK8是否可通过EGF途径对结直肠癌细胞的凋亡产生影响?本研究将探讨KLK8对结直肠癌细胞凋亡的调节作用及其机制,为进一步探索KLK8对结直肠癌的影响及其潜在机制奠定基础。
1 材料和方法
1.1 细胞培养与实验试剂
人胚肾上皮细胞HEK-293T、人结直肠癌细胞RKO和SW480均购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,所有细胞均培养在DMEM培养基(美国Invitrogen公司)中,所有培养基均添加10%胎牛血清(美国Gibco公司)和1%青霉素/链霉素(美国Invitrogen公司)。表皮生长因子受体(epidermal growth factor receptor,EGFR)siRNA套装购自百奥生物技术(南通)有限公司,Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自生工生物工程(上海)股份有限公司,KLK8质粒购自上海吉凯基因化学技术有限公司,嘌呤霉素购自美国Roche公司,ELISA试剂盒购自上海西唐生物科技有限公司,兔抗人KLK8多克隆抗体(货号:ab150395)购自英国Abcam公司,鼠抗人β-actin单克隆抗体(货号:sc-47778)购自美国Santa Cruz公司,山羊抗兔IgG二抗(货号:7076Ⅴ)和山羊抗小鼠IgG二抗(货号:7074Ⅴ)均购自美国Cell Signaling公司。
1.2 肿瘤基因组图谱分析与GSEA
GEO芯片数据集GSE21815、GSE37182和GSE71187从GEO官网(https://www.ncbi.nlm.nih.gov/geo/)下载,用于比较结直肠正常组织和癌旁组织间的差异。TCGA结肠癌(COAD)由275例结直肠癌和349名健康志愿者组成,从USUC Xena网站(https://xenabrowser.net/datapages/?dataset=TCGA)下载。为阐明KLK8在结直肠癌中的作用机制,在Broad Institute平台上进行GSEA,并将统计学显著性设为0.25。利用“GO”基因集的方法,对KLK8高表达和低表达的结直肠癌数据进行基因表达差异分析,寻找KLK8的相关信号通路。
1.3 方法
1.3.1 质粒慢病毒包装
将HEK-293T以1×107个/10 cm培养皿的密度铺板。次日进行质粒转染。按照目的质粒(pcDNA3.1-KLK8质粒,上海吉凯基因化学技术有限公司)∶包装质粒psPAX2∶包装质粒pMd.2.G为2.0∶1.5∶0.5的比例,将3种质粒混合在500 μL无血清的Opti-MEM培养基中。按照LipofectamineTM3000产品说明书进行质粒转染。48 h后收集上清液。收集的病毒液经过滤器过滤后于-80 ℃储存。将RKO和SW480细胞以1×105细胞/孔的密度放置在6孔板中,培养过夜。细胞贴壁后,在细胞培养基中加入上述得到的病毒液。感染24 h后去除病毒液,加入新鲜细胞培养基。将2 μg/mL嘌呤霉素加入细胞培养基中,4周后产生稳定的KLK8过表达细胞系。收集耐药细胞进行后续分析。
1.3.2 siRNA转染细胞
配制转染反应体系:siRNA与转染试剂的比例为1 μg∶1 μL,分别用125 μL Opti-MEM温育于Ependorf试管中,室温温育5 min,然后混合。将RKO和SW480细胞以1×105个细胞/孔的密度铺板在6孔板中,培养过夜。待细胞贴壁后,加入上述转染体系,感染24 h后换液,加入新鲜细胞培养基。收集细胞进行后续分析。
1.3.3 蛋白质印迹法(Western blot)检测
按照十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶的配方制备合适浓度的SDS-PAGE凝胶胶板。将制备好的SDSPAGE胶板安装好。加入电泳缓冲液后,加入50 μg蛋白样品到凝胶内的上样孔中,80 Ⅴ电压电泳,电泳完毕后开始转膜,用甲醇激活聚偏二氟乙烯(polyvinylidene fluoride,PⅤDF)膜,100 Ⅴ转膜90 min。转膜完成后,采用5%胎牛血清室温封闭1 h。加入一抗KLK8(1∶1 000稀释)、β-actin(1∶5 000稀释),4 ℃摇床上温育过夜。第2天用1×磷酸盐吐温缓冲液(phosphate buffered saline with Tween,PBST)洗膜5次,每次7 min,加入对应一抗种属来源的HRP标记的二抗(山羊抗兔IgG二抗和山羊抗小鼠IgG二抗均为1∶5 000稀释),在室温摇床上温育1 h,用1×PBST洗膜5次,每次7 min。然后曝光成像。
1.3.4 Annexin Ⅴ-FITC/PI双染法流式细胞术检测细胞凋亡
计数铺RKO和SW480细胞,按照AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒(货号:E606336)说明书处理细胞,处理好的细胞采用流式细胞术检测细胞凋亡。
1.3.5 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测EGF表达
收集RKO和SW480的细胞培养上清液,2 000~3 000 r/min离心20 min。仔细收集上清液。应用ELISA法检测细胞上清液中EGF的表达水平,严格按照ELISA试剂盒说明书进行操作。每孔各加入标准品或待测样品100 μL,将反应板充分混匀后置于37 ℃ 40 min。接着用洗涤液将反应板充分洗涤4~6次,向滤纸上印干。向每孔加入蒸馏水和第一抗体工作液各50 μL(空白除外)。将反应板充分混匀后置于37 ℃ 20 min。然后用洗涤液将反应板充分洗涤4~6次,向滤纸上印干。每孔加酶标抗体工作液100 μL。将反应板置于37℃10 min。接着用洗涤液将反应板充分洗涤4~6次,向滤纸上印干。每孔加入底物工作液100 μL,置37 ℃暗处反应15 min。每孔加入100 μL终止液混匀。30 min内用酶标仪(型号:DENLEY DRAGON Wellscan MK 3)在450 nm处测吸光度(D)值。
1.4 统计学处理
实验中所有统计分析均使用SPSS 13.0软件进行。实验中所有的数据均以表示,两个样本间比较均使用t检验,多样本间用单因素方差分析检验。P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌中KLK8的表达情况
KLK8的表达与多种肿瘤的发生、发展密切相关[10,12]。本研究采用GEO芯片数据集GSE21815、GSE37182和GSE71187分析发现,与正常组织相比,结直肠癌组织中KLK8的表达显著上调(图1)。
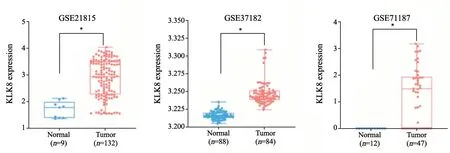
图1 KLK8在结直肠癌中表达升高Fig.1 KLK8 is highly expressed in colorectal cancer
2.2 KLK8对结直肠癌细胞凋亡的影响
细胞凋亡异常是人类恶性肿瘤的特征[19]。本研究通过构建KLK8过表达的RKO和SW480细胞系稳定转染细胞株和敲低细胞株来判断KLK8表达升高或降低是否会影响结直肠癌细胞的凋亡,Western blot检测证实已成功构建了KLK8过表达的RKO和SW480细胞系稳定转染细胞株和敲低细胞株(图2A)。采用AnnexinⅤ-FITC/PI双染法流式细胞术来检测KLK8对结直肠癌细胞凋亡的影响,与对照组相比,KLK8过表达显著抑制结直肠癌细胞的凋亡(图2B、C)。

图2 KLK8过表达抑制结直肠癌细胞的凋亡Fig.2 KLK8 overexpression inhibited apoptosis of colorectal cancer cells
2.3 GESA分析KLK8表达抑制结直肠癌细胞凋亡的机制
为深入了解KLK8抑制结直肠癌细胞凋亡的机制,本研究利用TCGA数据库,采用GSEA对KLK8高表达和KLK8低表达结直肠癌组织中的基因表达进行了分析。结果显示,根据KLK8表达水平的不同,142条富集途径的表达存在差异,本研究选取差异最明显的前20条通路(图3A,P<0.05)。KLK8与ECM的分解、表皮发育通路正相关,这两种通路与细胞凋亡密切相关(图3B)。

图3 结直肠癌中KLK8高低表达显著富集的通路Fig.3 Significantly-altered pathways were predicted in colorectal cancer depending on KLK8 expression
2.4 KLK8抑制结直肠癌细胞凋亡的机制
作为一种丝氨酸蛋白酶,KLK8能切割并激活多种膜蛋白的细胞外部分,如EGF。EGF与表皮发育、ECM的降解密切相关[16-17]。在过表达KLK8的RKO和SW480细胞上清液中,EGF的表达明显升高(图4A),表明KLK8可以剪切EGF。接下来,本研究探讨了EGF的表达升高是否有助于KLK8在结直肠细胞中的抗凋亡功能。在过表达KLK8的RKO和SW480细胞中利用siRNA敲低EGFR(图4B),细胞凋亡明显增多(图4C、D),表明抑制EGFR可以逆转KLK8的抗凋亡作用。

图4 KLK8通过激活EGF抑制结直肠癌细胞的凋亡Fig.4 KLK8 inhibited colorectal cancer cell apoptosis via the activation of the EGF
3 讨论
结直肠癌是全球常见的消化道恶性肿瘤之一,其发病率和死亡率居高不下。发病率居恶性肿瘤第3位,死亡率居第2位[20-21]。因此,迫切需要研究结直肠癌的发病机制和分子生物学标志物,以促进结直肠癌的早期诊断、预后预测和制定有效的治疗策略。
KLK8参与肿瘤发展的多个阶段,如肿瘤的增殖、迁移和血管生成,与肿瘤的恶性行为密切相关[4,9,12]。有研究[22]表明,KLK8可促进结直肠癌细胞的增殖和转移,但KLK8对结直肠癌细胞凋亡的影响及其机制尚未可知。本研究通过GEO数据库分析发现,KLK8在结直肠肿瘤中表达升高。在结直肠癌细胞中过表达KLK8可抑制结直肠癌细胞的凋亡,而敲低KLK8可促进结直肠癌的凋亡。
KLKs具有水解多种底物的能力,如促表皮生长因子(pro-epidermal growth factor,pro-EGF)、蛋白酶激活受体(protease-activated receptor,PAR)和神经调节蛋白-1等[18]。本研究通过GSEA分析发现,KLK8高表达与表皮发育及ECM的分解密切相关。作为表皮发育的重要调节因子,EGF是一种含有53个氨基酸残基的多肽,可与EGFR结合,启动细胞内信号通路的级联反应。因此,EGF可参与多种生理学和病理学过程,包括细胞增殖、凋亡、迁移、存活和血管生成等[16-17]。本研究显示,过表达KLK8的结直肠癌细胞上清液中,EGF的表达量增多,表明KLK8可剪切结直肠癌细胞表面的pro-EGF,释放EGF。为进一步研究其对结直肠癌细胞凋亡的影响,本研究利用siRNA敲低EGF的细胞表面受体EGFR,采用AnnexinⅤ-FITC/PI双染法流式细胞术检测结直肠癌细胞的凋亡情况。结果发现,敲低EGFR后,结直肠癌细胞的凋亡增加,表明抑制EGFR可逆转KLK8抑制的结直肠细胞的凋亡,因此推测KLK8可通过剪切释放EGF,抑制结直肠癌细胞的凋亡。
本研究显示,KLK8在结直肠癌中表达升高。过表达KLK8可抑制结直肠癌细胞的凋亡,敲低KLK8可促进细胞的凋亡。KLK8可剪切释放EGF,敲低EGFR表达,阻断EGF调控信号通路可逆转KLK8对结直肠癌细胞凋亡的抑制作用。本研究阐明了KLK8对结直肠癌细胞凋亡的影响及其潜在机制,为结直肠癌的分子靶向治疗提供了新线索。

