90Y微球选择性内放射治疗在肝细胞癌中的应用及研究进展
牛 娜 ,林岩松
中国医学科学院北京协和医学院北京协和医院核医学科,北京 100730
2018年,中国肝癌新发392 868例,占全球新发病例的46.7%,中国肝癌死亡368 960例,占全球死亡病例的47.1%。中国肝癌粗发病率(27.6/10万)是全球肝癌粗发病率(11.0/10万)的2.51倍,中国肝癌粗死亡率(25.9/10万)是全球肝癌粗死亡率(10.2/10万)的2.54倍[1]。2012—2015年,中国肝癌5年生存率仅为12.1%[2]。这些数据提示肝癌的预防及生存改善是中国肝癌领域关注的重点。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌最主要的病理学类型,占85~90%。HCC起病隐匿,约85%的患者在确诊时已是中晚期,由于失去了手术切除的时机,只能通过局部微创治疗或系统治疗等手段控制疾病进展、延长生存期(图1)。

图1 指南推荐的不可手术HCC的治疗方式Fig.1 The treatment modalities of inoperable HCC recommended by guidelines
放射治疗是恶性肿瘤的常规治疗手段,分为外照射和内照射治疗两种途径。内照射治疗是利用肿瘤组织与放射性核素及其标记药物的特异性亲和力,或将放射性核素通过血管、淋巴管及腔内等介入手段引入体内肿瘤组织,达到治疗或控制肿瘤的目的。内照射治疗能突破外照射治疗的局限,以更高的辐射剂量、更加靶向地对肿瘤组织进行治疗,同时降低对正常组织的损伤。以肝肿瘤为例,对肝肿瘤起到致死性杀伤作用的辐射吸收剂量至少需要120 Gy,但正常肝组织对射线敏感,接受超过30 Gy的剂量即可能引起放射性肝炎,因此外照射治疗全肝引起肝功能下降的剂量阈值为30 Gy[3]。而在Leung等[4]的早期研究中,通过对HCC患者经肝动脉注射高锝-99标记的大颗粒聚合白蛋白后显像研究发现,对HCC患者通过肝动脉注入核素后,肿瘤与正常组织的靶本中位比值为3.7,意味着如果正常组织接受剂量为30~33 Gy,肝部肿瘤组织接受的剂量为110~120 Gy,远远超过外放射治疗对肿瘤组织施予的剂量,这为通过肝动脉介入的钇-90(yttrium-90,90Y)微球选择性内放射治疗(selective internal radiation therapy,SIRT)提供了理论依据。
90Y微球SIRT是将载有发射β射线的放射性核素90Y微球经肝动脉注入肿瘤组织,放射性微球因无法通过肿瘤的毛细血管床而聚集在肿瘤组织中,肿瘤局部区域所接受的电离辐射剂量高达100~150 Gy,使肿瘤细胞内脱氧核糖核酸受损而产生强大的杀瘤效应,因90Y在肝组织中的射程仅2.50 mm,故对正常肝组织的损伤非常小而达到靶向杀瘤效应。90Y微球SIRT的研究起步于20世纪50年代。1965年,Ariel[5]首次报道90Y标记的陶瓷微球治疗原发性肝癌患者,初步提示其可缩小肿瘤、缓解症状且耐受性良好。1993年,Yan等[6]在国内首次报道90Y标记的玻璃微球治疗原发性肝癌的基础及临床研究结果。同期,刘允怡团队[7-9]在中国香港开展了数项90Y树脂微球SIRT(90Y resin microsphere SIRT,R-SIRT)在HCC中的前期临床试验,验证了其有效性和安全性。基于上述研究证据,许多国家和地区陆续批准了90Y树脂微球用于肝脏恶性肿瘤的SIRT。美国食品药品管理局(Food and Drug Administration,FDA)于1999年以“人道主义器械豁免(humanitarian device exemption,HDE)”政策批准了英国公司研制的90Y玻璃微球用于HCC的SIRT。2001年,Gray等[10]发表的Ⅲ期临床试验结果表明,在结直肠癌肝转移(colorectal liver metastases,CRLM)患者中氟尿苷肝动脉输注化疗(hepatic artery infusion chemotherapy,HAIC)联合90Y树脂微球,可显著地提高治疗应答率并延长患者的无进展生存期(progression-free survival,PFS)。基于该研究结果,美国FDA于2002年以上市前审批(premarket approval,PMA)的方式正式批准了90Y树脂微球用于CRLM的SIRT。目前在中国大陆,90Y树脂微球正处于进口申报阶段,有望于2021年在中国大陆获批上市。
1 90Y微球的种类及物理性质
90Y满足了作为治疗用放射性核素应具备的特性(表1),包括:①发射纯β射线,能量高(最高能量2.27 MeⅤ,平均0.94 MeⅤ),射程短,半衰期短;② 稳定性好,无危害性的衰变后产物;③生物相容性好,能与载体稳定结合;④ 选择性聚集,在有效半衰期内保留在肿瘤组织中,肿瘤区与非肿瘤区放射剂量比值高[11]。相比于其他核素,90Y发射纯β射线,在体内穿透距离短,防护简便,因此90Y微球治疗在美国作为门诊手术,治疗当天即可出院[12-14]。同时,90Y发射的β射线能量高,杀瘤细胞作用强,能量在2周内释放达95%,有效放射持续7个半衰期,即18 d左右。而HCC的倍增时间为41 d,故90Y可在肝癌细胞倍增之前达到最大的能量释放及肿瘤治疗效应。
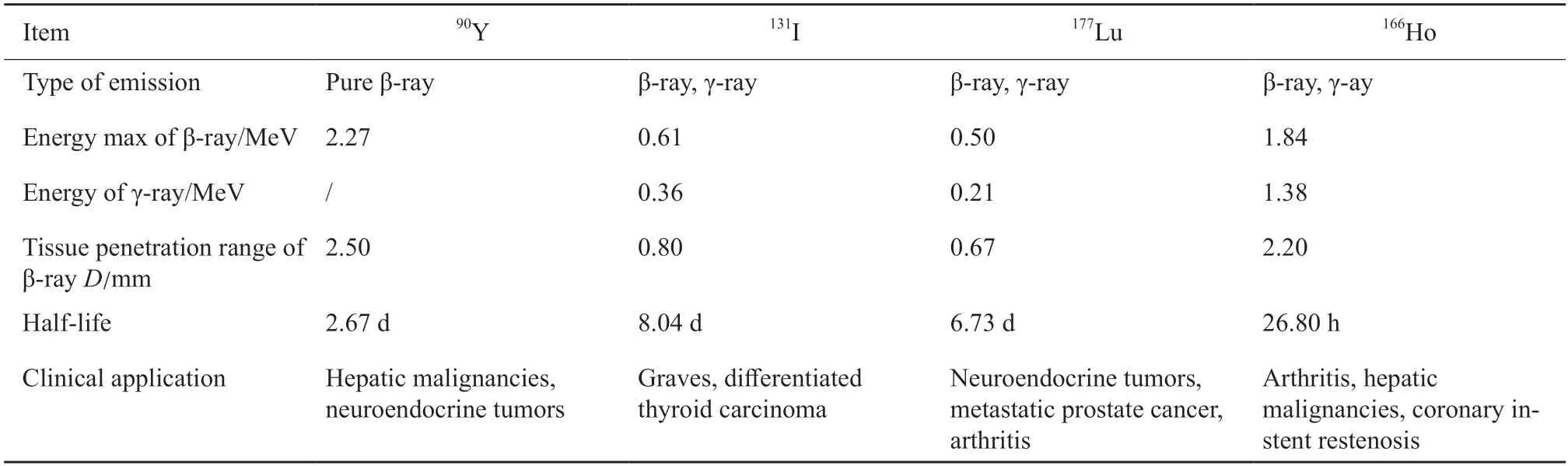
表1 90Y与其他常见放射性治疗核素物理特性的比较Tab.1 Comparison of physical characteristics between 90Y and other common radionuclides for radiotherapy
目前全球商业化供应的90Y微球包括90Y树脂微球和90Y玻璃微球,这两种微球的物理特性及其效应有所不同(表2)[11,13]。首先,树脂微球比重较小,能更好地在血液中悬浮,到达肿瘤血管末端,从而更有选择性地针对肿瘤进行放射性治疗;玻璃微球比重较大,容易沉积在血管壁而无法对肿瘤部位进行更细致的选择。其次,树脂微球的单位放射性活度较低,每次治疗所需的微球数更多,能更全面、均匀地覆盖肿瘤,同时对肿瘤血管有一定的栓塞作用;而玻璃微球治疗的栓塞效应较低。第三,树脂微球的注入速度较慢,在注入过程中可进行数字减影血管造影(digital subtraction angiography,DSA),确认导管位置;玻璃微球的注射速度快,虽然可减少手术时间,但术中无法进行DSA辅助定位。
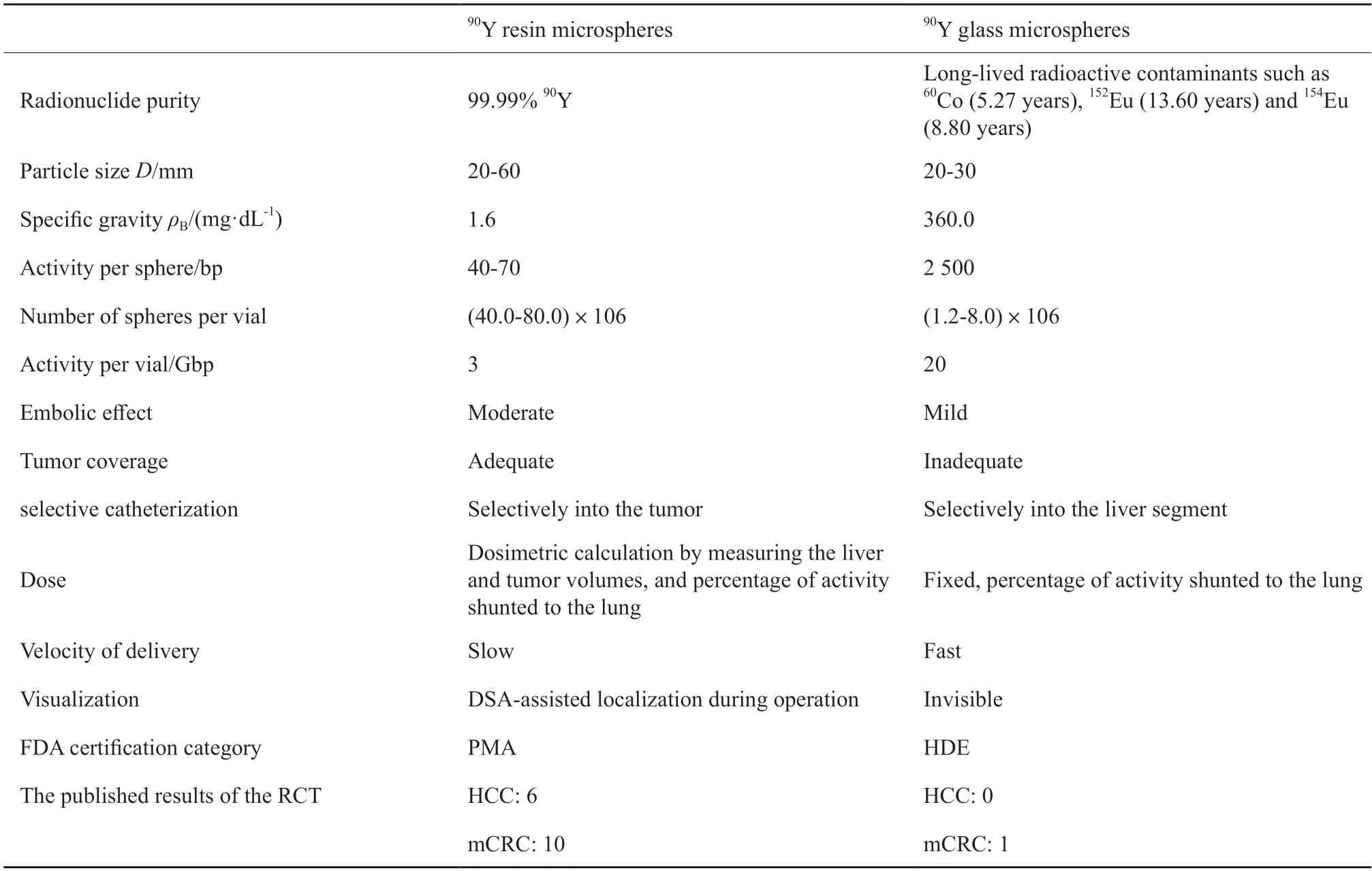
表2 90Y微球的种类及特性Tab.2 Types and characteristics of 90Y microspheres
2 SIRT在HCC中的研究进展
2.1 SIRT用于HCC的姑息治疗
2.1.1 SIRT单独治疗
R-SIRT在不同分期HCC患者的治疗中均有应用。2011年,Sangro等[15]在一项真实世界研究(n=325)中,评估不适合手术切除、经动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)或系统治疗的HCC患者经R-SIRT的生存情况及安全性,结果显示,巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer,BCLC)为A、B、C期的患者,中位总生存期(overall survival,OS)分别达到24.4、16.9、10.0个月,安全性良好,仅6.1%的患者出现3级以上不良反应。该研究提示R-SIRT可为各期HCC患者(尤其对于晚期、无治疗选择的患者)提供一定的生存获益。基于该研究结果,90Y微球SIRT于2012年首次被纳入欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)HCC指南推荐,用于前期TACE治疗失败、肝功能良好、大血管侵犯但无肝外转移的HCC患者(ⅢC期)。
TACE是中期HCC患者的首选治疗方式。Kolligs等[16]在一项前瞻性、随机对照研究中比较了R-SIRT与TACE的疗效和安全性,R-SIRT组患者平均接受1次治疗,TACE组患者平均接受3.4次治疗,结果显示,相较于TACE组,R-SIRT组的客观缓解率(objective response rate,ORR)更高,治疗相关不良反应更少,两组患者的生活质量均无显著改变。
晚期HCC患者的首选治疗为索拉非尼。Ⅴilgrain等[17]和Chow等[18]分别于2017和2018年发表了两项Ⅲ期随机对照研究(SARAH:法国,n=459;SIRveNIB:亚太地区,n=360)的结果,比较了R-SIRT和索拉非尼治疗中晚期HCC患者的有效性和安全性,两项研究结果均显示,R-SIRT组患者的中位OS与索拉非尼组无显著差异;R-SIRT组的ORR显著更高(SARAH:19.0%vs12.0%,P=0.04;SIRveNIB:16.5%vs1.7%,P<0.001),3级以上不良反应显著更少,生活质量更高。提示SIRT针对晚期HCC在缓解疾病的同时有助于改善患者的生活质量,基于上述研究,2018年ESMO肝癌指南推荐SIRT用于病灶局限于肝脏、肝功能良好的HCC患者。
部分HCC患者伴有门静脉血栓(portal vein thrombosis,PⅤT),此类患者易伴有门静脉高压。由于TACE具有栓塞作用,其治疗PⅤT患者易引起急性肝衰竭或门静脉胃底静脉曲张出血。90Y微球由于栓塞效应较小,用于HCC伴PⅤT患者相对安全。Kulik等[19]在一项Ⅱ期研究中分析了90Y玻璃微球SIRT(90Y glass microsphere SIRT,G-SIRT)在不可切除HCC伴或不伴PⅤT患者中的安全性和有效性(n=108),结果显示,ORR为42.2%,无PⅤT、伴分支PⅤT和伴主干PⅤT的患者中位OS分别为467.0、304.0和133.5 d;所有患者未出现放射性胃炎或肺炎。基于该研究,SIRT于2011年首次纳入美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)肝胆管癌指南,推荐用于不可手术HCC患者的局部治疗。
2.1.2 SIRT联合系统治疗
90Y微球SIRT可诱导HCC肿瘤微环境中的免疫激活,其与免疫治疗可能存在协同作用,能增强免疫治疗效果[20]。Zhan等[21]回顾性分析R-SIRT联合免疫检查点抑制剂(immune checkpoint inhibitor,ICI)治疗HCC的安全性(n=26),发现在随访初期30 d内无患者死亡,无3/4级及肝胆或免疫治疗相关不良反应,2例患者在治疗后1~3个月出现肝胆相关不良反应。在2020年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上公布的一项Ⅱ期研究(n=40)中,R-SIRT联合纳武单抗治疗亚洲晚期HCC患者,ORR为30.5%,相较于既往研究中纳武单抗单药治疗有明显提高。目前,联合ICI的其他临床试验(如NCT03380130)正在开展中。
此外,90Y微球SIRT还可联合索拉非尼治疗,延长部分HCC患者的生存期。Ricke等[22]开展了一项前瞻性、随机对照的Ⅱ期研究,比较了索拉非尼联合90Y微球SIRT与索拉非尼单独治疗HCC患者的生存情况,虽然该研究未达到改善总人群OS的主要终点,但在亚组分析中发现,对于非肝硬化HCC、≤65岁的HCC及非乙醇性HCC亚组患者,索拉非尼联合90Y微球SIRT后OS显著延长。该研究为索拉非尼联合SIRT的获益人群探索提供了方向。
2.2 SIRT用于HCC的转化治疗
外科手术治疗是HCC患者获得长期生存最重要的手段,然而,可手术的HCC患者不超过20%。转化治疗的目的是使肿瘤缩小降期,为患者提供接受根治性治疗的机会。Pardo等[23]在一项国际多中心真实世界研究中(n=100),评估了R-SIRT辅助基线伴有高危因素(高血压、糖尿病、心脏病等并发症)者手术切除或移植的安全性,经R-SIRT后行肝切除或移植者中24%和7%的患者出现3级术后并发症和任何等级肝功能衰竭,术后90 d的存活率达96%,进行肝切除和移植的患者,中位OS分别超过38.2和43.9个月。提示R-SIRT有望作为手术高风险人群的辅助治疗,提高这一人群的肝切除或安全移植概率,为患者带来长期生存获益。
因切除范围较大而导致剩余肝脏体积过小引起剩余肝功能不全,是影响根治性切除的主要原因。Fernández-Ros等[24]分析了83例肝脏肿瘤患者接受R-SIRT后的肝脏体积变化,在治疗10~26周时,剩余肝体积占总肝体积之比<40%的患者显著减少(29.4%vs56.6%,P<0.001),15例患者接受了肝切除或移植。提示90Y微球SIRT作为肝切除术前的转化治疗,可使剩余肝体积代偿性增大,提高HCC的可切除性,改善术后肝功能。
对于可接受肝移植的患者,由于供肝短缺,患者等待期较长,容易出现肿瘤进展而失去肝移植机会。桥接治疗的目的是控制肿瘤进展,让患者顺利渡过等待期、接受肝移植。Salem等[25]发表的一项Ⅱ期研究比较了G-SIRT与TACE作为HCC移植前桥接治疗的效果,研究发现,G-SIRT组患者的疾病进展时间(time to progression,TTP)显著长于TACE组(>26.0个月vs6.8个月,P=0.001 2);对于处在移植等待期的患者,G-SIRT和TACE治疗分别使87%和70%的患者成功接受了肝移植。基于该研究,2018年ESMO肝癌指南推荐SIRT可替代TACE用于等待肝移植患者小肿瘤的治疗,防止患者因肿瘤进展而失去肝移植机会。
2.3 SIRT用于HCC的放射性肝段切除(radiation segmentectomy,RS)
近年来,随着SIRT技术的发展,其应用范围不断扩大。对于局限于2个肝段内的HCC,向肝段输送高剂量的90Y微球,杀死肿瘤及其周围正常肝组织,可达到与手术切除类似的效果,该治疗方式亦被称为RS。90Y微球RS为拒绝接受肝切除,或因肝功能不足、剩余肝脏体积不足等原因不适合手术切除的患者提供了新的根治性治疗选择。
2011年,Riaz等[26]首次报道了90Y玻璃微球RS(90Y glass microsphere RS,G-RS)治疗HCC患者的疗效和安全性(n=84),患者肿瘤接受的中位放射剂量为1 214 Gy,结果显示,59%的患者肿瘤应答,81%的患者肿瘤坏死;中位OS为26.9个月,中位TTP为13.6个月;安全性良好,仅9%的患者出现3/4级不良反应。
部分HCC患者病灶为单发且直径<5 cm,但因为肿瘤位置等因素影响,不能进行手术或射频消融(radiofrequency ablation,RFA)治疗。针对此类患者,Ⅴouche等[27]进行了一项多中心研究(n=102),分析SIRT的有效性,结果显示,肿瘤完全缓解(complete response,CR)率达47%,部分缓解(partial response,PR)率达39%;中位TTP为33.1个月;32%的患者经G-RS治疗后进行了肝移植;中位OS为53.4个月。该研究为90Y微球RS成为该类患者有效的治疗手段奠定了基础。
针对肿瘤<3 cm的HCC患者,Biederman等[28]开展了G-RS对比TACE联合微波消融治疗的研究(n=121),结果显示,两种疗法的CR率(82.9%vs82.5%)、OS(30.8个月vs42.7个月)及TTP(11.1个月vs12.1个月)均无显著差异。提示90Y微球RS可提供与根治性治疗相当的疗效。
3 展望
20余年的临床探索为90Y微球SIRT在HCC中的疗效和安全性提供了临床证据。基于近年来不断增加的临床获益证据,90Y微球SIRT已被国际指南推荐用于不可手术HCC患者的姑息治疗或转化治疗,成为HCC患者重要的治疗选择(图2)。鉴于90Y微球SIRT作为手术新辅助治疗及与免疫治疗等联用时展现出良好的安全性,以90Y微球SIRT为基础的联合疗法有望成为未来研究趋势。此外,随着90Y微球剂量计算模型的不断优化,其在RS上的创新应用已成为新的研究热点,未来有望作为外科手术的替代疗法,为HCC患者带来治愈希望。
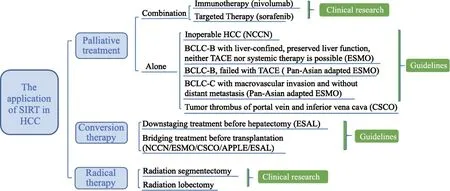
图2 SIRT在HCC中的应用Fig.2 The application of SIRT in HCC

