高效液相色谱法同时测定牡蒿叶中4个绿原酸类成分含量
于凤琳 袁丹 陈宇 李美芽 窦晓兵 蒋福升
浙江中医药大学 杭州 310053
牡蒿(Artemisia japonica Thunb.)为菊科蒿属植物,全草可入药。《现代本草纲目》记载,中药牡蒿味苦、微甘,寒,具有清热、解表、凉血、杀虫等功效;主治感冒发热,劳伤咳嗽,潮热,中暑,疟疾,高血压病,口疮,疥癣,湿疹等[1]。药理学研究表明,牡蒿富含多糖、萜类、黄酮类和酚类等成分[2],具有活血、止血、抗炎[3]、抗氧化[4]和抗关节炎[5]等诸多药理活性,且毒性低、安全性好[3-4],民间也常作野菜食用和泡茶饮用[6]。
除了上述药理活性外,牡蒿在民间也常用于肝炎治疗。早在1977年,张世友[7]采用牡蒿根治愈一例传染性肝炎;2017年,姚萍[8]采用鸭乙型肝炎病毒感染模型确证牡蒿提取物对鸭乙型病毒性肝炎具有较好疗效。然而对于牡蒿的药效物质基础的研究相对较少。笔者前期研究发现,牡蒿中含有大量绿原酸类成分。研究表明,绿原酸类成分具有良好的抗病毒[9]、保肝退黄、抗氧化、抗炎、抑菌等活性[10],可见绿原酸类成分极有可能是牡蒿发挥药效的物质基础之一。因此,本研究拟采用高效液相色谱法(high performance liquid chromatography,HPLC)建立牡蒿叶中绿原酸、异绿原酸A、异绿原酸B和异绿原酸C的含量测定方法;另外由于绿原酸类成分不稳定,易水解,因此本研究以上述4个绿原酸类成分总含量为响应值,以乙醇浓度、液料比、超声功率为主要因素,采用Box-Behnken响应面法对提取工艺进行优化,以便更确切地反映牡蒿叶中绿原酸类成分含量,为其质量控制提供科学依据,同时为牡蒿的后续开发应用奠定基础。
1 材料和方法
1.1 仪器 UltiMate3000型高效液相色谱仪购于美国戴安公司,配备LPG-3400A泵、WPS-3000SL自动进样器和PDA-3000检测器;Thermo Scientific Syncronis Amino色 谱 柱 (4.6mm×250mm,5μm) 购 于 Thermo Fisher公司(批号:12156);SK2510HP型超声波清洗器购于上海科导超声仪器有限公司;DFT-50型手提式高速粉碎机购于北京新诺立华仪器有限公司;Milli-Q Biocel超纯水仪为美国密理博有限公司。
1.2 药物和试剂 牡蒿采自福建省宁德市寿宁县,经浙江中医药大学丁志山教授鉴定为菊科蒿属植物牡蒿(Artemisia japonica Thunb.),样品保存于浙江中医药大学生命科学学院分子医学研究所(编号:2019051001);绿原酸对照品购于上海毕得医药科技有限公司(批号:AGA445,含量≥99%);异绿原酸A对照品购于上海嵘崴达实业有限公司(批号:DST190918-036,含量≥98%);异绿原酸B对照品、异绿原酸C对照品均购于成都普思生物科技股份有限公司(批号:PS001054、PS001057,含量≥98%);色谱纯乙腈购于默克公司(批号:JA078630);色谱纯甲酸购于上海麦克林生化科技有限公司(批号:C10332078);95%医用乙醇购于上海凌峰化学试剂有限公司(批号:20190917)。
1.3 色谱条件 Thermo Scientific Syncronis Amino色谱柱(4.6mm×250mm,5μm),乙腈:0.1%甲酸水(40:60,V/V)为流动相,流速1mL·min-1,柱温25℃,检测波长325nm,进样量10μL。
1.4 溶液制备
1.4.1 对照品溶液的配制 取绿原酸、异绿原酸A、异绿原酸B和异绿原酸C对照品,分别精密称定,以60%乙醇溶解定容后进行系列对倍稀释,分别配成对照 品 浓 度 均 为200.00、100.00、50.00、25.00、12.50和6.25μg·mL-1的系列混合对照品溶液。
1.4.2 供试品溶液的制备 牡蒿叶于60℃烘干,打粉,过80目筛;精密称取0.2g,置于50mL带盖管中,加入60%乙醇40mL,精密称定,重复制备3份;超声频率53kHz,功率250W,50℃下提取30min,冷却至室温,以60%乙醇补足质量,混匀,过0.22μm滤膜,备用。
1.5 测定方法建立
1.5.1 系统适用性实验 分别取混合对照品溶液和供试品溶液,按照1.3中的色谱条件各进样10μL,记录色谱图,分析各峰分离度。
1.5.2 线性关系考察 按照1.3中的色谱条件,对系列对倍稀释的混合对照品溶液进行进样分析,以浓度为横坐标,峰面积为纵坐标,进行线性关系拟合。
1.5.3 精密度实验 精密吸取1.4.1配制的混合对照品溶液,连续进样6次,记录4个对照品对应峰面积,计算相对标准偏差(relative standard deviation,RSD)值。
1.5.4 稳定性实验 取1.4.2制备的供试品溶液,按照1.3中的色谱条件,分别于0、2、4、6、8、12、24h进样10μL,记录峰面积,并计算绿原酸、异绿原酸A、异绿原酸B和异绿原酸C的RSD。
1.5.5 重复性实验 精密称取同一批样品适量,共6份,按照1.4.2的方法制备供试品溶液,再按照1.3中的色谱条件进样分析,计算样品中4个成分含量RSD。
1.5.6 加样回收率实验 取9份已知含量的牡蒿叶粉末样品,精密称定,分别加入已知成分含量80%、100%和120%的对照品,按照1.4.2的方法制备供试品溶液,然后按照1.3中的色谱条件进样分析,计算4个成分的平均加样回收率及RSD。
1.6 Box-Behnken响应面法优化提取工艺
1.6.1 单因素实验 精密称取牡蒿叶0.250g,固定其他因素不变,在超声频率53kHz条件下分别考察乙醇浓度、液料比、超声功率、超声时间和超声温度单因素变化对4个成分提取的影响,提取完成后分别定容至100mL,过0.22μm滤膜,按照1.3中的色谱方法进样分析。
1.6.2 Box-Behnken响应面优化设计 根据上述单因素实验结果,选定乙醇浓度、液料比和超声功率3个因素为优化对象,设定3个水平;采用Design-Expert 8.0.6软件,根据Box-Behnken设计原理,设置5个中心实验点,共17组实验;以4个成分总含量为响应值,优化提取工艺[11]。
1.7 工艺验证和含量测定 根据响应面法优化的提取工艺方法,重复提取6次,按照1.3中的色谱方法进样分析,测定牡蒿叶中绿原酸、异绿原酸A、异绿原酸B和异绿原酸C含量。
1.8 统计学分析 应用SPSS 18.0统计软件进行统计学分析,计量资料以±s表示,各组间比较采用单因素方差分析。采用Design-Expert 8.0.6软件对Box-Behnken响应面结果进行二次多项回归方程拟合,并对其回归系数进行方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 系统适用性验结果 按照1.3中色谱条件进样分析,提示在该色谱条件下绿原酸、异绿原酸A、异绿原酸B和异绿原酸C理论塔板数均>3 000,分离度均>2,各成分基线分离良好。见图1。
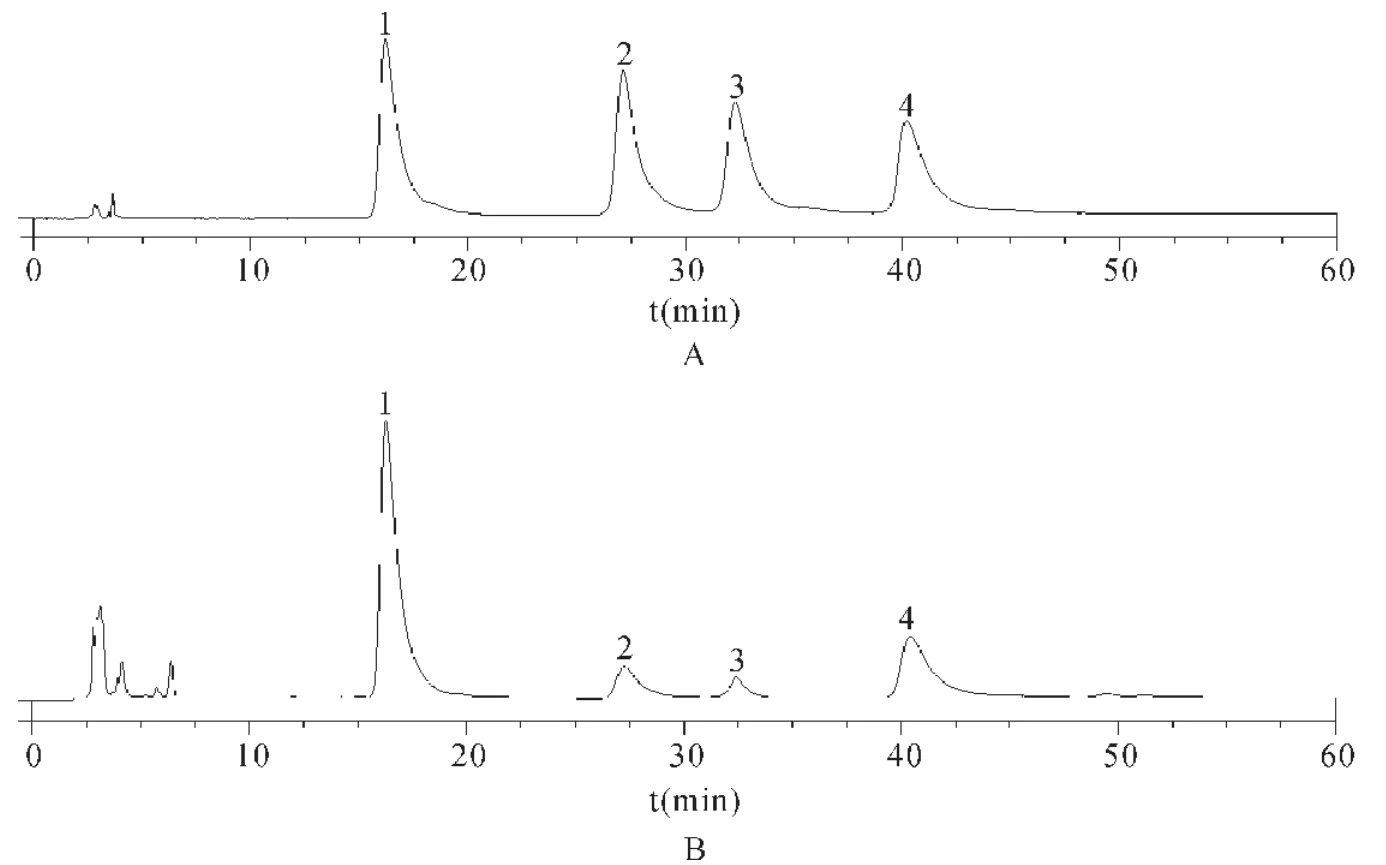
图1 混合对照品和牡蒿提取物高效液相色谱图Fig.1 High performance liquid chromatography of mixed reference and Artemisia japonica extract
2.2 测定方法学考察结果
2.2.1 线性关系考察结果 按照1.3中色谱条件,将对倍稀释混合对照品溶液进样分析,以浓度为横坐标,峰面积为纵坐标进行线性关系拟合,结果提示4个对照品在6.25~200.00μg·mL-1浓度范围内线性关系良好。见表1。
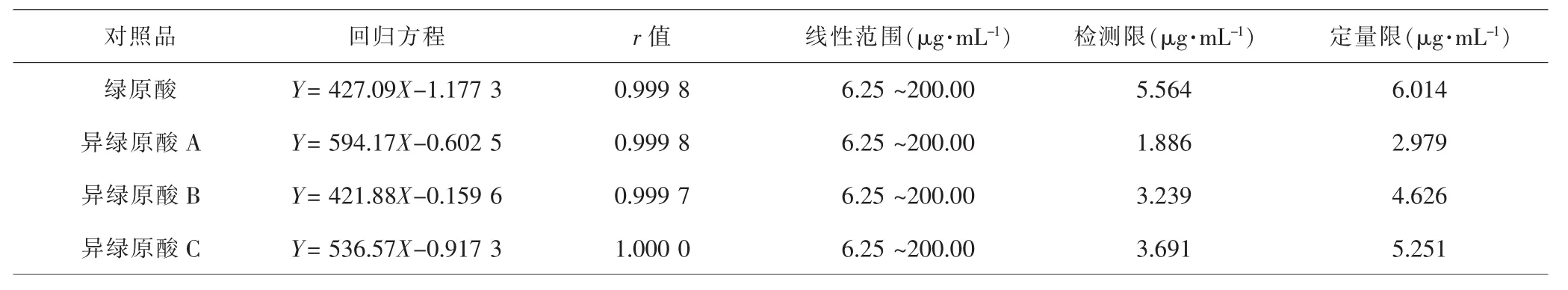
表1 4个对照品线性关系Tab.1 Linear relationship of the four references
2.2.2 精密度实验结果 精密吸取混合对照品溶液,连续进样6次,分析4个对照品对应峰面积RSD值,分别为1.059 6%、0.479 9%、0.386 2%和0.952 6%,表明仪器精密度良好。
2.2.3 稳定性实验结果 取供试品溶液,分别于0、2、4、6、8、12、24h进样10μL,计算得绿原酸、异绿原酸A、异绿原酸B和异绿原酸C的RSD分别为1.878 0%、0.778 1%、1.722 9%和1.478 4%,表明供试品溶液在24h内稳定性良好。
2.2.4 重复性实验结果 精密称取同一批样品适量,共6份,按照1.3中色谱条件进样分析,计算得出样品中4个成分含量RSD分别为1.544 7%、1.883 1%、1.763 2%和1.772 8%,表明本方法重复性良好。
2.2.5 加样回收率实验结果 4个成分RSD分别为0.887 1%、1.886 1%、2.219 3%和1.624 0%,加样回收率均在95%~105%区间内,且RSD小于3.000 0%,表明该方法准确性良好。见表2。
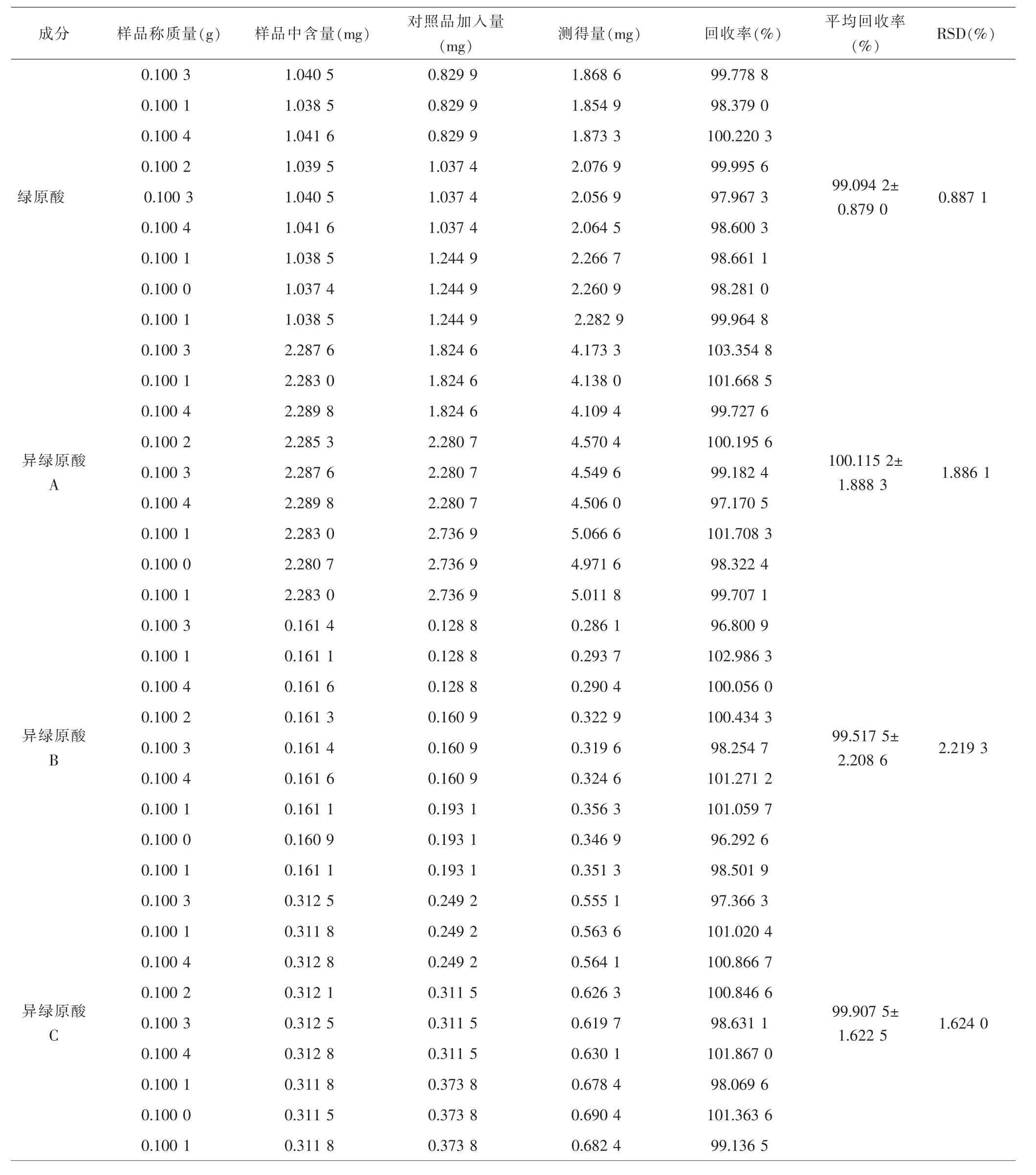
表2 加样回收率实验结果(n=9)Tab.2 Results of sample recovery(n=9)
2.3 Box-Behnken响应面法优化提取工艺
2.3.1 单因素实验结果 各单因素分析结果表明,乙醇浓度、液料比、超声功率、超声时间和超声温度各单因素变化时,4个成分合计含量极差分别为6.731 4mg·g-1、5.334 1mg·g-1、2.689 7mg·g-1、1.546 8mg·g-1和0.683 0mg·g-1,表明上述5个因素对4个绿原酸类成分提取率影响排序为:乙醇浓度>液料比>超声功率>超声时间>超声温度。见图2。总体上,异绿原酸B和异绿原酸C含量相对低,各因素变化对其提取率影响不大;绿原酸含量较高,但水溶性好,上述各因素变化情况下对绿原酸提取率影响也不显著,在高乙醇(70%)提取条件下提取率反而有所下降。见图2A。异绿原酸A含量最高,极性相比绿原酸有所降低,乙醇浓度、液料比和超声功率对其有显著影响。在超声温度50℃、液料比20:1mL·g-1、超声频率53kHz、超声功率250W、超声时间20min条件下,乙醇浓度50%时,提取率较高。见图2A。在超声温度50℃、乙醇浓度50%、超声频率53kHz、超声功率250W、超声时间20min条件下,液料比达到20:1mL·g-1后提取率增加并不明显。见图2B。在超声温度50℃、乙醇浓度50%、液料比20:1mL·g-1、超声频率53kHz、超声时间20min条件下,随超声功率增加,提取率增加,因此以仪器上限功率250W为提取超声功率。见图2C。而在乙醇浓度50%、液料比20:1mL·g-1、超声频率53kHz、超声功率250W条件下,超声时间和超声温度变化均未能显著增加提取率。见图2D、2E。综合考虑提取率和能耗等因素,初步确定乙醇浓度50%、液料比20∶1mL·g-1、超声功率250W、室温超声提取20min较为合适。
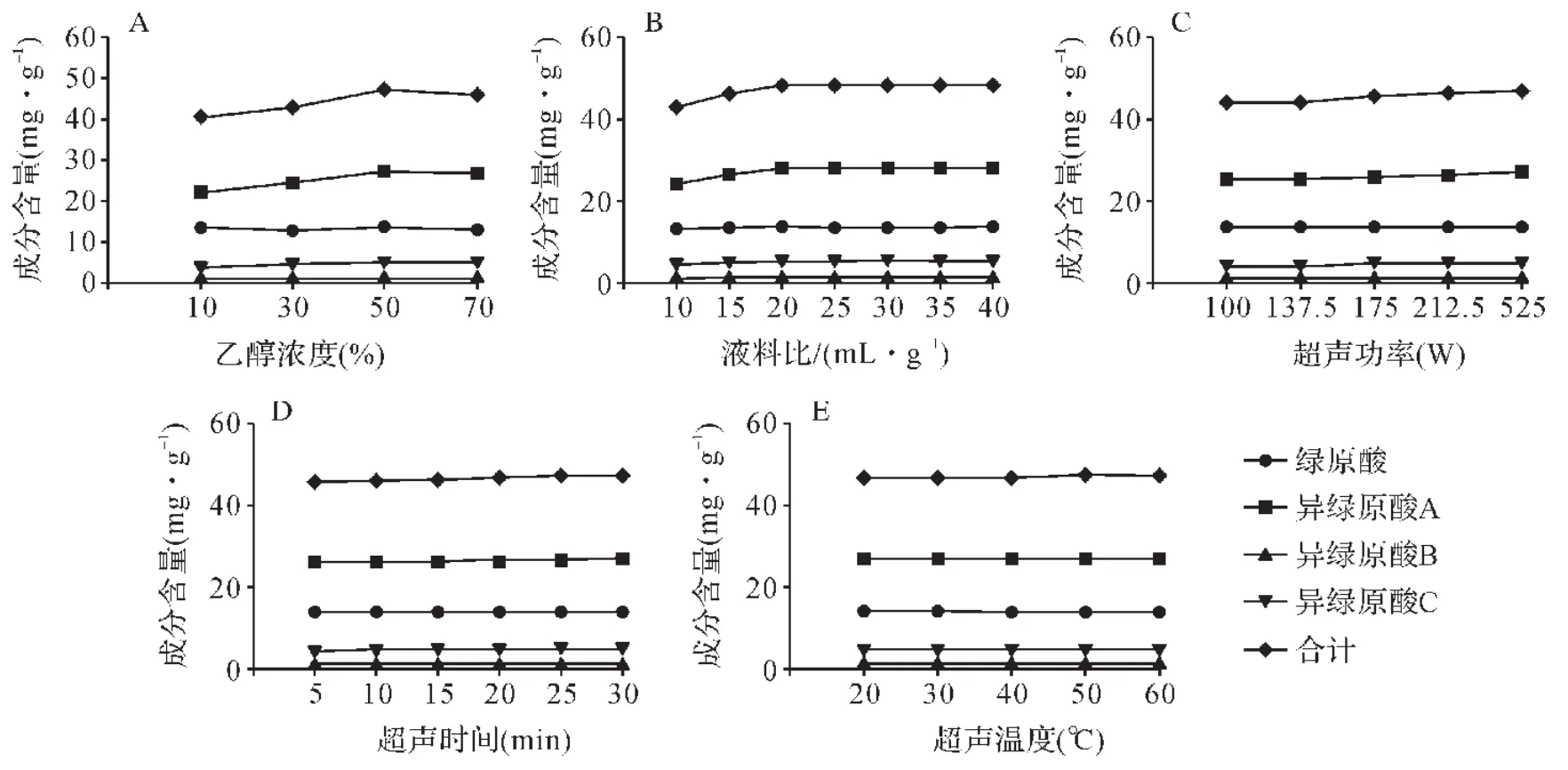
图2 各提取因素对4个成分提取率影响Fig.2 Impact of extraction factors on the extraction rate of the four components
2.3.2 Box-Behnken响应面优化设计结果 根据上述单因素实验结果,选定乙醇浓度、液料比和超声功率3个因素为优化对象,设定3个水平。见表3。采用Design-Expert 8.0.6软件,根据Box-Behnken设计原理,设置5个中心实验点,以4个成分总含量为响应值,共完成17组实验。见表4。

表3 响应面优化设计因素与水平Tab.3 Factors and levels of response surface experiment design
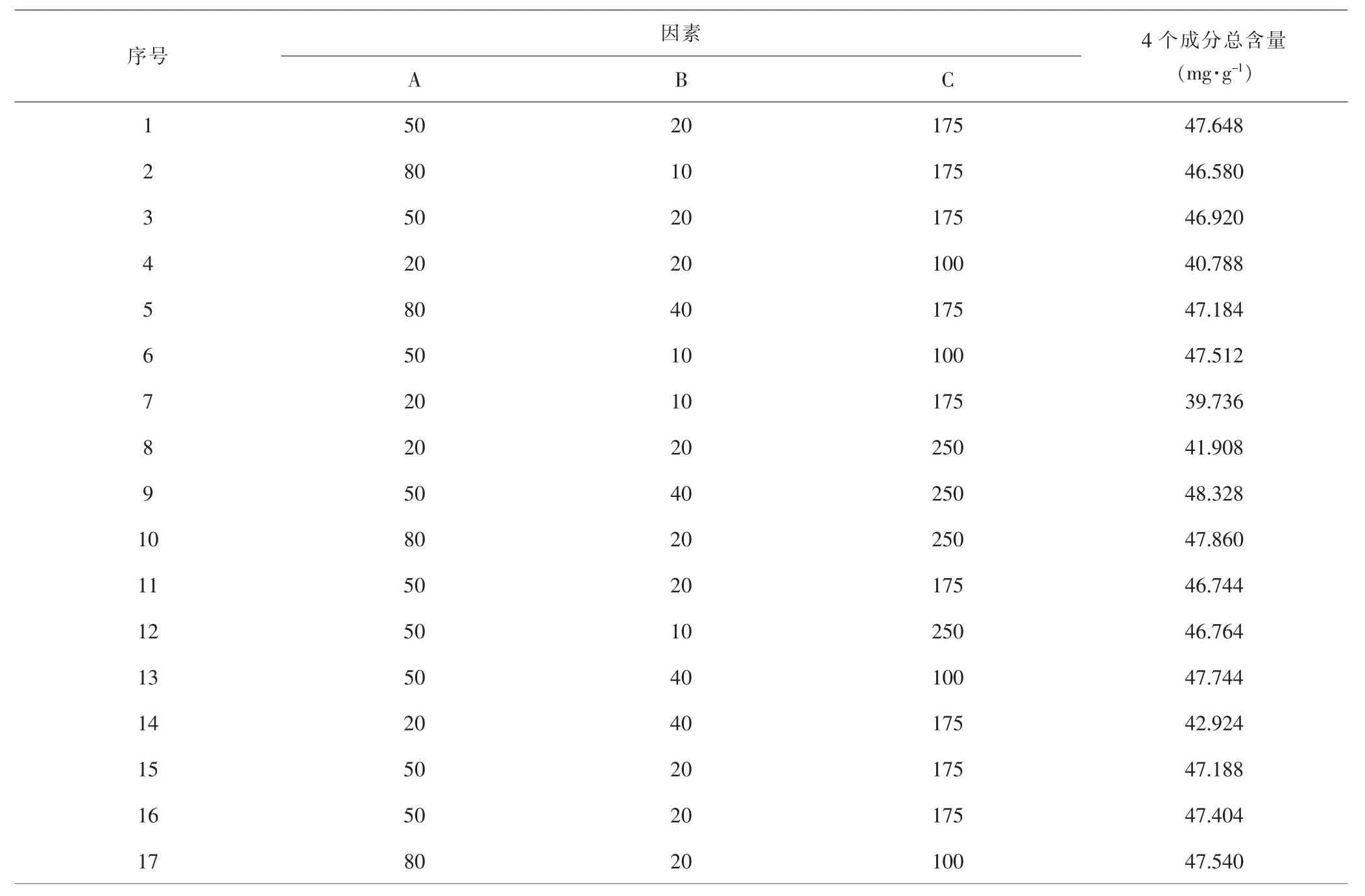
表4 响应面实验设计安排与结果Tab.4 Arrangement and results of response surface experiment design
借助Design-Expert 8.0.6软件分析,4个成分合计提取率对因素A、B、C的二次多项回归方程为:提取率=11.86+0.72A+0.17B+0.050C-0.17AB-0.050AC+0.063BC-0.77A2-0.067B2+0.10C2,建立的回归模型P<0.01。见表5。表明模型对提取率预测较准,拟合精度较好,可利用该模型作后续优化设计。失拟项P=0.182 3>0.05,表明该模型拟合较好。同时,多元相关系数R2=0.986 7,接近于1,表明相关性好;校正决定系数R2和预测系数R2均较高且数值接近,表示该回归模型能充分解释工艺过程。此外,变异系数<10%,精密度>4,表明实验的可信度和精确度高,有效信号与噪声比值较为合理。模型的二次项系数为负,曲线开口向下,说明提取率有极大值。一次项中因素A和二次项A2对结果影响极显著,一次项因素B对结果影响显著,因素A和B交互作用也非常显著。见表5。

表5 Box-Behnken响应面二次模型及其回归系数方差分析Tab.5 Box Behnken response surface quadratic model and its regression coefficient variance analysis
2.3.3 响应曲面和等高线图分析结果 固定任意1个因素处于零水平,按照拟合的二次回归方程对其他2个因素进行编程运算,经Design-Expert 8.0.6分析得到交互因素的响应面和等高线图。见图3。从图3中看出,乙醇浓度对4个成分提取率的影响最显著,曲线弧度较大;液料比与超声功率相对次之,曲线弧度较小。2个因素交互影响方面,乙醇浓度与液料比交互作用比较明显。以提取量取最大值为参考,采用Design-Expert 8.0.6优化分析,超声提取牡蒿中总绿原酸最佳工艺为:乙醇浓度为59.75%,液料比为40:1mL·g-1,超声频率53kHz,功率为250W,室温下提取20min,95%置信度下,提取量的预测值为49.061 2mg·g-1。
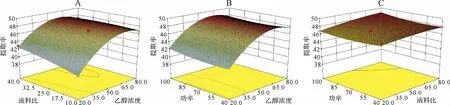
图3 乙醇浓度、液料比和超声功率对牡蒿叶4个绿原酸成分总提取率交互影响的响应面图Fig.3 Response surface diagram of interaction among ethanol concentration,liquid-solid ratio and ultrasonic power on total extraction rate of four chlorogenic acid components in Artemisia japonica leaves
2.4 工艺验证和含量测定结果 为方便操作,调整乙醇浓度为60%,以液料比为40:1mL·g-1,超声频率53kHz,超声功率为250W,室温下提取20min,平行试验6次,按照1.3中的色谱方法进样分析,实际测得绿原酸、异绿原酸A、异绿原酸B和异绿原酸C含量分别为14.317 0mg·g-1、27.945 2mg·g-1、1.230 4mg·g-1和5.066 5mg·g-1,合计总量达48.559 0mg·g-1。见表6。4个成分合计含量与理论预测值的相对偏差为1.0236%,表明采用响应面法优化得到的超声提取牡蒿中4个绿原酸类成分的工艺参数准确可靠。此外,值得注意的是,与其他富含绿原酸类中药相比,牡蒿叶中绿原酸和异绿原酸A含量高于大多数中药材。见表7。
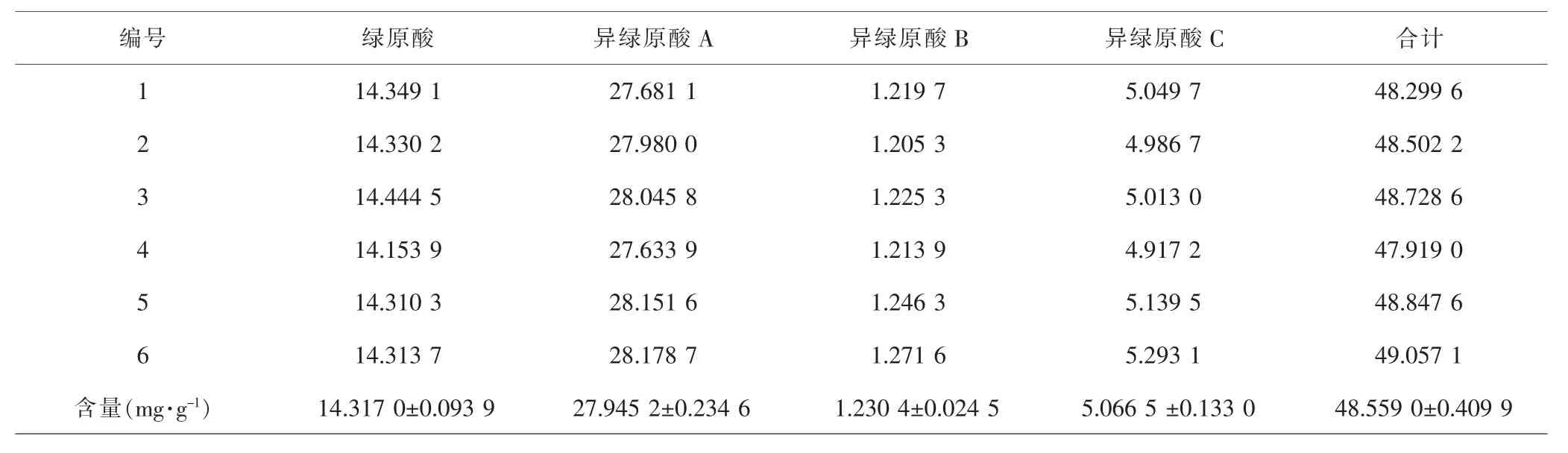
表6 牡蒿叶中各成分含量测定结果Tab.6 Content determination results of four chlorogenic acids in Artemisia japonica leaves

表7 各药材中绿原酸、异绿原酸A、异绿原酸B和异绿原酸C含量(mg·g-1)Tab.7 Contents of chlorogenic acid,isochlorogenic acid A,isochlorogenic acid B and isochlorogenic acid C in different Chinese herbs(mg·g-1)
3 讨论
绿原酸类成分是众多药用植物的药效成分,常作为指标成分用于中药材质量分析和药物制剂质控[12-20]。从文献资料看,多数研究采用RP18反相色谱柱,以乙腈和甲酸水(或磷酸水)为流动相,对绿原酸类成分含量进行测定[12-20]。而笔者前期研究发现,牡蒿提取物中有少量杂质峰,与异绿原酸A、B和C峰重叠,RP18色谱柱难以有效分离;但采用Thermo Scientific Syncronis Amino正相色谱柱,以乙腈:0.1%甲酸水(40:60,V/V)为流动相,1mL·min-1等度洗脱,大多杂质峰在7min内已出峰,绿原酸、异绿原酸A、异绿原酸B和异绿原酸C峰周围未见杂质峰,且4个成分分离度良好。Syncronis Amino正相色谱柱常用于糖类和氨基酸等水溶性成分分析,绿原酸类成分含奎尼酸基团,极性大,从实验结果看,该色谱柱也适用于绿原酸类成分分离,所建立的色谱方法稳定可靠,适用于牡蒿叶中绿原酸类成分含量测定。
在单因素考察基础上,以牡蒿叶中4个主要绿原酸类成分总提取率为响应值,采用Box-Behnken响应面法对乙醇浓度、液料比和超声功率3个因素进行优化设计。结果与单因素考察结果类似,各因素的影响大小依次为乙醇浓度>液料比>超声功率,其中乙醇浓度和液料比交互作用显著。通过Design-Expert 8.0.6计算和工艺验证,确定最佳提取工艺为:60%乙醇,液料比40:1(mL·g-1),超声频率53kHz,功率250W,室温超声提取20min。在该优化提取工艺下,测得牡蒿叶中绿原酸、异绿原酸A、异绿原酸B和异绿原酸C含量 分 别 高 达14.317 0mg·g-1、27.945 2mg·g-1、1.230 4mg·g-1和5.066 5mg·g-1,与提取工艺优化前比较,测得的4个成分含量明显提高,这在一定程度上与绿原酸类成分稳定性有关,尤其是水提过程中更易降解,因此通过合理优化提取工艺后,能更为真实地反映牡蒿叶中绿原酸类成分的实际含量。另外,综合比较现有文献资料可以发现,牡蒿叶中绿原酸含量低于金银花、甜叶菊和款冬花,与绵茵陈和毛连菜相当;异绿原酸A含量低于金银花,但高于绵茵陈;异绿原酸B和异绿原酸C含量也较高;4个成分总含量仅次于金银花,高于大多传统中药。尤其值得注意的是,与同科属植物绵茵陈比较,除了绿原酸含量相当外,牡蒿中的其余3个成分含量均高于绵茵陈。绵茵陈具有清热、利湿、退黄等功效,常用于治疗湿热黄疸和传染性肝炎等病症;而研究已证实绿原酸、异绿原酸类成分是其发挥抗炎、抗氧化、抗病毒、保肝退黄等重要药效物质基础[9-10]。因此,本研究从物质含量角度,间接提示了牡蒿治疗黄疸型肝炎的潜在药效物质基础。此外,中药成分复杂,建立多指标成分测定方法对建立中药质量标准、提升中药材品质具有重要意义[21],因此本研究为牡蒿的进一步开发应用及其质量标准的建立奠定了良好的基础。

