线粒体分裂蛋白DRP1在胶质瘤中的表达及其临床意义
范文君,田玉玉,蔡青,冯达云,折潇
脑胶质瘤是颅内最常见的原发肿瘤,约占原发性中枢神经系统肿瘤的48%[1]。胶质瘤因生长迅速、侵袭性强而预后不良,患者2年生存率不到15%,5年生存率低于10%[2]。由于胶质瘤的发病机制不清,传统的手术治疗加放化疗的效果欠佳,90%以上的胶质母细胞瘤患者在指南推荐的标准放化疗后数月出现复发[3]。
线粒体是细胞质的一个重要组成部分,近年来许多研究表明线粒体是影响肿瘤发生发展的重要因素:恶性肿瘤三磷酸腺苷(adenosine Triphosphate,ATP)的产生方式主要为有氧糖酵解;此外线粒体凋亡通路存在异常,提示线粒体功能失调参与了肿瘤的病理生理机制[4]。而恶性胶质瘤的线粒体结构异常和功能障碍是一个被忽视的研究方向。线粒体分裂蛋白DRP1定位于胞浆,以多聚体形式发挥功能,当线粒体受到各种理化因素的刺激后,线粒体外膜分裂适配蛋白分子1(mitochondrial adaptor fission 1,Fis1)召集DRP1并转运至线粒体外膜处的潜在分裂位点上,DRP1聚合物围绕线粒体形成指环结构,通过水解三磷酸鸟苷(guanosine triphosphate,GTP)提供能量,逐渐压缩线粒体使得线粒体断裂,发挥分裂线粒体的功能[5]。此外,有文献报道DRP1参与脯氨酸代谢、机体免疫调节、细胞凋亡等重要功能的调节[6-7]。此前亦有文献报道在胶质瘤中DRP1的表达水平异常增高[8-9]。为此,本研究对CGGA数据库中mRNAseq_325的数据和临床资料进行多层次分析,检测临床病例的胶质瘤(及不同部位)组织的DRP1表达水平,并分析DRP1表达水平与患者生存时间的关系;以探讨线粒体分裂蛋白DRP1在胶质瘤中的表达和转录水平及其与患者预后的关系。
1 材料与方法
1.1 资料数据收集 中国脑胶质瘤基因组图谱计划(CGGA)由北京市神经外科研究所、首都医科大学附属北京天坛医院江涛教授团队建立。目前该数据库是我国最全、最新、最科学的胶质瘤图谱,该数据库包含了患者性别、年龄、放疗和化疗情况、最长达4 537 d的随访结果,以及近2 000例不同组织病理分类、不同WHO分级、原发/复发中国人群的脑胶质瘤的基因组学数据。数据库于2020年5月6日数据更新。本研究获取了mRNAseq_325这一组数据,该数据库包含325例不同级别胶质瘤患者的mRNA测序,以及该患者的基因突变信息。此外,还收集了TCGA和GEO数据库(GSE16011)中胶质瘤的DRP1转录数据。
1.2 胶质瘤组织标本的收集 收集空军军医大学唐都医院神经外科2019年6月—2020年4月手术切除的14例胶质瘤组织样本,放入液氮中冻存待测。14例胶质瘤组织样本均匹配有大致正常的瘤旁组织。所有组织样本的收集、使用经空军军医大学伦理委员会批准。
1.3 DRP1蛋白含量检测 采用蛋白免疫印迹方法。将收集到的组织样本从液氮中取出,分离约10 mg组织样本,加入500 μL RIPA裂解液,置于冰上,用匀浆器将组织匀浆。之后冰上再静置裂解20 min,13 000 g离心15 min,收集上清,BCA蛋白定量后加入5×上样缓冲液。配置10%的下层和5%的上层聚丙烯酰胺凝胶,蛋白电泳分离蛋白样品;转膜,5%的脱脂奶粉封闭2 h,一抗孵育过夜。DRP1(CST,#8570,1∶1 000),Actin(Abclone AC004,1∶20 000)。
1.4 DRP1 mRNA含量检测 取适量组织样本,加入1 mL TRIzol(America,Invitrogen),按照说明书提取总RNA,再用反转录试剂盒(Takara,Japan)反转录RNA成为cDNA。再采用qPCR检测cDNA的含量。引物序列:DRP1(F:5′-GCTCCAGGACGT-CTTCAACA-3′,R:5′-TCTGCTTCCACCCCATTTTCT-3′,)GAPDH(F:5′-CCACCCATGGCAAATTCCATG-GCA-3′,R:5′-TCTAGACGGCAGGTCAGGTCCACC-3′)。
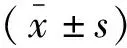
2 结 果
2.1 胶质瘤与正常脑组织的DRP1 mRNA水平比较 CGGA-mRNAseq_325数据库的数据显示,Ⅳ级胶质瘤的DRP1 mRNA水平明显低于Ⅱ级、Ⅲ级胶质瘤,差异具有统计学意义(P=0.000 000 11,P=0.000 068);但Ⅱ级与Ⅲ级胶质瘤DRP1 mRNA水平之间的差异无统计学意义(P=0.23)(图1A)。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变是低级别胶质瘤和继发性胶质母细胞瘤的重要标记物,IDH突变导致胶质瘤产生超甲基化表型,是肿瘤细胞表观遗传不稳定的主要原因。另有研究显示,同一级别胶质瘤IDH突变者表现出更长的生存期。IDH突变型胶质瘤的DRP1 mRNA水平高于野生型胶质瘤(P=0.000 000 005 4)(图1B)。染色体1p/19q联合性缺失作为少突胶质细胞肿瘤的诊断标志,与化疗的敏感性和预后生存相关,表现为同级别的胶质瘤之间,1p/19q联合性缺失患者的生存期更长。染色体1p/19q联合性缺失型胶质瘤的DRP1 mRNA水平高于非缺失型胶质瘤(P=0.000 002 7)(图1C)。与正常脑组织相比,胶质瘤组织的DRP1 mRNA水平明显降低(P<0.05)(图1D)。GEO数据库的胶质瘤数据组(GSE16011)中,对照组为8例,胶质瘤组患者为276例;与对照组相比,胶质瘤组织的DRP1 mRNA明显降低(P<0.000 1)(图1E);胶质瘤Ⅱ级与Ⅲ级的DRP1 mRNA的差异无统计学意义(P=0.72),胶质瘤Ⅱ级与Ⅳ级相比DRP1 mRNA降低(P=0.018),胶质瘤Ⅲ级与Ⅳ级相比DRP1的 mRNA也降低(P=0.001 2)(图1F),这与之前CGGA数据库中的结果一致。

A:CGGA-mRNAseq_325数据库,各级胶质瘤的DRP1 mRNA水平;B:IDH突变和野生型胶质瘤的DRP1 mRNA水平;C:染色体1p/19q联合性缺失(Codel)和非联合性缺失(Non-codel)胶质瘤的DRP1 mRNA水平;D:TCGA胶质瘤数据库中的DRP1 mRNA水平;E:GEO数据库胶质瘤数据组(GSE16011),胶质瘤组与正常对照组的DRP1 mRNA水平比较;F:GEO数据库胶质瘤数据组(GSE16011),不同级别胶质瘤组与正常对照组间的DRP1 mRNA水平比较
2.2 本组胶质瘤与瘤旁组织DRP1蛋白和mRNA水平比较 本研究收集14例Ⅳ级胶质瘤患者的瘤体组织,同时获得少量瘤旁组织,检测结果显示,6例Ⅳ级胶质瘤患者胶质瘤组织的DRP1蛋白和mRNA表达水平均明显低于瘤旁组织(均P<0.05)(图2)。与前面数据库的数据一致。
A:胶质瘤和瘤旁组织的DRP1蛋白检测;B:胶质瘤与瘤旁组织的DRP1蛋白水平;C:胶质瘤与瘤旁组织的DRP1 mRNA水平(T-胶质瘤组织,N-瘤旁组织)
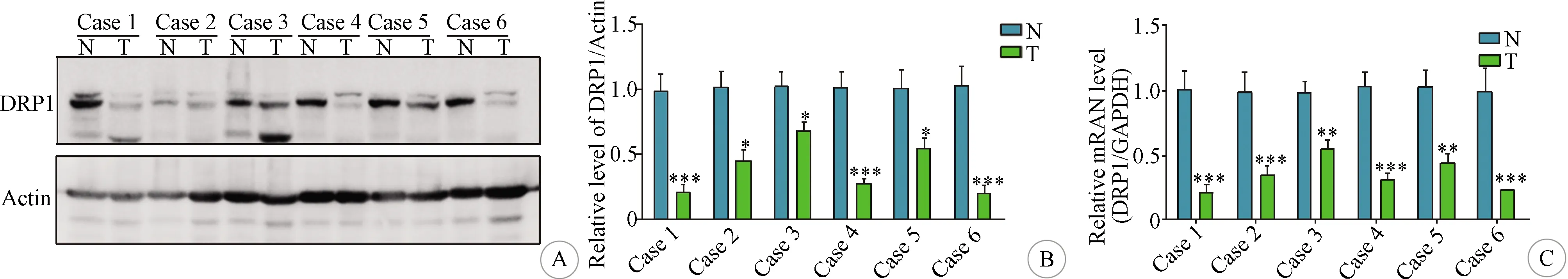
2.3 胶质瘤不同区域的DRP1蛋白和mRNA水平比较 本研究对3例Ⅳ级胶质瘤的外缘(交界区)、中心区和瘤旁区组织进行检测。结果显示,与瘤旁区相比,交界区与瘤中心区组织的DRP1蛋白和mRNA表达水平降低(均P<0.05)(图3A-I)。不同区域DRP1蛋白表达水平的整体统计结果显示,与瘤旁区相比,瘤体区组织的DRP1蛋白表达水平明显降低(图3J)。
A、D、G:胶质瘤瘤旁区、交界区和中心区组织的DRP1蛋白水平检测;B、E、H;瘤旁区、交界区和瘤体区组织的DRP1蛋白水平;C、F、I:瘤旁区、交界区和瘤体区的DRP1 mRNA水平;J:不同区域组织的DRP1水平整体统计结果
2.4 DRP1高表达与低表达胶质瘤患者的生存时间比较 从CGGA数据中分析DRP1的转录水平与患者生存时间的关系显示,DRP1高表达患者的生存时间明显长于低表达患者(P<0.000 1);DRP1高表达组患者的中位生存时间比DRP1低表达组患者长7年以上。见图4。
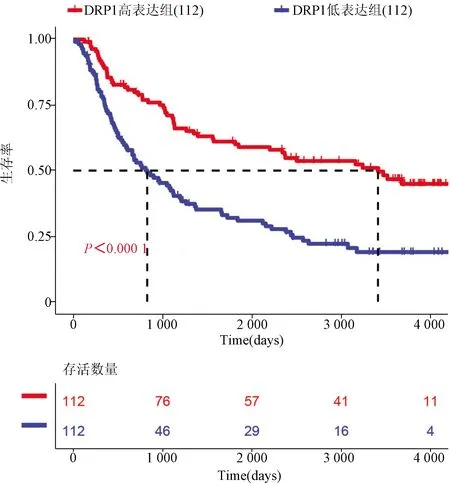
CGGA-mRNAseq_325数据库中DRP1高表达和低表达胶质瘤患者的生存时间
3 讨 论
脑胶质瘤是颅内最常见的原发恶性肿瘤,即使采取积极治疗如手术加标准化疗和放疗后,复发率依然很高,5年生存率很低[1]。近年来基于大规模高通量测序技术的迅猛发展,以及对于临床病例随访数据库的不断完善,使得胶质瘤的组学研究和精准医疗取得空前的发展,各种新型辅助治疗不断被报道,给临床诊疗提供了更多的选择。
CGGA是由首都医科大学北京天坛医院神经外科江涛教授团队领衔建立的中国脑胶质瘤基因组图谱数据库[10]。该库中所有样本均来源于中国胶质瘤患者,涉及近2 000例胶质瘤样本的病理分类、WHO分级、mRNA芯片检测数据、mRNA测序数据、miRNA芯片数据和DNA甲基化芯片数据,可进行基因突变图谱、基因表达分布、DNA甲基化水平的可视化和基因与生存相关性分析等。以往研究对小样本胶质瘤的免疫印迹和PCR检测,由于样本量太小及取样的限制,得出的结果可能存在一定的偏倚及误差,而通过分析CGGA数据库中大样本测序再加上一定量样本的免疫印迹和PCR检测结果,能更准确地反映胶质瘤的特性及特点。这有助于提高对胶质瘤的认识及开发针对胶质瘤的新干预策略[10-11]。此外,本研究还观察了TCGA肿瘤数据库及GEO数据库中的胶质瘤数据,综合目前世界上的三大肿瘤数据库的数据,对胶质瘤的DRP1转录水平及其意义进行分析。
线粒体与肿瘤发生关系密切。线粒体是细胞生物能量代谢、生物合成与信号转导的重要枢纽,能帮助细胞感应应激及适应环境,因此在肿瘤的发生发展中发挥着特殊作用[4]。在不同肿瘤中均发现了线粒体动力学的紊乱,表现为与瘤旁组织相比,肿瘤细胞的线粒体融合/分裂蛋白发生异常,线粒体形态也发生改变。在肝癌、乳腺癌和肺癌中发现线粒体分裂蛋白DRP1表达水平升高[12],而线粒体融合相关蛋白(mitofusins,MFNs)表达水平降低[13-14],即线粒体分裂态增加,提示肿瘤中线粒体动力学发生了改变,而通过干预紊乱的线粒体融合/分裂状态可能是潜在的治疗靶点[8,15]。然而,肿瘤中线粒体形态改变并不是一成不变的。本研究发现,胶质瘤表现出与大多数肿瘤不同的线粒体形态,即DRP1表达水平降低,分裂态降低,而线粒体融合状态增加;这提示胶质瘤中线粒体动力学发挥着不同于其他肿瘤的作用及效应。
线粒体动力蛋白DRP1可能参与免疫应答的调节。线粒体形态参与细胞能量代谢的调控,可间接地影响免疫细胞的活化和应答。近期一项研究表明DRP1功能降低抑制机体免疫反应,提示线粒体动力学对于机体免疫至关重要[16]。另一项研究[17]发现,特异性敲除巨噬细胞中线粒体融合基因Miga2会导致线粒体过度分裂,进而导致线粒体碎片化,巨噬细胞会特异性表达白介素12(interleukin 12,IL-12),这会促进T细胞产生干扰素γ(interferon gamma,IFN-γ),并显著增强其抗肿瘤免疫的能力;另外,发挥抗肿瘤效应的T细胞拥有更多的碎片化线粒体,而当肿瘤被清除时,这些T细胞会消亡。然而,在胶质瘤中DRP1转录和翻译的绝对降低,使得线粒体分裂态大幅减少,故而可能使免疫细胞的激活受到抑制,导致免疫细胞的抗肿瘤效应大大降低,这很可能是胶质瘤在发生发展中发挥免疫逃逸的重要原因。
线粒体动力蛋白DRP1参与细胞凋亡的核心调控。在凋亡早期,胞浆中的DRP1会转移至线粒体表面,使线粒体发生严重的碎片化[18-19]。促凋亡蛋白(B-cell lymphoma-2 associated X,Bax)亦从胞浆转移至线粒体,并可与DRP1共定位,使线粒体内外膜物质如细胞色素C释放,而细胞色素C的释放会与胞质中的凋亡肽酶激活因子1(Apoptotic peptidase activating factor 1,APAF-1)以及半胱氨酸天冬氨酸蛋白酶前体9(procaspase-9)共同组成凋亡体,激活Caspase-9并与Caspase-8一起诱发Caspase级联反应,发生细胞凋亡[20-21]。在这一过程中,DRP1的线粒体转位发挥了重要作用,若通过敲低DRP1阻止DRP1的线粒体转位,线粒体碎片化及细胞凋亡将会被抑制,细胞存活受到保护[22]。因此,胶质瘤的DPR1低表达很可能限制了多种理化治疗对于胶质瘤细胞的杀伤作用,抑制了胶质瘤细胞的凋亡使得治疗效果不佳。
综上所述,本研究通过对CGGA、TCGA和GEO胶质瘤数据库进行深入分析,以及临床胶质瘤组织样本的免疫印迹和PCR检测,发现了胶质瘤中线粒体动力学蛋白DRP1表达水平异常。与文献报道的肝癌、乳腺癌及肺癌中DRP1表达水平升高不同,胶质瘤的DRP1蛋白表达水平明显降低。并且DRP1低表达患者的生存时间明显减少,这可能与DRP1调节肿瘤免疫和细胞凋亡的功能有关。DRP1表达水平低可作为反映胶质瘤患者预后不良的重要指标,对DRP1低表达进行干预可能是胶质瘤治疗的潜在靶点。

