脐血间充质干细胞外泌体对APP/PS1小鼠海马神经元的保护作用及其机制
王涵,刘卫平,龙乾发,李俊辰,黑悦,刘宇琪,季丞
阿尔茨海默病(Alzheimer’s disease,AD)是一种隐匿起病的进行性神经退行性疾病,目前机制尚不清楚;虽然在AD的研究方面已投入巨大,但仍然缺乏有效的预防及治疗措施[1-2]。间充质干细胞(mesenchymal stem cell,MSC)具有抗炎、免疫调节、血管生成、清除病理蛋白以及基质重构等功能[3]。而间充质干细胞外泌体(mesenchymal stem cell-derived exosome,MSC-EXO)不仅具有与间充质干细胞相似的功能,并且具有更好的安全性[4]。本研究以APP/PS1小鼠作为AD的疾病模型,给予尾静脉注射MSC-EXO处理,通过免疫组织化学染色观察小鼠脑内淀粉样蛋白(amyloid β-protein,Aβ)的沉积,并通过Nissl染色观察海马组织的神经元数量;并对NF-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)、Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein-1,Keap1)及血红素氧合酶1(heme oxygenase-1,HO-1)蛋白的表达水平进行检测;以探讨MSC-EXO对海马神经细胞的保护作用及其机制,为AD的治疗提供一种新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级APP/PS1雄性小鼠以及年龄匹配的野生型C57BL/6小鼠(北京华阜康生物科技股份有限公司,许可证号SCXK(京)2016-0006),饲养于空军军医大学动物中心,生产许可证号:SCXK(陕)2019-001;小鼠在12∶12白昼交替的环境中自由饮食饮水。本研究方案得到空军军医大学动物伦理委员会的批准。
1.1.2 主要试剂 间充质干细胞专用培养基(友康恒业生物科技有限公司);4′,6-二脒基-2-苯基吲哚(DAPI)(Sigma,D9542-10MG);兔抗ACTB(Abclonal,AC026);兔抗Nrf2(Abmart,T55136S);兔抗keap1(Proteintech,10503-2-AP);兔抗HO-1(Proteintech,10701-1-AP);6e10抗体(Biolegend,SIG-39320);辣根过氧化物酶偶联的羊抗鼠(Thermo Fisher Scientific,A16078),辣根过氧化物酶偶联的羊抗兔(Thermo Fisher Scientific,A16096),CD9单克隆抗体(Abcam,ab92726);TSG101单克隆抗体(Abcam,ab125011);Alexa FlourTM 594 C5 Maleimide(Invitrogen,A10256)。
1.2 方法
1.2.1 MSC培养及外泌体(exosome,EXO)分离、鉴定 本课题组前期已形成成熟的MSC培养和EXO分离与鉴定的方法[5]。使用干细胞专用培养基培养间充质干细胞,细胞融合至80%时,更换无血清培养基继续培养24~48 h,收集细胞上清,于-80 ℃冻存备用,或者直接进行EXO的分离。采用超速离心法在4 ℃下进行EXO的分离,依次300 g/min离心10 min、2 000 g/min离心10 min、10 000 g/min离心20 min去除细胞及细胞碎片,100 000 g/min离心70 min得沉淀,PBS重悬;再次100 000 g/min离心70 min,沉淀以100 μL PBS重悬,-80 ℃保存。采用蛋白质免疫印迹法检测EXO的表面标志物CD9和TSG101,电子显微镜(电镜)观察EXO的形态。
1.2.2 EXO的标记与示踪 按本课题组前期研究的方法[6]。将Alexa FlourTM594 C5 Maleimide加入EXO悬液中,避光常温孵育1 h;EXO旋转柱(MW3000,Invitrogen)中的树脂粉末在常温下水化15~30 min,离心去除多余的水分,将旋转柱放入1.5 mL离心管中,孵育完毕的EXO加入树脂中,750 g离心5 min,收集标记的MSC-EXO。将标记的MSC-EXO通过尾静脉注射入APP/PS1小鼠体内,24 h后麻醉小鼠,灌注取脑固定,行免疫荧光染色,用共聚焦显微镜对小鼠大脑切片进行观察拍照。
1.2.3 动物分组及处理 将20只培养至9个月大的APP/PS1小鼠随机分为模型组(AD+saline)和治疗组(AD+EXO),每组10只;将年龄匹配的10只野生型c57小鼠作为正常对照组。治疗组小鼠通过尾静脉注射50 μg/150 μL EXO悬液,AD+ saline组和对照组小鼠注射等体积的生理盐水。30 d后,每组4只小鼠直接取海马组织做免疫印迹实验,每组3只小鼠4%多聚甲醛灌注后取海马行免疫组化染色,每组3只小鼠取海马用4%戊二醛固定后电镜下观察。
1.2.4 蛋白质免疫印迹法 3组小鼠在注射EXO或生理盐水后30 d处死,于冰上快速剥离海马组织,加入RIPA裂解液,超声裂解后,12 000 r/min离心10 min,取上清液进行BCA定量,然后加入上样缓冲液,95 ℃加热10 min,制备蛋白样品。10%琼脂糖凝胶电泳(SDS-PAGE)分离蛋白,300 mA 恒流转膜2 h,5%脱脂奶粉封闭2 h。TBST缓冲液洗膜,4 ℃下一抗孵育过夜;次日复温1 h,TBST洗膜,常温下二抗孵育2 h,加入发光液于发光仪中曝光。用Image Lab分析条带。
1.2.5 免疫组化和免疫荧光染色 小鼠麻醉后用4%多聚甲醛灌注,剥离脑组织置于4%多聚甲醛溶液中固定,石蜡包埋,切片(厚度4~10 μm)。将切片依次浸入二甲苯及梯度乙醇中进行脱蜡和水化;之后放入枸橼酸缓冲液中沸水浴100 s进行抗原修复;在3%的过氧化氢溶液中室温孵育30 min,TBS冲洗3次;二抗来源的血清室温下封闭1 h,加一抗在湿盒中孵育过夜;次日用TBS冲洗切片,室温下孵育二抗2 h(免疫组化用HRP偶联的二抗,免疫荧光用Alex 488偶联的二抗)。免疫组化染色:二抗洗涤后,DAB显色,自来水终止;苏木素复染30~60 s,水洗后用1%盐酸乙醇分化,自来水返蓝,脱水固定封片。免疫荧光染色:二抗洗涤后,DAPI染色10 min,洗涤后,封片。在显微镜下观察切片,并采集图像。
1.2.6 透射电镜观察 取脑剥离海马组织,浸泡在4%戊二醛固定液中将海马切成组织块(1 mm×1 mm×2 mm),继续在4%戊二醛溶液中固定24 h,PBS缓冲液冲洗;1%锇酸中后固定,漂洗;梯度乙醇及丙酮脱水;依次使用不同比例的丙酮与包埋剂进行渗透;使用812树脂进行包埋,将包埋板放入恒温干燥箱中37 ℃ 4 h、45 ℃ 6 h、60 ℃ 12 h依次干燥后,进行超薄切片,片厚50~100 nm;醋酸双氧铀和柠檬酸铅分别染色30 min、10 min,蒸馏水漂洗,干燥,电镜下观察。
1.2.7 尼氏染色(Nissl staining) 取材及石蜡包埋、切片等步骤同上。石蜡切片依次在二甲苯和梯度乙醇中脱蜡和水化,用1%焦油紫溶液染色20 min,蒸馏水清洗切片,用70%乙醇分色,之后梯度乙醇脱水,固定封片,显微镜下观察。
2 结 果
2.1 间充质干细胞及EXO鉴定、示踪 流式细胞仪检测培养的间充质干细胞的表面标志,发现其高表达干细胞及基质细胞标记CD29、CD90、CD44,阳性率均在90%以上,低表达造血干细胞及内皮细胞标志CD34和CD45,阳性率均低于2%(图1)。免疫印迹检测结果显示,EXO表面标志蛋白TSG101、CD9呈阳性;电镜观察MSC-EXO为类圆形双层膜囊泡状结构,呈盘状或茶托状,膜结构完整,直径在30~150 nm之间,具有EXO的典型特性。对给予A549标记EXO的小鼠脑组织进行NeuN免疫荧光染色,电镜下被NeuN标记的神经元为绿色。结果显示,海马区神经元中出现红色荧光,表明MSC-EXO经尾静脉注射后,可通过血-脑屏障进入海马神经元。
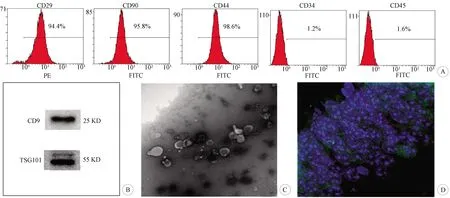
A: MSC表面标志物鉴定;B:免疫印迹检测MSC-EXO特异性表面标记CD9和TSG101;C: 电镜观察MSC-EXO(×43 000);D:MSC-EXO示踪(NeuN免疫荧光染色,×400)
2.2 3组小鼠海马及皮层的Aβ阳性面积 免疫组化染色后细胞核为蓝色,神经元内或胞外组织间隙中存在的棕黄色或棕褐色颗粒及斑块即为Aβ免疫染色阳性反应。结果显示,AD+saline组小鼠海马及皮层的Aβ阳性面积比对照组小鼠明显增多,AD+EXO组小鼠海马及皮层的Aβ阳性面积较AD+saline组小鼠减少(图2)。

A、B、C:免疫组化染色×40;D、E、F:免疫组化染色×100
2.3 3组小鼠海马DG区神经元数量比较 见图3。Nissl染色显示,对照组小鼠海马DG区神经元排列整齐均匀,胞内尼氏小体丰富,未见明显的神经元缺失。AD+saline组小鼠海马DG区的神经元数量减少,胞内尼氏小体大量脱失;DG区细胞层厚度与对照组相比显著减小(P<0.01)。AD+EXO组小鼠海马DG区的神经元数量较AD+saline组增多,DG区细胞层厚度与AD+saline组相比显著增厚(P<0.05)。
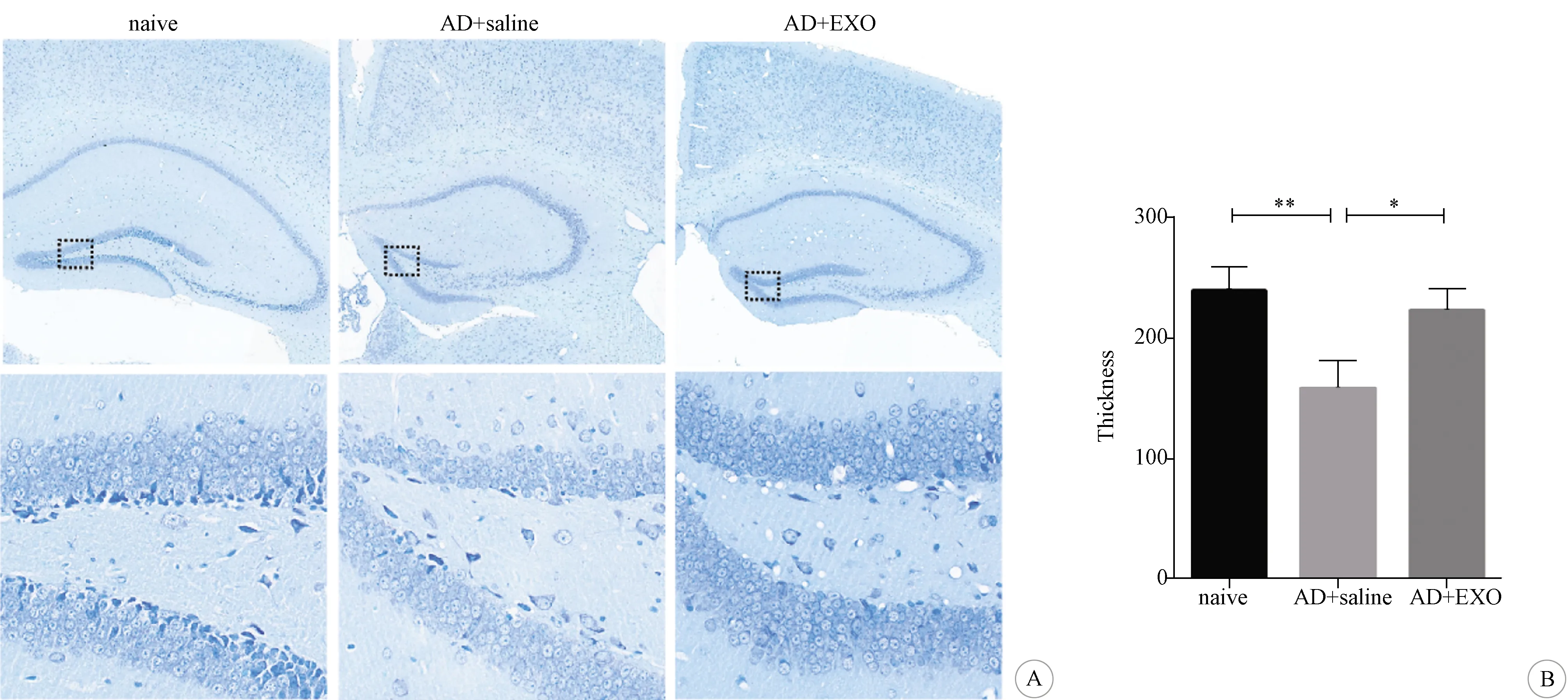
A:神经元的形态和数量(Nissl染色,×30,×400);B:细胞层厚度比较(*与AD+saline组比较P<0.05;**与对照组比较P<0.01)
2.4 3组小鼠海马神经元线粒体的改变 与对照组小鼠相比,AD+saline组小鼠海马神经元的线粒体出现肿胀、空泡化、嵴结构改变等现象;而AD+EXO组小鼠海马神经元的线粒体仅有轻微肿胀,嵴结构也近乎正常(图4)。

A、B、C:×8 200;D、E、F:×16 500) A:蛋白免疫印迹实验;B:蛋白表达水平半定量分析
2.5 3组小鼠海马Nrf2、Keap1及HO-1表达量比较 见图5。与对照组相比,AD+ saline组小鼠海马组织的Nrf2、HO-1蛋白表达量显著升高,而Keap1表达量显著降低(均P<0.05)。与AD+saline组相比,AD+EXO组小鼠海马组织的Nrf2、HO-1蛋白表达量显著降低,而Keap1表达量显著升高(均P<0.05)。
3 讨 论
AD是以认知障碍、记忆障碍、人格和行为改变为主要临床表现的中枢神经系统退行性疾病[7],已被世界卫生组织认定为全球公共卫生重点疾病。据报道,1990年至今中国AD的患病率约为3.4%,预计到2050年中国AD患者将达到2010年的2.52倍。目前AD的治疗以对症处理为主[8],但临床效果不佳,亟待研发新的治疗思路和手段。
随着再生医学的发展,间充质干细胞越来越受到重视,因其不仅有免疫原性低、成瘤性低的特性,还能发挥免疫调节、抗炎作用,且具有多向分化潜能,可以预见其在治疗AD方面有着良好的前景[9-13]。研究表明,间充质干细胞通过旁分泌的方式发挥作用[14],可分泌包括生长因子、集落刺激因子、神经源性营养因子在内的多种生物活性物质。EXO作为细胞分泌的囊泡状结构,不仅携带有丰富的生物活性物质等,无成瘤风险,更易保存和运输,在多种神经退行性疾病的治疗研究中已显现出很好的疗效[15,16],但在AD的治疗应用研究报道较少。
目前的研究报道,AD的发病原因除了比较公认的Aβ蛋白的生成和代谢紊乱假说之外,Tau蛋白异常磷酸化、氧化应激和自由基损伤、神经炎症、胆碱能假说等也在AD的发生发展中起到了十分重要的作用[17-18]。本研究主要针对AD的Aβ异常堆积的病理机制及氧化应激和自由基损伤假说进行探讨。
本研究采用免疫组化技术对APP/PS1小鼠脑内的Aβ沉淀进行检测,结果显示经MSC-EXO处理后AD小鼠脑内的Aβ沉积明显减少;表明MSC-EXO减少了Aβ蛋白在小鼠脑内的聚集。并采用尼氏染色对3组小鼠海马DG区神经元进行观察,显示与对照组相比,AD+saline组小鼠海马DG区神经元尼氏小体大量缺失,神经元密度明显降低,而AD+EXO组小鼠海马DG区神经元则缺失明显减少。这与本研究前期的实验结果,即MSCs-EXO可以靶向修复神经元并促进损伤脑组织中的神经元再生[19]相一致;最近的研究结果也证实了这一点[20]。这些研究结果表明MSCs-EXO可能在AD早期发挥延缓发病的作用。
在AD发病过程中,氧化应激作为发病中的关键一环,可导致神经元突触膜及树突棘的氧化损伤,影响突触可塑性,进而导致认知功能障碍。氧化损伤还会导致包括能量代谢在内的多种生理过程的酶活性的改变,造成神经元损伤。Nrf2/Keap1是重要的氧化应激信号调节通路,在维持体内的氧化物和过氧化物平衡方面发挥着十分重要的作用[21]。前期研究已证明,在癫痫小鼠模型中MSC-EXO可以改善炎症诱导的星形胶质细胞转化;此过程就涉及了Nrf2/Keap1通路[5]。本研究发现MSC-EXO可调控氧化应激相关Nrf2/Keap1信号通路;推测MSC-EXO可能是通过调控Nrf2/Keap1信号通路影响线粒体氧化应激,以达到改善神经元和认知功能的作用。
此外,氧化应激会损伤线粒体膜,造成线粒体的形态损伤和功能失调。线粒体级联损伤在AD发病过程中也发挥着十分重要的作用[22]。本研究通过电镜观察发现,AD+saline组小鼠海马神经元线粒体有明显损伤,而经EXO处理的AD+EXO组小鼠海马神经元线粒体损伤则明显减轻。这也进一步佐证了MSC-EXO可能通过改善氧化损伤发挥治疗作用。
总之,本研究结果表明MSC-EXO在修复AD的神经元损伤方面有良好的效果;因此,MSC-EXO未来可能为AD的临床治疗提供新的途径。

