肺炎克雷伯菌荚膜血清型、毒力基因和耐药性研究*
施 瑜,王 震,张汉园,李 莹
江苏省镇江市中西医结合医院检验科,江苏镇江 212000
肺炎克雷伯菌(KPN)是人和动物消化道及呼吸道的正常菌群,也是临床重要的机会致病菌。近3年来CHINET细菌耐药监测网的数据显示,KPN已经成为临床占比第二位的致病菌,对碳青霉烯类抗菌药物的耐药率在肠杆菌科中为最高,在25.00%以上[1-3]。根据KPN在琼脂平板上的黏液性质可分为经典型肺炎克雷伯菌(cKP)和高黏液肺炎克雷伯菌(HvKP),HvKP因其携带更多的毒力基因,具有比cKP更高的毒力,往往会引起较为严重的肺炎、败血症、眼内炎、坏死性筋膜炎和各脏器的脓肿等多部位的感染,严重者可导致死亡[4-5],呈现出高毒力、高致病的特性。KPN的毒力因子包括荚膜多糖抗原、铁摄入系统,菌毛的黏附作用等,包括有rmpA、magA、wcaG、fimH、kfu、Aero等毒力基因,这些毒力基因的表达都大大增加了KPN的侵袭力。本次研究重点对本院2019年1-9月临床分离的KPN的黏液表型、荚膜血清型、毒力基因和耐药性的相互关系进行分析,现报道如下。
1 资料与方法
1.1标本来源 收集本院2019年1-9月临床分离的非重复菌株。所有菌株均经珠海迪尔的DL-96Ⅱ细菌鉴定系统鉴定为KPN,菌种保存于-80 ℃超低温医用冰箱中。药敏结果参照美国临床和实验室标准化协会(CLSI)提供的(M100-S28)的标准来判读。
1.2仪器与试剂 3110型CO2恒温培养箱(美国Thermo公司),-80 ℃超低温医用冰箱(海尔公司)、高速低温离心机(湖南湘仪公司),金属干式加热仪(Labnet公司),mini 1610 PCR扩增仪(杭州朗基公司),EPS-600电泳仪(上海天能公司),紫外线凝胶成像仪(美国Bio-Rad公司);哥伦比亚血平板和中国蓝平板(上海科玛嘉公司),Premix TaqTM Version 2.0 plus dye、DL2000 DNA标志物、琼脂糖均购自日本Taraka公司,GoldviewⅠ型核酸染色剂(北京索莱宝科技有限公司)。
1.3方法
1.3.1菌株复苏、转种、分纯和鉴定 将保存于-80 ℃超低温冰箱的菌种复苏,转种于血平板,35 ℃培养18 h,挑取血平板上单个菌落进行纯培养,分纯后的菌落经DL-96Ⅱ细菌鉴定仪鉴定为KPN,并进行药敏试验。所有鉴定均严格按照《全国临床检验操作规程》第四版操作。
1.3.2质控菌株 大肠埃希菌(ATCC25922)、肺炎克雷伯菌(ATCC700603) 均购自江苏省临床检验中心。
1.3.3黏液丝试验(ST) 用接种环蘸取菌落向上挑起,重复两次。如黏液丝不能挑起或长度小于5 mm,判定为ST阴性;如黏液丝长度等于或超过5 mm则判定为ST阳性,即高黏液表型菌(HvKP)[6]。
1.3.4DNA模板制备 1.5 mL的EP管中加入400 μL SDS裂解液,用接种环挑取适量菌落于裂解液中混匀。置于金属干式加热仪中100 ℃加热20 min,12 000 r/min,4 ℃高速离心10 min,上清液即为DNA模板,置于-20 ℃备用。
1.3.5荚膜血清型和毒力基因检测 采用PCR法扩增K1、K2、K5、K20、K54、K57 6种主要荚膜血清型和rmpA、magA、wcaG、fimH、kfu、Aero 6种毒力基因。引物委托宝日医生物技术(北京)有限公司合成。PCR反应体系为50 μL:Premix Taq plus酶25 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板5 μL,ddH2O 18 μL。扩增条件:95 ℃,预变性3 min、94 ℃变性40 s、50~59 ℃退火40 s、72 ℃延伸60 s、经35个循环,最后72 ℃延伸10 min。引物序列参考文献[6-9]、退火温度和产物长度见表1。取 PCR扩增产物10 μL进行1.50%琼脂糖凝胶电泳120 V 80 min,在紫外凝胶成像仪上观察结果。

表1 KPN的荚膜血清型和毒力基因引物序列
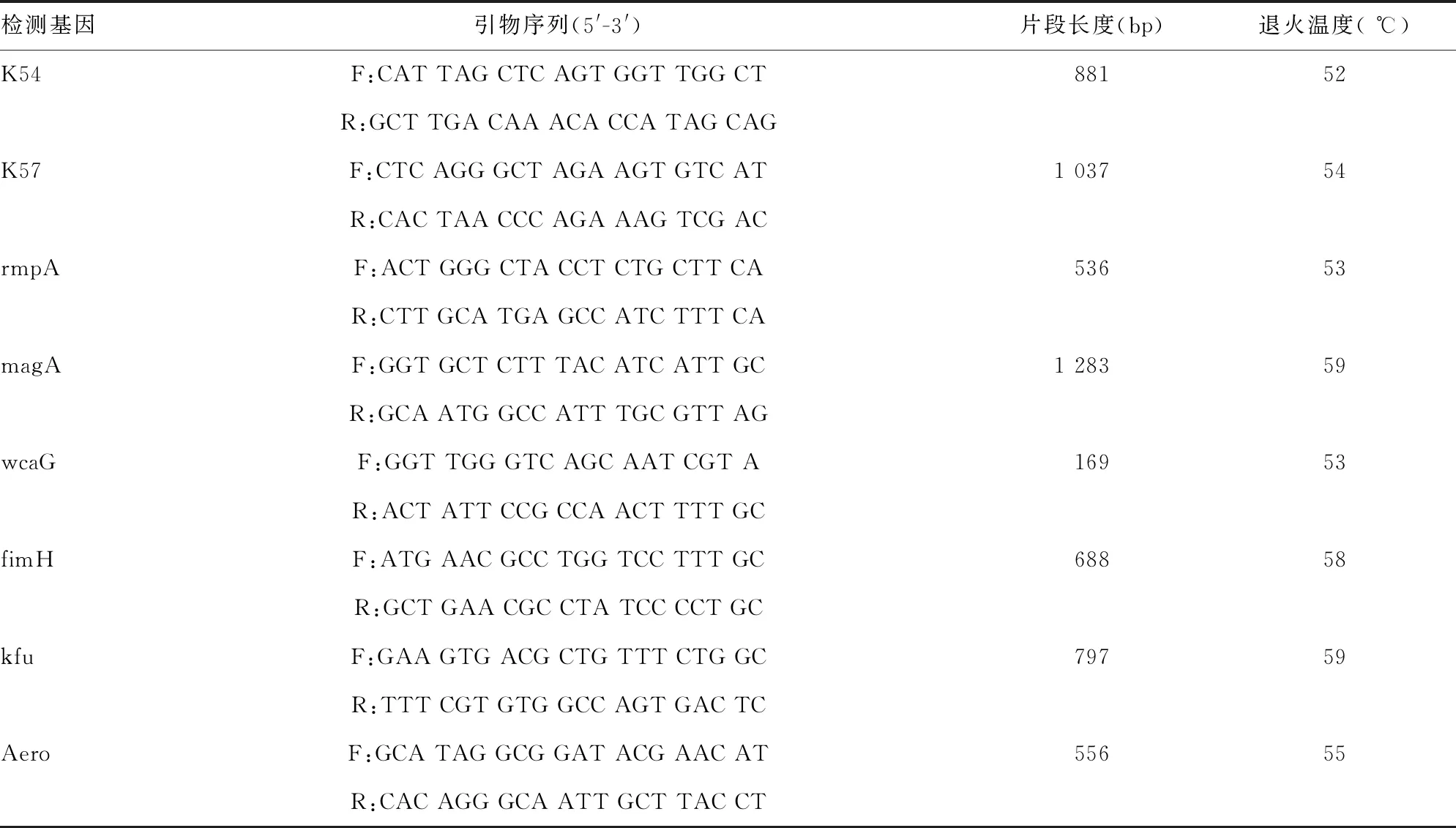
续表1 KPN的荚膜血清型和毒力基因引物序列
1.4统计学处理 采用Whonet 5.6软件对细菌耐药进行统计,采用SPSS25.0软件进行统计分析。计数资料采用菌株数和百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1荚膜血清型和毒力基因分布 93株KPN中6种荚膜血清型和6种毒力基因均有检出。其中K2型检出率最高,为21.50%(20/93),其次是K1型占13.98%(13/93),K57型占8.60%(8/93),K20型和K54型均占3.24%(3/93),K5型占1.08%(1/93)。毒力基因中fimH占比最高,为96.80%(90/93);其次是rmpA和Aero,均为64.52%(60/93);magA仅在K1型中检出;wcaG仅在K1和K54型中检出。同时检测到6种毒力基因的KPN菌株为13.98%(13/93),全部出现在K1型中;同时检出4种和3种毒力基因的分别为11.83%(11/93)和33.33%(31/93),主要见于K2、K20、K54、K57型中;rmpA+fimH+Aero的组合最为多见,占33.33%(31/93),有22株KPN只检出1种毒力基因fimH。有2株KPN未检测到上述6种荚膜血清型和6个毒力基因。见表2。PCR扩增产物见图1。
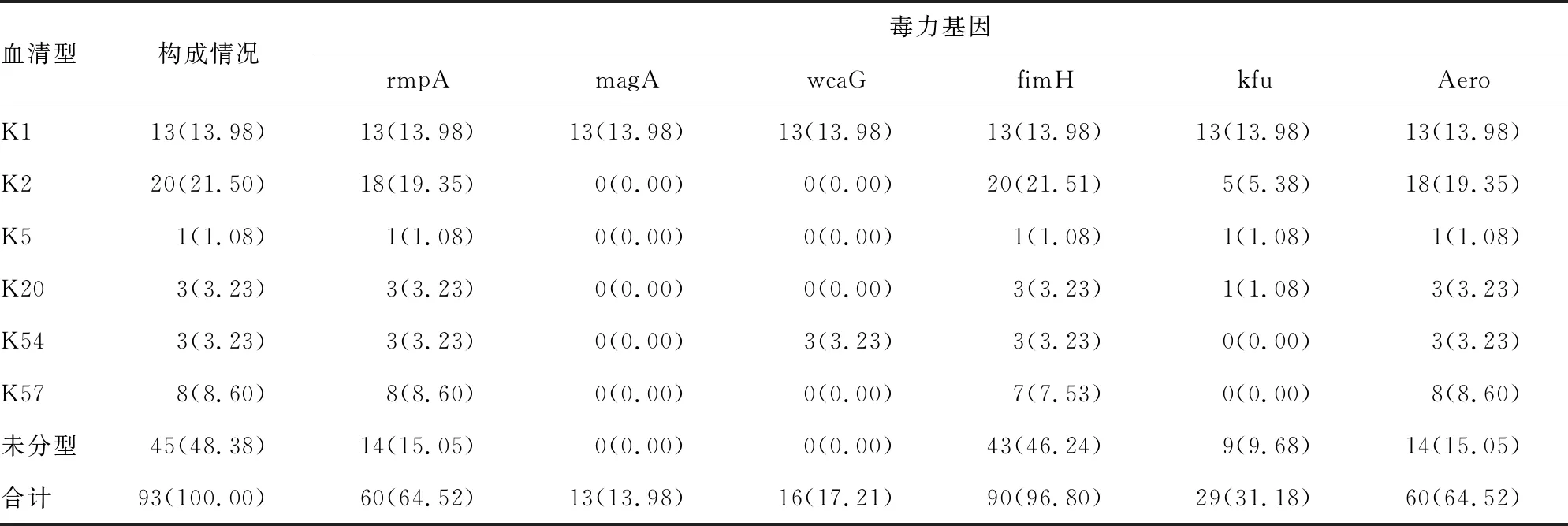
表2 93株KPN的荚膜血清型和毒力基因的检测结果[n(%)]
2.2不同黏液表型KPN的荚膜血清型与毒力基因比较 ST阳性株,即HvKP占51株(54.84%),6种荚膜血清型在HvKP中均有检出,为78.43%(40/51);ST阴性株(cKP)为42株(45.16%),除了K5和K57型,其余4种血清型在cKP中均有检出,为19.05%(8/42),主要荚膜血清型在不同黏液表型的检出率比较,差异均有统计学意义(P<0.05)。毒力基因rmpA、wcaG和Aero在HvKP的检出率明显高于cKP,差异有统计学意义(P<0.05),magA、fimH和kfu在二者的构成比比较,差异无统计学意义(P>0.05)。HvKP中同时携带3种以上毒力基因者为86.27%(44/51),高于cKP的26.19%(11/42),差异有统计学意义(P<0.05)。见表3。
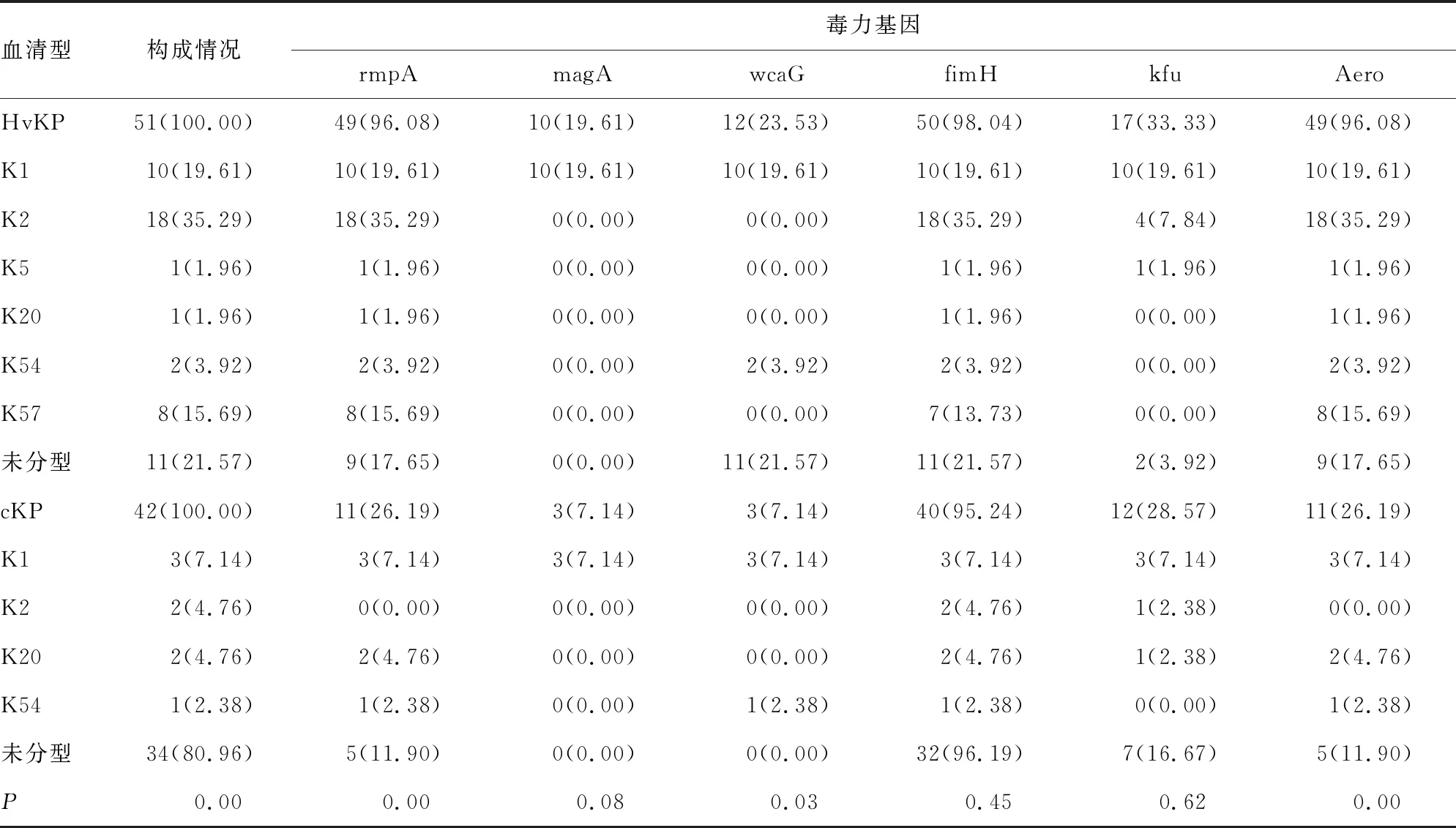
表3 不同黏液表型KPN的荚膜血清型与毒力基因检测结果[n(%)]
2.3不同黏液表型菌的药敏比较 除氨苄西林对KPN的耐药率为100.00%外,HvKP对常见抗菌药物的耐药率均低于cKP,没有发现对亚胺培南、美罗培南、派拉西林/他唑巴坦、庆大霉素和阿米卡星耐药的菌株。除亚胺培南和美罗培南外,其他12种常见抗菌药物在两者之间差异有统计学意义(P<0.05)。见表4。

注:M为DL2000 DNA标志物;1~6泳道分别为K1、K2、K5、K20、K54、K57血清型,片段长度分别是1 283、641、280、741、881、1 037 bp;7~12泳道分别是毒力基因wcaG、fimH、kfu、magA、rmpA和Aero,片段长度分别是169、688、797、1 283、536、556 bp。
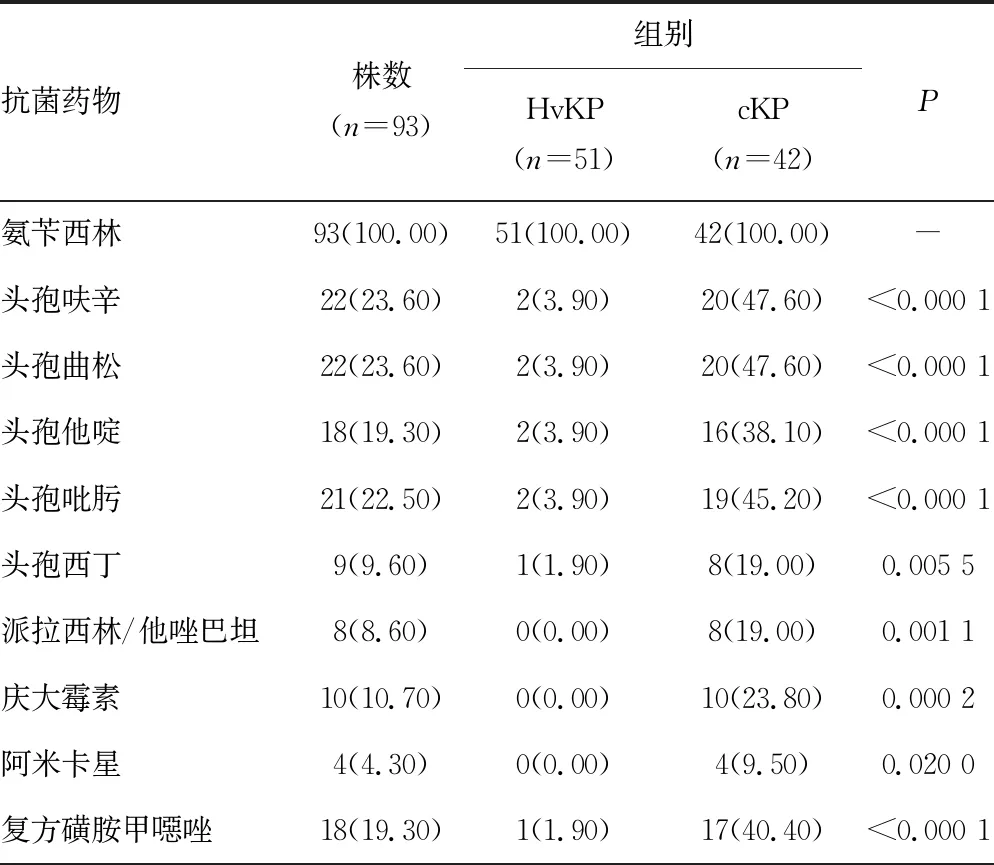
表4 不同黏液表型KPN对抗菌药物的耐药情况[n(%)]
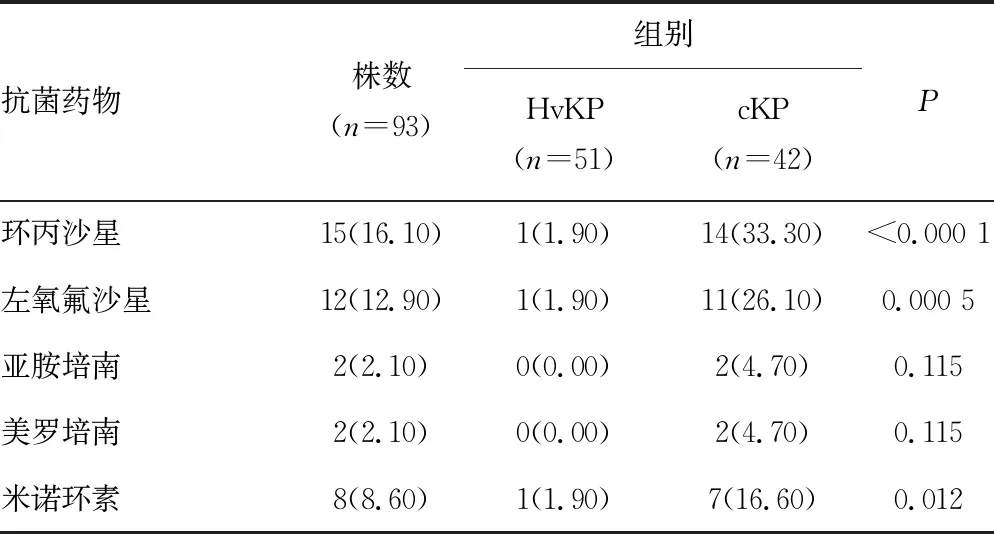
续表4 不同黏液表型KPN对抗菌药物的耐药情况[n(%)]
2.4多重耐药菌与黏液表型、荚膜血清型和毒力基因的相关性比较 93株KPN中,检出20株多重耐药菌,其中产超广谱β内酰胺酶(ESBLS)的KPN 18株(19.35%),耐碳青霉烯类抗菌药物的KPN 2株(2.15%),多重耐药菌在黏液表型、主要荚膜血清型、rmpA、magA、wcaG、Aero的检出率均明显高于耐药菌,差异有统计学意义(P<0.05)。见表5。
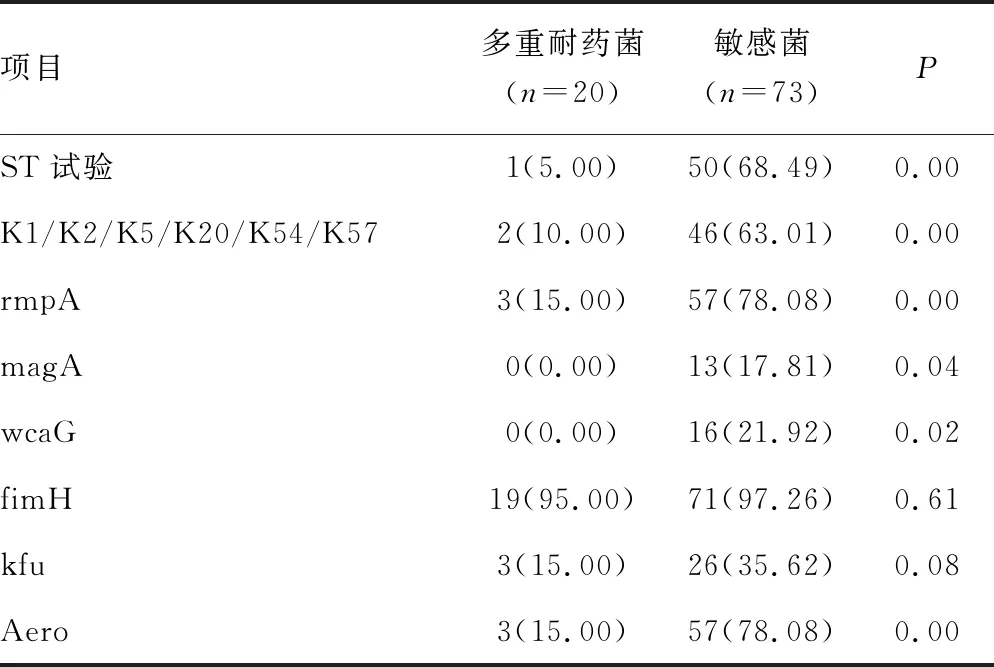
表5 耐药菌与敏感菌的荚膜血清型和毒力基因比较[n(%)]
3 讨 论
自从20世纪80年代台湾地区报道了可引起多处非传统部位感染的HvKP以来[10],越来越多的研究发现HvKP相较cKP而言,其细菌的黏液表型特征、致病特点都有很大的差异[11]。其主要特征是可引起健康人群、没有基础疾病的亚太人群的感染,同时具有从原始感染部位转移至其他组织器官,从而导致远端、不常见部位如眼和软组织等处的感染,这在非免疫缺陷患者革兰阴性杆菌的感染中非常罕见[12]。本次研究中,HvKP占54.85%,cKP占45.16%,本次分离的KPN以高黏液表型为主。
荚膜多糖(CPS)被认为是KPN最重要的毒力因子之一,CPS亲水并带有负电荷,与同样带有负电荷的吞噬细胞之间存在静电相斥现象,可以阻滞和抵抗宿主吞噬细胞的吞噬和消化作用。根据CPS抗原的不同,可将KPN分为82个血清型[13],其中K1、K2、K5、K20、K54、K57型荚膜血清型与HvKP密切相关,是最常见的、毒力最强的型别,具有更强的致病性[14]。本次研究中6种荚膜血清型都有检出,其中以K2型为主(21.50%),其次是K1型(13.98%)和K57型(8.60%)。K1/K2/K57型在HvKP的检出率(70.59%)明显高于cKP(11.90%),K57型只出现在HvKP中,与上海地区相似[15]。虽然K1/K2型主要见于高黏液表型中,但是在非黏液表型也有少量检出,所以仅仅通过ST试验可能会漏检高产毒菌株,检测人员需要通过PCR检测荚膜血清型和毒力基因才能更好地筛选出产毒菌株。
6种毒力基因在13株K1型菌中全部都有检出;其他5个型别同时携带3~4种毒力基因者(82.86%)明显高于未分型者(30.95%);HvKP组中同时携带3种以上毒力基因者(86.27%)明显高于cKP组(30.95%)。此次研究证实了高毒力血清型携带有更多的毒力基因;K1型毒力相较其他荚膜血清型而言,毒力更强。携带有多种毒力基因的K1型与侵袭性综合征(尤其在肝脓肿)密切相关[10],实验室需要加强对K1型KPN的监控。
本次研究发现,fimH在6种毒力基因中的检出率最高,为 96.80%;其次是rmpA和Aero,均为64.52%,magA检出率最低。fimH主要编码Ⅰ型菌毛(TIP)蛋白[16],fimH主要介导细菌的TIP与上皮细胞的甘露糖受体结合,使KPN黏附于宿主细胞上,同时还介导生成生物膜[17],因为不参与黏液的形成,所以在HvKP株(98.04%)和cKP株(96.24%)的分布没有差异,与相关报道一致[18]。rmpA作为黏液表型调节基因,属于转录调控因子家族,在多种荚膜血清型的合成中起到正向调控作用[15],形成高黏液表型,rmpA基因存在于219×103大质粒上,CHEN等[19]发现该毒力质粒上还同时表达包括Aero在内的多种毒力基因,HvkP株含有此毒力质粒,可协同调控HvKP毒力的形成,增加KPN的侵袭力;Aero编码的是铁载体中最为重要的气杆菌素,可与宿主转铁蛋白中Fe3+结合形成螯合物,通过细胞膜上特定的铁蛋白受体进入细菌体内,从而干扰宿主体内的铁代谢,此外铁载体还可以催化产生自由基,造成宿主组织细胞的损伤[20]。本次研究发现,所有rmpA阳性的菌株Aero也同时阳性,在HvKP株的检出率(96.08%)明显高于在cKP中的检出率(26.19%),在6种血清型的检出率(95.83%)明显高于非分型组(31.11%),提示rmpA和Aero是KPN的主要毒力基因。magA是黏液相关基因,仅存在于K1型的质粒上,编码K1型特异性的Wzy聚合酶[21],是K1型荚膜生成的主要调控因子;wcaG编码的基因产物是CPS中的岩藻糖,ZHENG等[22]发现wcaG不仅参与CPS的合成,还是KPN形成生物膜的一个独立危险因素。本次研究发现,magA基因仅存在于K1型菌,证实了K1型和magA具有相关性,而wcaG基因只存在于K1和K54型中,与报道一致[23]。kfu编码磷酸转移酶系统的一些成分,有助于KPN摄入Fe3+,增强了KPN毒力[24]。
细菌耐药方面,除了氨苄西林、亚胺培南和美罗培南的耐药率在两组KPN无差异外,HvKP的耐药率明显低于cKP。除了对氨苄西林的耐药率为100.00%外,HvKP对其他抗菌药物的耐药率均较低,仅有1株HvKP产ESBLS,这株产ESBLS的HvKP为K2型,毒力基因的模式是rmpA+fimH+Aero。cKP中产ESBLS的检出率为40.47%,只有1株为K20型,其余为未分型血清型,大多数只检出1种毒力基因fimH;cKP中检出2株CRE,均为未分型血清型,毒力基因的模式均为fimH+kfu。刘盼盼[25]研究发现,经亚胺培南体外诱导HvKP产生耐药后,其高黏液表型消失、rmpA等毒力基因丢失、小鼠致死率下降、大多数毒力基因表达下调。本次研究中,多重耐药菌的荚膜血清型的检出率明显低于敏感菌,除了fimH和kfu,其余4种毒力基因均存在明显差异,究其原因,可能是KPN在获得耐药基因的同时丢失了质粒上的毒力基因,导致毒力基因的表达发生改变,从而引起表型和毒力的变异。
综上所述,本次研究的KPN以HvKP为主,K1、 K2和K57型是本院常见的荚膜血清型,K1型所携带的毒力基因最多;rmpA和Aero是KPN的主要毒力基因;HvKP携带的荚膜血清型和毒力基因均明显高于cKP,但是耐药率明显低于cKP。本次研究还发现了1株产ESBLS的高产毒菌,这种高产毒多重耐药菌一旦侵入机体将会为临床的治疗带来极大地挑战,因此必须引起高度重视,应深入对此类菌株研究。

