脂联素抑制甲基环糊精包被的胆固醇诱导的人血管平滑肌细胞泡沫化*
薛贻敏, 孟 春, 曾丽娟, 黄廷烽, 吴 畏, 林风辉△
(1福建医科大学省立临床医学院,福建省立医院重症医学四科,福建福州350001;2福州大学生物科学与工程学院,福建福州350108)
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的首要原因,后期斑块区域破裂形成的血栓可导致急性供血障碍甚至死亡。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)源性泡沫细胞大量存在于AS 斑块病变区域内,是主要的泡沫细胞之一,它们通过自分泌细胞因子并促进自身的增殖、迁移和炎症反应,在AS 斑块重塑及失稳过程中发挥重要作用[1-2]。脂联素(adiponectin,APN)是脂肪细胞分泌的一种内源性蛋白质,具有调节脂质代谢、降低炎症反应、减轻胰岛素抵抗、稳定血管斑块等多种生物学效应,在AS 相关的多种心血管疾病中起保护作用[3],但其具体作用机制仍未被完全阐明。本研究用甲基环糊精包被的胆固醇(cholesterol:methyl-βcyclodextrin,Chol:MβCD)诱导体外培养的 VSMCs源性泡沫细胞,并基于沉默信息调节因子1(silent information regulator 1,SIRT1)/过氧化物酶增殖物激活受体γ 辅激活因子1α(peroxisomal proliferator-activated receptor γ coactivator-1α,PGC-1α)通路探讨APN 对 VSMCs 泡沫化的影响,寻找 APN 抗 AS 的潜在机制。
材料和方法
1 主要试剂
人主动脉平滑肌细胞株(CRL-1999)购自ATCC。人重组 APN、Chol:MβCD 及油红 O 染料均购自 Sigma;胆固醇检测试剂盒及荧光标记胆固醇外流分析试剂盒均购自BioVision;胎牛血清购自Gibco。硫酸链霉素和青霉素均购自华北制药股份公司;DMEM低糖培养液及TRIzol 试剂购自Invitrogen;BCA 蛋白浓度测验盒购自上海碧云天生物工程有限公司;逆转录酶试剂盒购自TaKaRa;RT-qPCR 试剂盒购自Roche;PCR 引物由上海生工生物技术有限公司设计合成;兔抗 SIRT1、PGC-1α 和 GAPDH 抗体及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG均购自Cell Signaling Technology。
2 主要方法
2.1 VSMCs 的培养 用DMEM 低糖培养液(加入10%胎牛血清、1%青霉素和1%链霉素)培养人主动脉平滑肌细胞,于恒温细胞培养箱(37 ℃、5%CO2)内培养。每2~3 d更换一次培养液,实验选取对数期增殖旺盛的细胞。
2.2 实验分组 以每孔 1×105接种 VSMCs 至 24 孔板上,细胞贴壁后更换为无血清培养液培养24 h。将细胞分为5 组:对照组(正常培养)、泡沫细胞组(加入含有100 mg/L Chol:MβCD 的DMEM 低糖培养液,继续刺激 24 h 构建 VSMCs 源性泡沫细胞模型[4])及低、中、高剂量APN 组(在泡沫细胞构建成功后分别加入2.5、5 和 10 mg/L APN 继续干预24 h,其余两组给予同等体积的 PBS 干预 24 h[5])。每组设 3 个复孔。
2.3 油红O 染色 油红O 染料0.7 g溶于200 mL 异丙醇中制成油红O 储存液,稀释2/3 后配成工作液。培养结束后,倒去培养液,PBS 冲洗3 次,4%多聚甲醛固定30 min,室温放置10 min 后加入油红O 工作液,避光染色30 min,显微镜下观察细胞形态,对红染颗粒计数,计算单个细胞内平均脂质含量。
2.4 酶荧光化学法检测细胞内胆固醇含量 离心管收集细胞,PBS 洗脱后加入 500 μL 正己烷/异丙醇混合液,超声破碎细胞,以800×g离心10 min,收集上清液,按照胆固醇测定试剂盒说明书,测定胞内总胆固醇(total cholesterol,TC)和游离胆固醇(free cholesterol,FC),以mg/(g protein)表示。胆固醇酯(cholesteryl ester,CE)=TC-FC。CE/TC×100%>50%则认为符合泡沫细胞改变。
2.5 胆固醇流出率的检测 按照荧光检测试剂盒说明书检测细胞胆固醇流出率,计算方法:胆固醇流出率(%)=细胞上清液荧光测值/(细胞上清液荧光测值+细胞裂解液荧光测值)×100%。
2.6 RT-qPCR 检测 各 组细 胞 SIRT1 和 PGC-1α 的mRNA 表达 各组细胞用 PBS 清洗 2 次,TRIzol 试剂提取总RNA 后,按逆转录酶试剂盒及RT-qPCR 试剂盒说明书进行RT-qPCR 检测。反应参数为:95.0 ℃5 min预变性;95.0 ℃ 15 s变性,60 ℃ 30s退火,循环40 次。各样本重复3 次,以β-肌动蛋白(actin)为内参照,各基因的相对表达量均采用2-ΔΔCt法表示。所用引物序列详见表1。
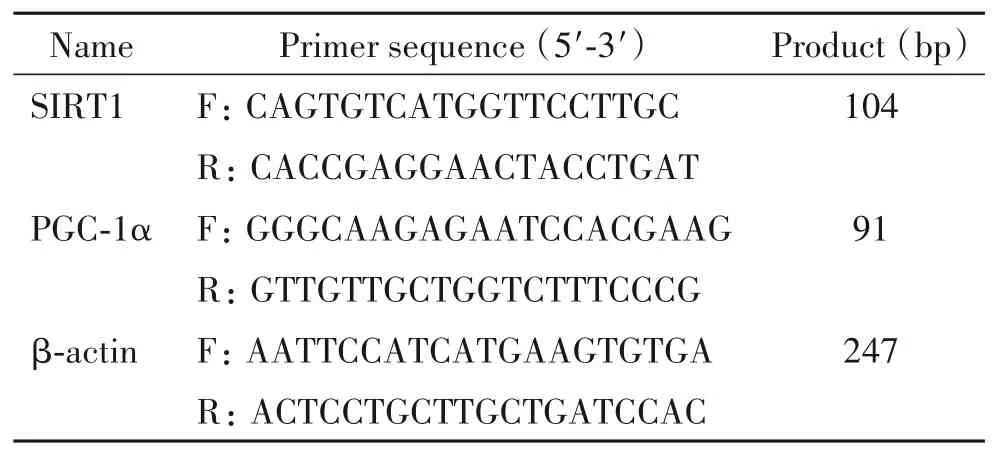
表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
2.7 Western blot 检测各 组 细胞 SIRT1 和 PGC-1α的蛋白表达 提取各组细胞总蛋白并进行蛋白定量(BCA 法),取等量蛋白(30 μg)行SDS-PAGE 分离后转移至聚偏氟乙烯膜上,非特异性封闭2 h,加入Ⅰ抗(兔抗 SIRT1 和 PGC-1α 抗体 1∶500 稀释,兔抗GAPDH 抗体 1∶1 000 稀释),4 ℃孵育过夜,HRP 标记的山羊抗兔Ⅱ抗(1∶2 000 稀释)室温孵育1 h 后ECL 显色,凝胶图形分析系统Image Lab 3.0 采集扫描,以 SIRT1、PGC-1α 与 GAPDH 条带灰度值的比值表示其相对表达量。
3 统计学处理
使用SPSS 20.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 各组细胞油红O染色结果
对照组的VSMCs呈梭形,胞内几乎无红色颗粒,生长过程呈典型峰谷状;泡沫细胞组VSMCs 形态增大变圆,胞质大量红色脂滴聚集,胞内脂质含量显著升高(P<0.05),呈泡沫样改变;与泡沫细胞组比较,低、中和高剂量APN 干预组VSMCs 胞内脂质含量均显著下降(P<0.05),泡沫细胞减少;随着APN 浓度的增加,细胞内红色颗粒呈下降趋势,见图1。
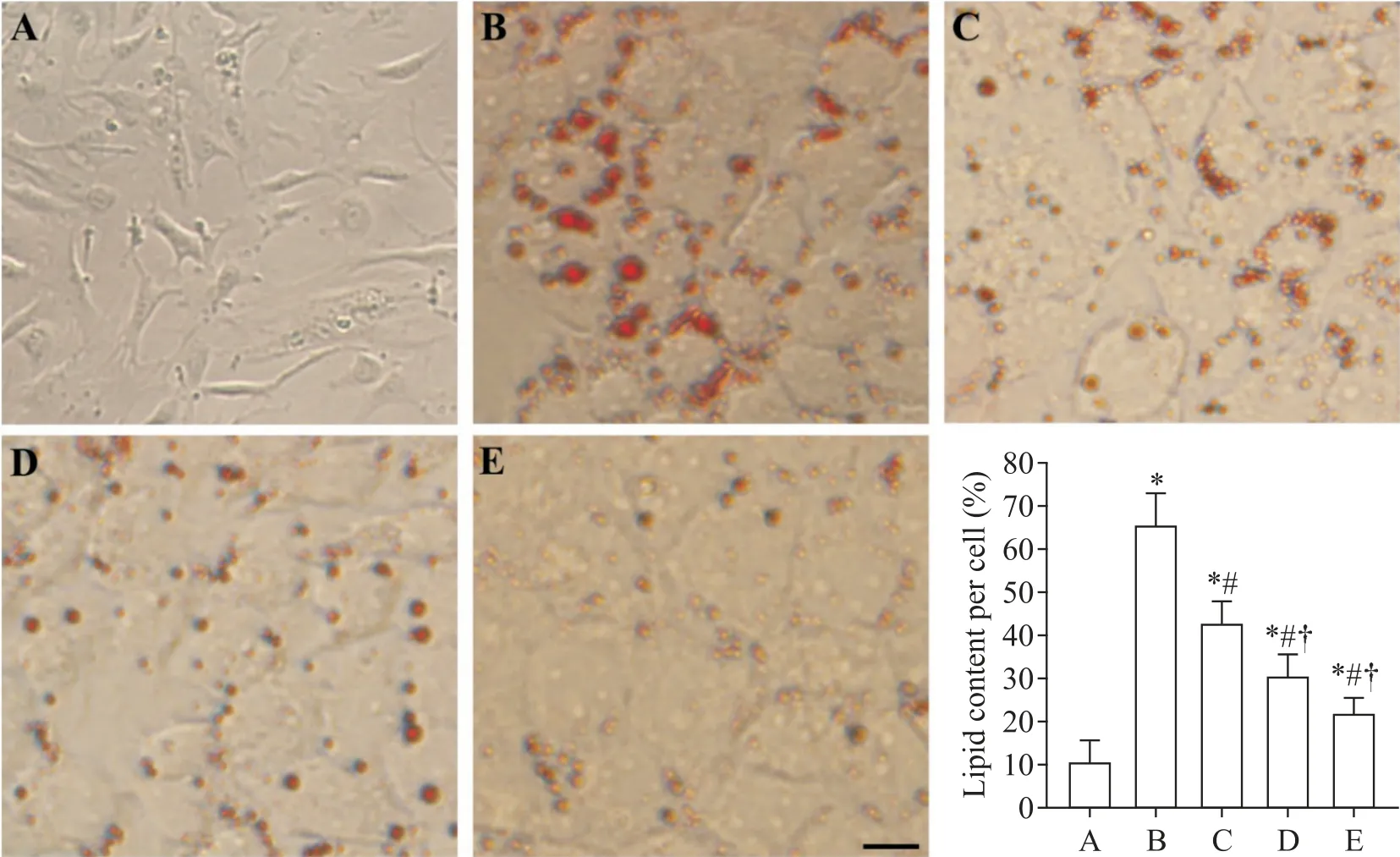
Figure 1.Results of oil red O staining in each group(scale bar=50 μm).A:control group;B:foam cell group;C:low-dose(2.5 mg/L)APN group;D:middle-dose(5 mg/L)APN group;E:high-dose(10 mg/L)APN group.Mean±SD. n=3.*P<0.05 vs A;#P<0.05 vs B;†P<0.05 vs C.图1 各组细胞油红O染色结果
2 各组细胞胞内胆固醇检测结果
与对照组相比,泡沫细胞组胞内TC、FC 和CE 的含量及CE/TC 值均显著升高(P<0.05);各APN 干预组中,胞内TC 和CE 含量及CE/TC 值均较泡沫细胞组显著下降(P<0.05);高剂量APN 降低CE 和CE/TC的效果优于中、低剂量APN(P<0.05),见表2。
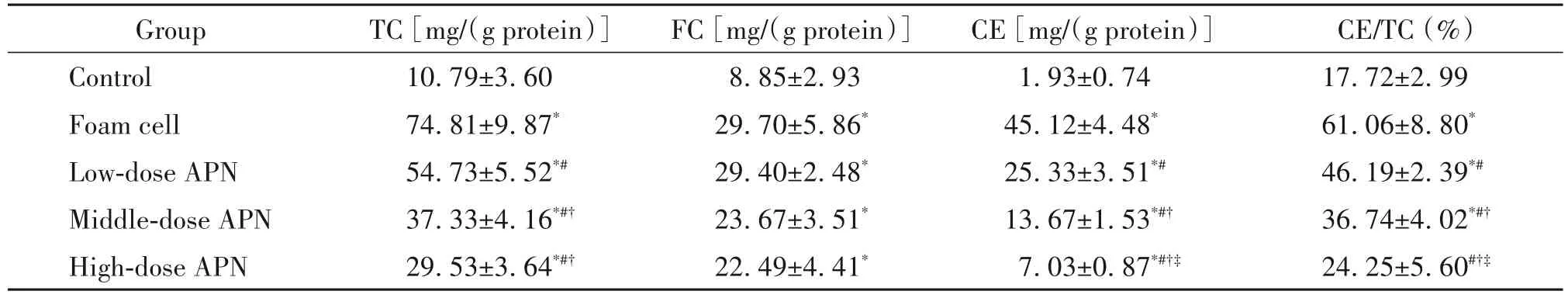
表2 各组细胞胞内胆固醇检测结果检测Table 2.The levels of intracellular cholesterol in each group(Mean±SD. n=3)
3 各组细胞胆固醇流出率检测结果
与对照组相比,泡沫细胞组细胞胆固醇流出率显著升高(P<0.05);各剂量APN 干预后,细胞胆固醇流出率均较泡沫细胞组显著升高(P<0.05);不同剂量组间比较结果显示,中、高剂量APN 组细胞胆固醇流出率显著高于低剂量 APN 组(P<0.05),见图2。
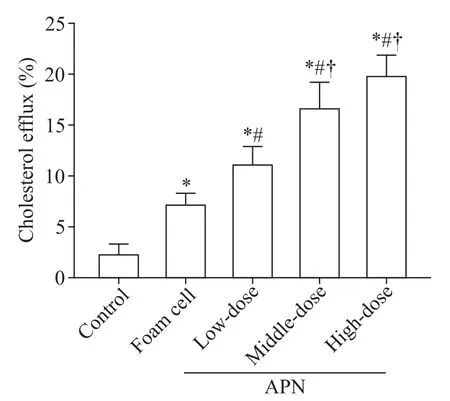
Figure 2.Cholesterol efflux in each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs foam cell group;†P<0.05 vs low-dose APN group.图2 各组细胞胆固醇流出率检测结果
4 各组细胞SIRT1和PGC-1α的mRNA表达
与对照组比较,泡沫细胞组SIRT1 和PGC-1α 的mRNA 相对表达量均显著下降(P<0.05);各APN 干预组中,SIRT1 和 PGC-1α 的 mRNA 相对表达量均较泡沫细胞组显著升高(P<0.05);中、高剂量APN 组SIRT1和PGC-1α的mRNA相对表达量显著高于低剂量APN组(P<0.05),见图3。
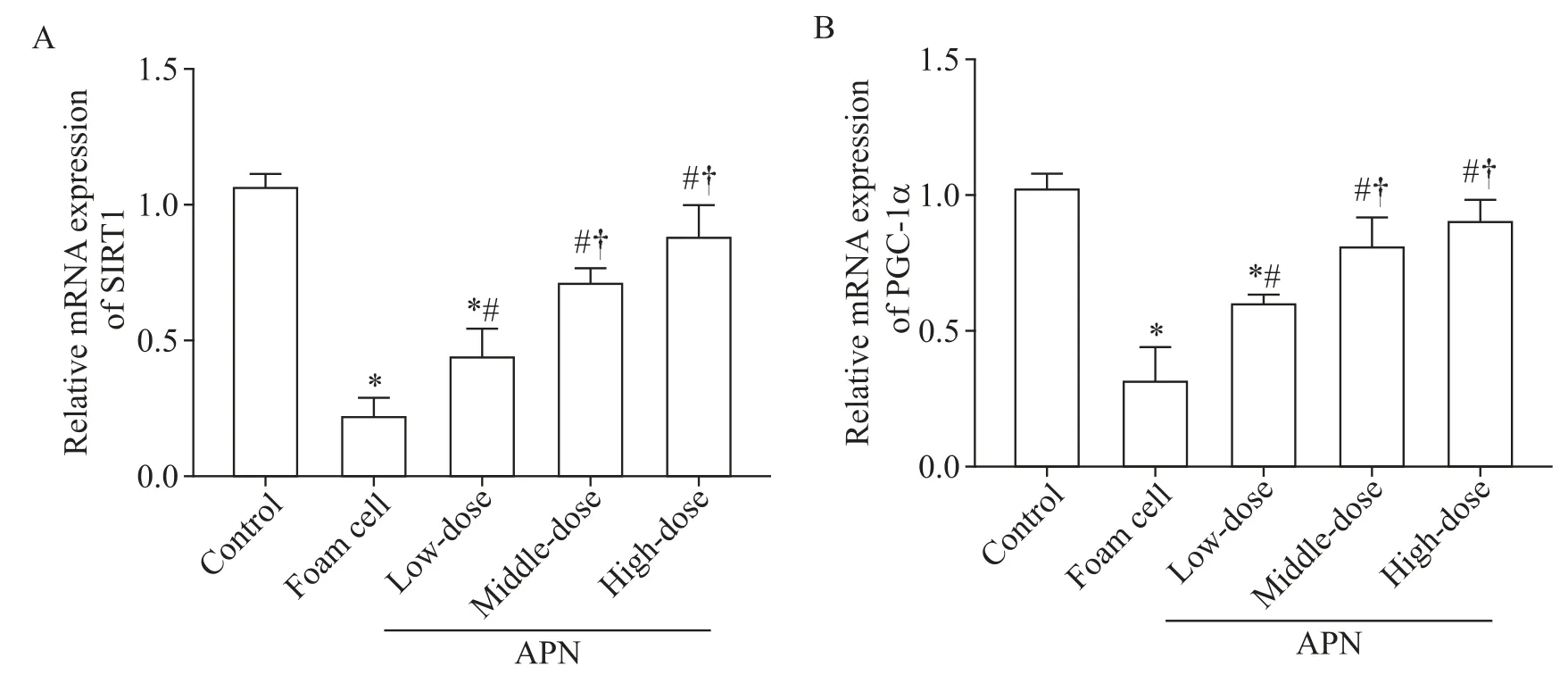
Figure 3.The mRNA levels of SIRT1(A)and PGC-1α(B)in each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs foam cell group;†P<0.05 vs low-dose APN group图3 各组细胞SIRT1和PGC-1α的mRNA表达
5 各组细胞SIRT1和PGC-1α的蛋白表达
与对照组比较,泡沫细胞组SIRT1 和PGC-1α 蛋白的相对表达量均显著下降(P<0.05);各APN 干预组中,SIRT1 和PGC-1α 蛋白的相对表达量均较泡沫细胞组显著升高(P<0.05);中、高剂量APN 组SIRT1和PGC-1α 蛋白的相对表达量显著高于低剂量APN组(P<0.05),见图4。
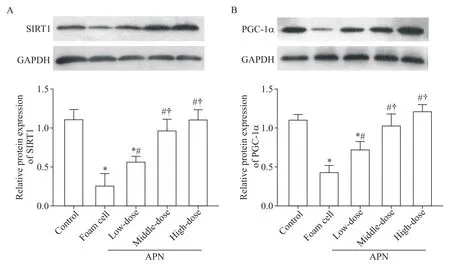
Figure 4.The protein levels of SIRT1(A)and PGC-1α(B)in each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs foam cell group;†P<0.05 vs low-dose APN group.图4 各组细胞SIRT1和PGC-1α蛋白的表达
讨 论
VSMCs摄取大量脂质成分使得细胞外观呈现泡沫样改变是AS 病变过程的中心环节。体外实验中胆固醇因不溶于水难以被细胞直接吸收,β-环糊精具有外侧亲水、内侧疏水的环状立体结构,性质稳定,可吸附胆固醇而形成紧密的包合物。Chol:MβCD 作为胆固醇和β-环糊精的包合物,可顺利进入细胞中并释放出胆固醇,造成胞内胆固醇蓄积,从而建立稳定的泡沫细胞模型[6]。故本研究利用Chol:MβCD 刺激VSMCs,诱导VSMCs 源性泡沫细胞模型,模拟人体内AS 病变过程中胆固醇沉积和泡沫细胞的形成。目前认为,在中晚期AS 斑块病变中,绝大多数泡沫细胞为VSMCs 源性,抑制VSMCs 泡沫化有助于稳定斑块、延缓AS 进程。APN 是维持血管稳态的重要因子,可通过与其受体结合,抑制脂质合成,促进脂肪酸氧化,从而调控脂质平衡[7]。本研究使用不同浓度APN 干预VSMCs 源性泡沫细胞,结果显示APN 可呈浓度依赖性抑制VSMCs 的脂质沉积,促进细胞胆固醇流出,提示APN 可有效抑制Chol:MβCD诱导的人VSMCs泡沫化。
胆固醇在细胞内以FC 及CE 两种形式存在,二者存在着动态平衡,酰基辅酶A:胆固醇酰基转移酶是调控胞内胆固醇代谢平衡的关键酶,可将多余的FC 转化为CE 并储存于细胞内的脂滴中,从而避免过量的FC 对细胞造成损伤,减少CE 在胞内的沉积是抑制泡沫细胞形成的关键[8]。本研究中APN 可显著降低细胞内TC,随着剂量的增加对胞内CE 的抑制更加显著,从而降低CE/TC,促进细胞胆固醇流出,说明APN 主要通过抑制CE 沉积抑制细胞泡沫化。此外,Ebrahimi-Mamaeghani 等[9]的研究证实,APN 可通过抑制血小板聚集,减少血小板活化,发挥一定的抗血栓作用;Wang 等[10]的研究显示,抑制APN 的表达可使内皮依赖性平滑肌松弛障碍加重,从而进一步损害血管内皮细胞。以上研究说明APN可通过多种途径发挥抗AS作用。
SIRT1 是sirtuin 家族成员之一,可通过对底物的去乙酰化作用参与细胞的分化、增殖、凋亡和代谢等过程。已有研究表明,VSMCs中SIRT1的表达减少可促进AS中斑块纤维帽的破裂,SIRT1还可通过抑制核因子κB信号通路而抑制VSMCs泡沫化[11-12]。PGC-1α是SIRT1的靶分子,SIRT1对PGC-1α的去乙酰化能显著提高PGC-1α 的活性;作为众多转录因子的共激活因子,PGC-1α 能通过抑制活性氧自由基介导的VSMCs迁移及增殖,减少泡沫细胞的形成[13-14]。本研究中VSMCs 源性泡沫细胞的形成伴随着SIRT1 和PGC-1α 的表达降低,提示 SIRT1/PGC-1α 通路参与VSMCs的泡沫化进程,这与上述文献研究一致。近年研究显示APN 可通过干扰Toll 样受体4 介导的炎症反应抑制 VSMCs 泡沫化[15],另外蛋白激酶 C/活化蛋白激酶C受体1也可能是APN 抑制VSMCs泡沫化的作用通路[5],然而 APN 是否通过调控 SIRT1/PGC-1α通路影响VSMCs泡沫化还未见报道。本研究结果显示,APN 可以逆转VSMCs 源性泡沫细胞中SIRT1 和PGC-1α的低表达,促进细胞胆固醇流出,减轻胞内脂质沉积,说明APN 可能通过SIRT1/PGC-1α 通路抑制VSMCs泡沫化。既往在成肌细胞中,有研究证实APN可通过诱导胞外Ca2+内流,激活腺苷酸活化蛋白激酶信号来调控SIRT1/PGC-1α通路[16]。本研究中APN对SIRT1/PGC-1α通路的调控机制仍有待进一步阐明。
综上所述,本研究结果表明APN 在体外可呈浓度依赖性抑制Chol:MβCD 诱导的人VSMCs 泡沫化,并可能通过调控SIRT1/PGC-1α 通路来实现,为进一步探讨APN的抗AS作用奠定了实验基础。

