龙眼miRNA合成途径相关基因的鉴定及表达分析
霍雯 陈晓慧 徐小萍 申序 李晓斐 赖钟雄


摘 要:為了解龙眼miRNA合成途径相关基因的生物学功能,本研究依据龙眼第3代基因组数据对龙眼miRNA合成途径相关基因进行了鉴定和生物信息学分析,并利用龙眼转录组对其在体胚发生早期定量表达进行分析。研究结果如下:共鉴定到12条龙眼miRNA合成途径相关基因,分别是DlDDL1、DlDDL2、DlDDL3、DlDCL1、DlSE、DlHYL1a、DlHYL1b、DlHYL1c、DlCBP20、DlCBP80、DlHEN1、DlHASTY。这些基因编码的氨基酸数目400~1000 aa,蛋白分子质量23.92~220.25 kDa;大部分蛋白均为酸性蛋白,所有蛋白均为不稳定蛋白,除DlHASTY外,其余蛋白均为亲水性蛋白;基因结构分析表明,各成员内含子数目差别较大,为2~23个;所有成员均含有保守结构域,数目差别较大,为1~7个;启动子顺式原件分析显示,基因启动子区域均含有大量光反应元件及激素响应元件;蛋白互作预测分析显示龙眼miRNA合成途径相关基因具有较强的互作关系。对龙眼体胚发生早期过程中表达分析显示,各基因在EC阶段具有较高的转录水平。本研究表明:龙眼miRNA合成途径相关基因可能参与龙眼体胚发育早期进程且在EC阶段发挥重要作用,同时响应多种激素应答及非生物胁迫,推测其在生物学功能方面具有多样性和差异性。
关键词:龙眼;miRNA合成途径相关基因;生物信息学分析;qPCR分析
中图分类号:S667.2 文献标识码:A
Identification and Expression Analysis of Genes Related to Longan miRNA Synthesis
HUO Wen, CHEN Xiaohui, XU Xiaoping, SHEN Xu, LI Xiaofei, LAI Zhongxiong
Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: In order to understand the biological functions of genes related to the longan miRNA synthesis pathway, we identified and analyzed the miRNA synthesis pathway-related genes in the third-generation genomic data of longan. And longan transcriptomes in the early stage of somatic embryogenesis (SE) was used for miRNA synthesis pathway-related genes expression analysis. A total of 12 genes related to longan miRNA synthesis pathway were identified, namely DlDDL1, DlDDL2, DlDDL3, DlDCL1, DlSE, DlHYL1a, DlHYL1b, DlHYL1c, DlCBP20, DlCBP80, DlHEN1, DlHASTY. The number of amino acids encoded by these genes was mostly between 400-1000 aa, and the molecular weight of the protein was 23.92-220.25 kDa. Most proteins were acidic proteins, all the proteins were unstable proteins. Except DlHASTY which is hydrophobic protein, the others were hydrophilic proteins. Gene structure analysis showed that the number of introns of each member varied greatly from 2 to 23. All members contained conservative domains, and the number difference varied from 1 to 7. Analysis of cis-acting elements in the promoter regions of gens related to miRNA synthesis pathway showed that a large number of light-responsive elements and hormone-responsive elements were presented in the promoter region of these genes. Protein interaction prediction analysis showed that the longan miRNA synthesis pathway-related genes had strong interaction relationship. Analysis of expression during the early stage of SE in longan showed that each gene had a high level of transcription at the EC stage. This study indicates that the genes related to the longan miRNA synthesis pathway may participate in the early development of longan SE development and play an important role in the EC stage, as well as responding to multiple hormone responses and abiotic stresses. Moreover, it is suggested that miRNA synthesis pathway-related genes might have diversity and differences in biological functions.
Keywords: longan; miRNA synthesis pathway-related genes; bioinformatics analysis; qPCR analysis
DOI: 10.3969/j.issn.1000-2561.2021.06.001
MicroRNA(miRNA)是一类长度约为21~24 nt的内源性非编码的单链负调控因子,主要在转录水平上通过介导基因的甲基化或在转录后水平上通过介导靶基因的降解等调节植物基因的表达。研究表明,在低等植物和高等植物中普遍存在很多miRNA家族,并且在进化过程很保守,这些miRNA的功能几乎涉及到生长发育、信号转导以及环境响应等生命进程的各个方面[1-3]。miRNA在植物体细胞胚发生过程中同样起着很重要的调控作用,在玉米[4]、柑橘[5]、龍眼[6]等中均有相关研究。
植物miRNA的生物合成大致可以分为3个步骤,首先在细胞核内由RNA聚合酶Ⅱ转录成初级转录本(pri-mi RNA),pri-miRNA是含有一个或多个非完全互补的发卡结构[7];然后由DCLl (Dicer-like 1)切割pri-miRNA形成茎环状前体miRNA(pre-miRNA),并在DCL1酶和RNA结合蛋白HYL1(Hyponastic Leavas 1)及C2H2锌指蛋白SE(Serrate)的作用下形成miRNA:miRNA*双链复合物[8];接着,由HUA ENHANCER 1(HEN1)甲基转移酶对双链结构3'端碱基进行甲基化,在HASTY蛋白协助下由细胞核运至细胞质;成熟 miRNA的一条链在细胞质中被降解,另一条成熟的miRNA进入RNA诱导的基因沉默复合物RISC(RNA-induced silencing complex)中发挥作用[9]。越来越多研究表明miRNA生物合成过程除了需要以上蛋白参与外,还需要许多蛋白因子的协同作用来共同调控miRNA的产生,SE蛋白与帽子蛋白CBP20(cap binding protein 20)和CDP80(cap binding protein 80)在pri- miRNA剪切过程中相互作用发挥着重要功能;在拟南芥中除DCL1、HYL1、SE外还发现了一种DDL(dawdle)蛋白也参与miRNA合成过程,在缺少DDL的突变体中发现pri-miRNA和成熟miRNA的积累减少[10]。
龙眼是我国重要的热带木本植物,其果实大小、产量及品质与胚胎发育过程有着密切的联系[11]。本实验室已经对龙眼体胚发育内在分子及基因调控机制开展了大量的研究,发现miRNA在龙眼体胚发生中具有重要作用[12-13],但关于龙眼miRNA合成途径基因的研究还未见报道。因此本实验通过对龙眼miRNA合成途径基因的鉴定及其理化性质、染色体分布、基因结构、蛋白保守结构域、系统进化树、启动子中顺式作用元件进行分析,以及各基因在体胚发生早期不同阶段特异表达FPKM分析,旨在了解龙眼miRNA合成途径相关基因可能存在的生物学功能,为龙眼体胚发生过程的分子机制提供理论依据。
1 材料与方法
1.1 材料
采用在本实验室已发表的第2代基因组数据基础上重新进行3代测序精确组装的龙眼基因组及转录组数据库(待发表),第3代龙眼基因组测序平台为PacBio Sequel,最终确定龙眼基因组染色体长度为0.45 Gb,Contigs N50=4.4 Mb,Super scaffold N50=27.7 Mb,Contig长度锚定率91.69%,Contig数量锚定率38.61%。拟南芥序列下载于TAIR-Home Page(https://www.arabidopsis. org/),其余物种如水稻、甜橙、杨树等氨基酸序列及基因序列下载于NCBI(https://www.ncbi.nlm.nih.gov/)。
实验材料为福建农林大学园艺植物生物工程研究所诱导并长期继代的龙眼品种‘红核子松散型胚性愈伤组织(LC2细胞系),并参照赖钟雄的培养方法获得胚性愈伤组织(embrogenic cultures,EC),不完全胚性紧实结构ICpEC(incomplete compact pro-embrogenic cultures,ICpEC),球形胚(globular embryos,GE)3个阶段的胚性培养物,提取RNA后进行反转录用于荧光定量PCR反应[14]。
1.2 方法
1.2.1 龙眼体胚发生早期miRNA合成途径相关基因的鉴定及蛋白理化性质分析 在TAIR网站下载模式植物拟南芥miRNA合成途径相关基因的氨基酸序列AtDDL(AT3G20550.1)、AtDCL1(AT1G 01040.1)、AtSE(AT2G27100.1)、AtHYL1(AT1G 09700.1)、AtCBP20(AT5G44200.1)、AtCBP80(AT2G13540.1)、AtHEN1(AT4G20910.1)、AtHASTY(AT3G05040.1)为种子序列,经与龙眼基因组数据库同源比对,筛选获得具有完整Open Reading Frame(ORF)的龙眼miRNA合成途径相关基因的候选序列,根据基因组注释,采用DNAMAN 6.0软件对候选的基因组DNA序列(genomic DNA,gDNA)、编码序列(coding sequence)CDS进行分析和对比,结合NCBI Blast同源比对分析,然后根据在线网站Pfam(https:// pfam.xfam.org/)、NCBI Conserved Domain Search(https//www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb. cgi)以及HMMER (https://www.ebi.ac.uk/Tools/ hmm)对龙眼miRNA合成途径相关候选基因的蛋白结构域进行筛选,最终确定了12条相关基因。
根据龙眼基因组中的查找注释,参考模式植物拟南芥和水稻的命名方法对得到的12条龙眼基因进行命名。通过ExPASy(https://web.expasy. org/protparam)在线网站对上述12条基因的蛋白理化性质如氨基酸数目、相对分子量、等电点、不稳定系数以及亲水性指数等方面进行分析。
1.2.2 龙眼体胚发生早期miRNA合成途径相关基因结构与蛋白结构域分析 采用工具TBtools[15]并利用龙眼gff及genome文件对获得的12条基因序列进行外显子和内含子特征分析;利用Pfam、CDD、HMMER等在线网站进行基因蛋白结构域的预测,并通过TBtools进行图片可视化绘制。
1.2.3 龙眼体胚发生早期miRNA合成途径相关基因进化树构建 通过NCBI下载其他物种相关基因的蛋白序列,最后采用MEGA软件中的邻近法(Neighbor-joining method)对龙眼及下载的蛋白序列进行系统进化树构建,自展系数法(Bootstrap)设置为1000次重复检验。
1.2.4 龙眼体胚发生早期miRNA合成途径相关基因启动子分析 经龙眼基因组数据库提取获得12条基因ATG上游2000 bp的序列,采用在线网站PlantCARE(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)预测分析其启动子特征和顺势作用元件功能,采用TBtools进行图片可视化绘制。
1.2.5 龙眼体胚发生早期miRNA合成途径相关基因蛋白互作预测分析 利用在线网站STRING(https://string-db.org)进行蛋白质互作预测,选用研究最深入的拟南芥作为参考,探究龙眼体胚发生早期miRNA合成途径相关基因蛋白之间的互作情况。
1.2.6 龙眼体胚发生早期miRNA合成途径相关基因不同阶段特异性表达分析 通过龙眼转录组数据库提取miRNA合成途径相关基因在不同体胚发生阶段:EC,ICpEC和GE特异表达的FPKM值,利用TBtools绘制表达热图,分析各基因在不同阶段的表达情况。
1.2.7 实时荧光定量PCR(qRT-PCR)分析 提取筛选得到的12条基因CDS序列,通过DANMAN结合引物设计原则设计12对符合条件的引物(表1);參照Lin等[16]的具体操作步骤,采用20 μL反应体系进行荧光定量PCR测定;通过罗氏LightCyclers480荧光定量PCR仪,以EF-1a为内参基因,采用2-ΔΔCT计算龙眼miRNA合成途径相关基因在体胚发生早期中的表达情况;利用Graphpad Prism 7进行作图,并与其FPKM值进行分析比较。
2 结果与分析
2.1 龙眼体胚发生早期miRNA合成途径相关基因的鉴定及蛋白理化性质分析
首先从TAIR网站上下载拟南芥miRNA合成途径相关基因编码蛋白的氨基酸序列:经过龙眼第3代基因组数据库的比对以及NCBI Blast双向比对结果,再结合Pfam、HMMER、CDD等网站进行结构域预测,最后鉴定出12条龙眼miRNA合成途径相关基因。最后参照模式植物拟南芥、水稻的命名方式将其命名为DlDDL1、DlDDL2、DlDDL3、DlDCL1、DlSE、DlHYL1a、DlHYL1b、DlHYL1c、DlCBP20、DlCBP80、DlHEN1、DlHASTY。
通过蛋白质特性分析可以发现(表2),miRNA合成途径相关基因编码的蛋白在400~ 1000 aa之间变化,蛋白分子质量23.92~220.25 kDa,其中DlHTL1b氨基酸数目最长为1968 aa,DlCBP20最短为206 aa;等电点5.05~10.32,大部分为酸性蛋白;不稳定系数45.20~103.43,均为不稳定蛋白;DlHASTY亲水性指数为0.049,是疏水性蛋白,而其余蛋白亲水性指数为–1.529~ –0.131,为亲水性蛋白。
2.2 龙眼体胚发生早期miRNA合成途径相关基因结构及蛋白结构分析
为了进一步了解龙眼体胚发生早期miRNA合成途径相关基因的结构特征,对12条基因的外显子-内含子的结构进行研究,发现其表现出不同的外显子-内含子的组织模式(图1)。基因长度存在着明显的差异,这很可能是因为在功能上的不同导致的。大部分基因的外显子数量为10~20个,DlDDL的3个成员中DlDDL2的外显子数目最少,仅有2个,DlDDL1和DlDDL3分别含有8和10个外显子;DlDCL1、DlCBP80、DlHASTY的外显子数目较多,均在20个左右,但DlCBP20的外显子数目较少为7个;DlHYL1的1a、1c两个成员外显子数目较为一致相差不大,1b的外显子数量仅为2个。12条基因呈现出不同的外显子–内含子数量分布,这可能与基因功能的分化有关。
蛋白保守结构域的结果显示(图2):DlDDL三个成员均含有典型的FHA结构域,但DlDDL1蛋白结构域的位置和长度均与DlDDL2、DlDDL3存在差异,推测它们在功能上可能有着不同的分工;DlDCL1显示含有7个不同的蛋白结构域,其中包括典型的Dicer与PAZ结构域,且在不同植物中高度保守;DlSE显示含有DUF3546和ARS2两个结构域;DlHYL1的3个成员中DlHYL1a和DlHYL1b均含有2个dsrm结构域,DlHYL1c则含有3个;DlCBP20和DlCBP80的结构域不相同,DlCBP20只含有1个典型的RRM结构域且长度较长;DlHEN1显示含有2个蛋白结构域,分别为DSRM和baccter_Hen1;DlHASTY只含有1个蛋白结构域Xpo1。
2.3 龙眼体胚发生早期miRNA合成途径相关基因进化树构建
为了进一步了解龙眼miRNA合成途径相关基因的进化关系,在NCBI上下载不同物种相关基因编码蛋白的氨基酸序列,并采用MEGA构建系统发育进化树。结果显示(图3):DlDDL1与甜橙的DDL蛋白亲缘关系最近,DlDDL2、DlDDL3分别与拟南芥和杨树DDL蛋白亲缘关系较近;DlDCL1与甜橙亲缘关系最为接近;DlSE蛋白与木槿、拟南芥在进化上保持较近的亲缘关系,与甜橙、杨树等亲缘关系较远;DlHYL1b、DlHYL1c与DlHYL1a不同,分别与拟南芥、油松亲缘关系较近;DlCBP 20和DlCBP80在进化关系上都与水稻在亲缘关系上保持较远的距离;DlHEN1与橡胶树、川桑亲缘关系较近;DlHASTY与油松等亲缘关系较远。
2.4 龙眼体胚发生早期miRNA合成途径相关基因启动子分析
为进一步了解龙眼体胚发生早期miRNA合成途径相关基因5端调控序列的功能,通过PlantCARE在线对12条基因起始密码子ATG上游2000 bp序列进行顺式作用元件预测,预测分析结果表明(图4):12条基因均含有CAAT-box和TATA-box表明其都能够进行正常的转录,但各基因的CAAT-box和TATA-box的数量多少有明显差异。对各基因含有的顺式作用元件进行分析发现(图5),12条基因均含有大量的光学响应元件及少量的厭氧诱导响应元件,50%的基因都含有生长素、乙烯、茉莉酸甲酯、水杨酸等激素响应元件,75%的基因响应脱落酸和赤霉素应答;另外,还有一些基因含有与细胞周期、昼夜控制、干旱、胁迫、胚乳、分生组织、低温等作用元件,提示这些基因可能参与生物钟、抗旱抗寒、种子生长、胚胎发育等过程。不同基因所含有的顺式作用元件以及数量都有差异,推测其对不同的胁迫响应具有一定的差异,并可能在龙眼生长发育中承担着不同的特异性功能。
2.5 龙眼体胚发生早期miRNA合成途径相关基因蛋白互作预测分析
利用String蛋白互作在线数据库对龙眼体胚发生早期miRNA合成途径相关基因蛋白之间的功能关系进行预测,选择研究较为深入的模式植物拟南芥作为参考,蛋白互作预测结果分析显示(图6):miRNA合成途径相关基因DCL1、SE、HASTY、DDL、HEN1、HYL1之间有很强的互作关系。
2.6 龙眼体胚发生早期miRNA合成途径相关基因不同阶段FPKM值分析
为了进一步了解miRNA合成途径相关基因在龙眼体细胞胚胎发生中的功能特点,结合龙眼第3代转录组数据库中EC、ICpEC、GE 3个阶段的FPKM值制作热图。结果显示(图7):在3个不同阶段中,除DlHYL1c表达量很低,其他基因的表达量相对较高,其中DlCBP20的表达量最高。DlDDL在3个阶段的表达量比较平稳,且DlDDL1的表达量较高;DlDCL1和DlSE在3个阶段中呈现出先上调后下调的模式;DlHYL1a与DlHYL1b表达模式一致呈现出下调模式;DlCBP20与DlCBP80、DlHEN1呈现出下调模式;DlHASTY则呈现出先上调后下调的表达模式。总体上,miRNA合成途径相关基因在龙眼体细胞早期发育过程中呈现出不同阶段的表达模式,提示不同基因在不同的体胚发生阶段有着不同的功能特点。
2.7 龙眼体胚发生早期不同阶段miRNA合成途径相关基因的表达模式分析
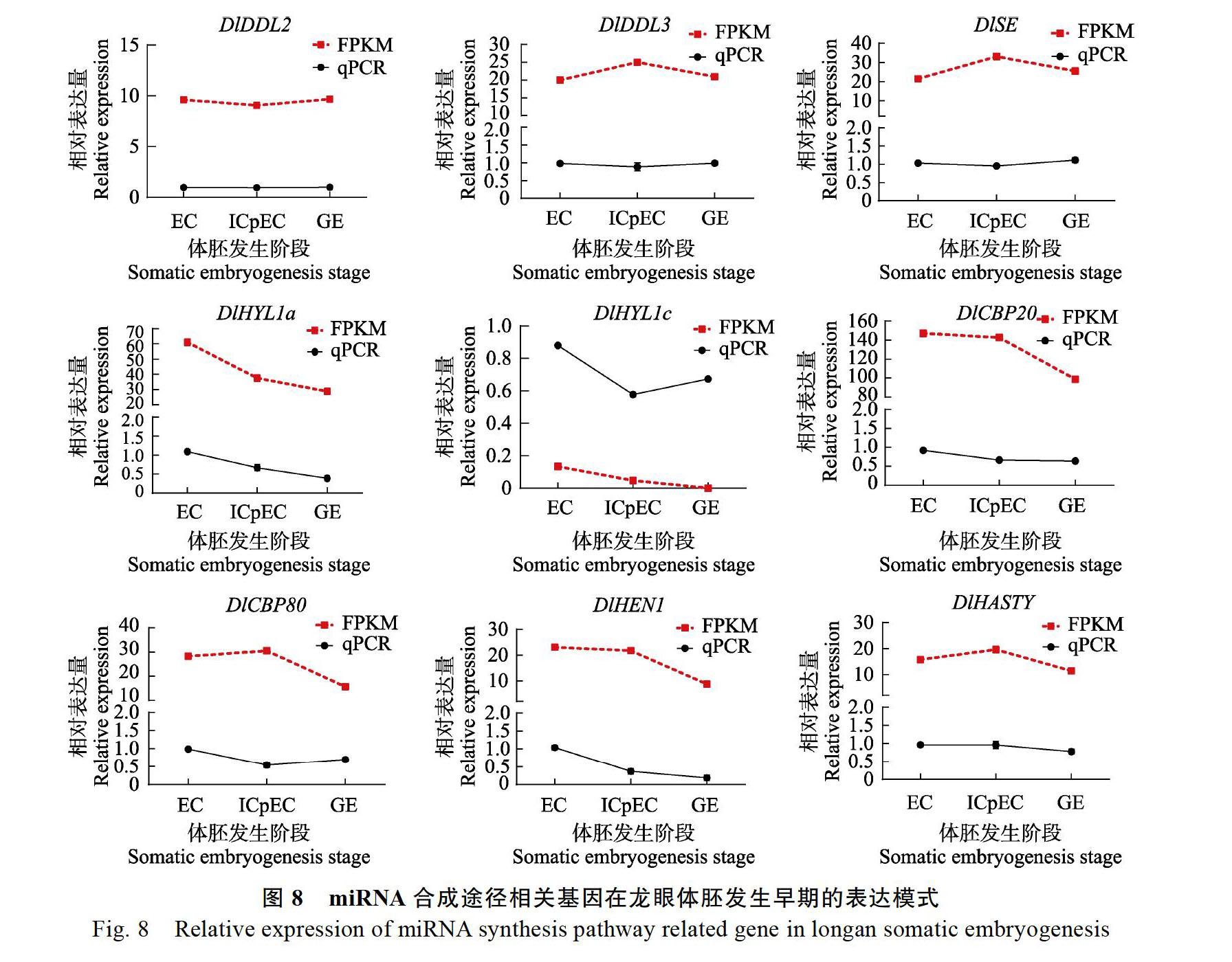
通过实时荧光定量PCR结果发现(图8),DlDDL1与DlHYL1b几乎不表达,DlDDL2、DlDDL3在体胚早期3个阶段表达量较平稳;DlSE在体胚早期3个阶段的表达量也较平稳;DlHYL1a在3个阶段的表达量呈现明显的下降趋势,DlHYL1c在3个阶段的相对表达量呈现先下降后上升的趋势,但总体上仍是呈现下降趋势;DlCBP20与DlCBP80的相对表达量总体上也是呈现下降趋势,DlHEN1与DlHASTY的相对表达量趋势与其FPKM值的趋势大致相同均呈现下降趋势。由此可见,miRNA合成途径基因在龙眼体胚发生早期的表达程度有所不同,总体上在EC阶段的表达量较高。
3 讨论
3.1 miRNA合成途径相关基因在植物生长发育中的作用
miRNA合成途径涉及到很多基因的参与,这些基因已经在模式植物尤其是拟南芥中展开广泛研究。AtDDLs在miRNA的生物合成和内源性的siRNA中发挥作用,其突变体普遍呈现出发育过程延迟、生长分化出不完全的根、幼苗和花、结实率降低等现象,充分表明了DDL蛋白在植物早期生长发育过程中具有重要作用[17];HYL1又被称为DRB1,是拟南芥中发现最早、研究最透彻的双链RNA结合蛋白,拟南芥hyl1的突变体会出现如植株矮小、晚花、根系生长慢、根向地性减弱等发育缺陷的症状,同时还会出现对IAA不敏感并且抑制生长素运输的现象,因此HYL1在植物的生长发育过程发挥着重要作用[18];有研究表明当在体外共孵育DCL1、HYL1、SE蛋白及pri-miR167时,能较精准地剪切出成熟miR167序列,若只加HYL1或SE蛋白其中一种时,剪切精确度会下降,若2种蛋白都不加时,剪切精确度下降更明显,这说明HYL1和SE在DCL1识别pri-miRNA并剪切的过程中发挥重要作用[19];在水稻中发现CBP20蛋白可提高大肠杆菌重组对高盐度、高热和脱水的耐受性,提示OSCBP20蛋白在应激条件下可能起保护作用[20],拟南芥中有研究发现CBP20和CBP80突变体中miRNA含量减少,pri-miRNA含量增多,免疫共沉淀实验表明,pri-miRNAs 159、166、168和172可能与CBP20和CBP80有关,还发现ABA处理后的CBP20/80突变体种子中miR159积累减少,MYB33和MYB101转录水平的升高,推测CBP20和CBP80是ABA在种子萌发过程中诱导miR159所必需的[21];在拟南芥发育的大多数阶段,HEN1的单个突变体表现出多种表型,如器官大小减少、莲座叶形状改变和花序数量增加[22];HASTY蛋白的缺失也会影响拟南芥发育中的许多过程,除减少茎根和侧器官的大小外,还会影响茎尖分生组织的大小,延迟短时间内的花诱导,叶片和心皮的正面化,破坏花序的节性,降低生育能力等[23]。
3.2 miRNA合成途徑相关基因可能参与激素应答和响应非生物胁迫
miRNA合成途径基因的表达不仅受到不同激素的诱导同样也受到许多环境因子的调节,不同的基因对非生物胁迫的应答模式也有所不同。对龙眼miRNA合成途径相关基因启动子序列进行生物信息学分析发现,这些基因含有脱落酸、乙烯、赤霉素、生长素、茉莉酸甲酯、水杨酸的激素响应元件,脱落酸有调节胚的发育、加速脱落休眠及抑制生长的生理功能[24],其中DlDCL1、DlCBP80、DlDRM2还有不止一个脱落酸激素元件;赤霉素不仅能促进体胚发生相关的转录因子表达影响早期胚性组织细胞向球形胚阶段的分化[25],还能影响胚轴的发育及种子的萌发[26];这些基因中还包含了水杨酸和茉莉酸甲酯的响应元件,这2种激素在植物抗病机制中发挥重要作用;生长素和乙烯对植物同样有着很重要的作用,有研究发现这2种激素在棉花的体胚发育中有重要作用[27],因此推测其中一些基因在相应的激素信号传导中发挥一定作用。
3.3 miRNA及合成途径相关基因参与植物体胚发育进程
植物体胚发生过程中需要很多基因的共同参与,其中miRNA及相关基因对植物体细胞胚胎的形成也有影响。在拟南芥中通过原位杂交实验表明,HEN1可以通过miR167负调控ARF6和ARF8的表达进而调控胚珠发育[28]。
本研究通过对miRNA合成途径相关基因在龙眼体胚发生早期的FPKM值与基因表达模式分析发现,DlDDL1与DlHYL1b在3个阶段均不表达,而DlHYL1c在3个阶段均有表达。DlDDL2、DlHYL1a、DlCBP20、DlHEN1、DlHASTY的表达模式与其FPKM值趋势一致,其中DlHYL1a、DlCBP20、DlHEN1均呈现出下调的模式,在EC阶段的表达量最高,提示其可能在龙眼胚性愈伤组织建成中发挥重要作用,DlDDL2、DlHASTY在3个阶段的表达量相差不大;DlHYL1c、DlCBP80、DlHEN1的表达模式与其FPKM值相比虽略有差异,但总体均呈现出下降趋势,即在EC阶段的表达量最高;DlDDL3、DlSE的表达模式与其FPKM值相比也有差异,但在3个阶段的表达趋势均相对平稳。DlDCL1在3个阶段的表达量呈现明显的下降趋势[29]。龙眼miRNA合成途径相关基因在体胚发生早期3个阶段的表达模式有差异,提示这些基因可能在龙眼体胚发生早期过程中发挥着不同的作用。
参考文献
[1] Hutvagner G. A microRNA in a multiple-turnover RNAi enzyme complex[J]. Science, 297(5589): 2056-2060.
[2] Zeng Y, Yi R, Cullen B R. MicroRNAs and small interfering RNAs can inhibit mRNA expression by similar mechanisms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17): 9779-9784.
[3] Doench J G, Petersen C P, Sharp P A. siRNAs can function as miRNAs[J]. Genes and Development, 2003, 17(4): 438-442.
[4] 付 蓉. 玉米自交系盐胁迫响应miRNA及其靶基因的鉴定研究[D]. 南通: 南通大学, 2016.
[5] 刘元龙. 参与柑橘果实发育的miRNA和靶基因的挖掘与分析[D]. 武汉: 华中农业大学, 2015.
[6] 林玉玲, 赖钟雄. 龙眼胚性愈伤组织miR398b前体克隆及其在龙眼体胚发生过程中的表达分析[J]. 热带作物学报, 2012, 33(11): 2012-2017.
[7] Lee Y, Kim M, Han J, et al. MicroRNA genes are transcribed by RNA polymerase II[J]. Embo Journal, 2004, 23 (20): 4051-4060.
[8] Kurihara Y, Watanabe Y. Arabidopsis micro-RNA biogenesis through Dicer-like 1 protein functions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(34): 12753-12758.
[9] Yu B, Yang Z, Li J, et al. Methylation as a crucial step in plant microRNA biogenesis[J]. Science, 2005, 307(5711): 932-935.
[10] Yu B, Bi L, Zheng B, et al. The FHA domain proteins DAWDLE in Arabidopsis and SNIP1 in humans act in small RNA biogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(29): 10073-10078.
[11] 李冬梅. 龙眼体细胞胚胎成熟机理的研究[D]. 福州: 福建农林大学, 2003: 3-5.
[12] 林玉玲, 赖钟雄. 利用Solexa测序技术鉴定龙眼体胚发生过程中的miRNAs[EB/OL].(2011-02-10) [2020-05-25]. http://www.paper.edu.cn/releasepaper/content/201102-64.
[13] Lin Y, Lai Z, Lin L, et al. Endogenous target mimics, microRNA167, and its targets ARF6 and ARF8 during somatic embryo development in Dimocarpus longan Lour[J]. Molecular Breeding, 2015, 35(12): 1-15.
[14] 赖钟雄. 龙眼生物技术研究[M]. 福州: 福建科学技术出版社, 2003: 18-22.
[15] Chen C J, Xia R, Chen H, et al. TBtools, a toolkit for biologists integrating various biological data handling tools with a user-friendly interface[J/OL]. BioRxiv, 2018: 289660 [2020- 05-25]. http://dx.doi.org/10.1101/289660.
[16] Lin Y L, Lai Z X. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J]. Plant Science, 2010, 178(4): 359-365.
[17] Morris E R, Chevalier D, Walker J C. DAWDLE, a forkhead- associated domain gene, regulates multiple aspects of plant development[J]. Plant Physiology, 2006, 141(3): 932-941.
[18] Hiraguri A, Itoh R, Kondo N, et al. Specific interactions between Dicer-like proteins and HYL1/DRB-family dsRNA- binding proteins in Arabidopsis thaliana[J]. Plant Molecular Biology, 2005, 57(2): 173-188.
[19] Dong Z, Han M H, Fedoroff N. The RNA-binding proteins HYL1 and SE promote accurate in vitro processing of pri-miRNA by DCL1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(29): 9970-9975.
[20] Zhou C, Chen R J, Gao X L, et al. Heterologous expression of a rice RNA-recognition motif gene OsCBP20 in escherichia coli confers abiotic stress tolerance[J]. Plant Omics, 2014, 7(1): 28-34.
[21] Kim S, Yang J Y, Xu J, et al. Two cap-binding proteins CBP20 and CBP80 are involved in processing primary MicroRNAs[J]. Plant Cell Physiology, 2008, 49(11): 1634-1644.
[22] Chen X, Liu J, Cheng Y, et al. HEN1 functions pleiotropically in Arabidopsis development and Acts in C function in the flower[J]. Development, 2002, 129(5): 1085-1094.
[23] Bollman M K. HASTY, the Arabidopsis ortholog of exportin 5/MSN5, regulates phase change and morphogenesis[J]. Development, 2003, 130(8): 1493-1504.
[24] Finkelstein R. Abscisic acid synthesis and response[J]. Arabidopsis Book, 2013, 11: e0166.
[25] Gómez-Cadenas A, Zentella R, Walker-Simmons M K, et al. Gibberellin/abscisic acid antagonism in barley aleurone cells: site of action of the protein kinase PKABA1 in relation to gibberellin signaling molecules[J]. Plant Cell, 2001, 13(3): 667-679.
[26] Chen M, Du X, Zhu Y, et al. Seed Fatty Acid Reducer Acts downstream of gibberellin signalling pathway to lower seed fatty acid storage in Arabidopsis[J]. Plant Cell Environment, 2012, 35(12): 2155-2169.
[27] 朱華国, 张献龙, 金双侠, 等. 两种常用激素组合下棉花体细胞胚胎发生过程的组织学观察[J]. 棉花学报, 2012, 24(2): 159-166.
[28] 魏帅杰. 拟南芥HEN1调控胚珠发育的分子机理研究[D]. 泰安: 山东农业大学, 2019.
[29] 陈晓慧. 龙眼体胚发生过程中DlDCLs的克隆与功能分析[D]. 福州: 福建农林大学, 2018.
责任编辑:黄东杰

