基于转录组测序的火龙果果肉不同发育时期淀粉和蔗糖代谢途径相关基因差异表达分析
杨运良 李建勋 马革农


摘 要:采用Illumina Novaseq 6000測序技术对火龙果果肉3个时期(幼果期、转色期、成熟期)的样品进行转录组测序,对获得的Unigene进行7大数据库注释,共有3617个Unigene成功注释在所有数据库中,进一步筛选与淀粉和蔗糖代谢途径相关的5个酶基因并进行实时荧光定量PCR(qPCR)基因表达验证。结果表明:转录组测序共得到115 193条转录本和47 855条Unigene,N50为2000。GO功能富集分析结果表明,18 582个Unigene在GO功能注释中被分为生物过程、细胞组成及分子功能3大类。KOG功能分类结果表明,6203个Unigene在KOG注释中被分为25个组,其中翻译后修饰、蛋白质周转、伴侣包含的Unigene最多,共854个。KEGG代谢通路注释结果表明,6554个Unigene获得功能注释,共有119条代谢途径,其中碳水化合物代谢所占比例最高。筛选出UGP2、glgC、glgA、Cluster-12747.5831、Cluster-12747.16617等5个参与淀粉和蔗糖代谢合成途径的关键酶基因,qPCR检测表达水平与转录组测序结果一致。
关键词:火龙果;果肉;转录组测序;淀粉;蔗糖
中图分类号:S667.9 文献标识码:A
Differential Expression Analysis of Genes Related to Starch and Sucrose Metabolism Pathway in Different Developmental Stages of Dragon Fruit Pulp Based on Transcriptome
YANG Yunliang, LI Jianxun*, MA Genong
Cotton Research Institute, Shanxi Agricultural University, Yuncheng, Shanxi 044000, China
Abstract: In this study, Illumina Novaseq 6000 sequencing was used to sequence the samples from three stages of dragon fruit pulp (young fruit stage, color conversion stage and mature stage). The unigenes obtained was annotated in seven databases. A total of 3617 unigenes were successfully annotated in all databases. Five enzyme genes related to starch and sucrose metabolism pathway were further screened and verified by quantitative Real-time PCR (qPCR). The results showed that 115 193 transcripts and 47 855 transcripts were obtained by transcriptome sequencing and unigene N50 was 2000. The results of GO functional enrichment analysis showed that 18 582 unigenes were divided into three categories: biological process, cell composition and molecular function in GO functional annotation. The results of KOG functional classification showed that 6203 unigenes were divided into 25 group, in KOG annotation, of which post-translational modification, protein turnover and chaperone contained the most unigenes. The results of KEGG metabolic pathway annotation showed that 6554 unigenes got functional annotation, and there were 119 metabolic pathways, among which carbohydrate metabolism accounted for the highest proportion. Five key enzyme genes involved in starch and sucrose metabolism and synthesis pathway, such as UGP2, glgC, glgA, Cluster-12747.5831 and Cluster-12747.16617, were screened. The expression level of qPCR was consistent with that of transcriptome sequencing.
Keywords: dragon fruit; pulp; transcriptome sequencing; starch; sucrose
DOI: 10.3969/j.issn.1000-2561.2021.06.003
火龙果营养丰富,富含糖、有机酸、蛋白质、矿质元素、维生素、膳食纤维等[1-2],是我国南方重要的果树树种。近年来,随着火龙果产业迅速发展,用于栽培的火龙果良种较少,通过分子生物学手段进行品种遗传改良研究具有必要性。截至目前,火龙果的全基因组测序尚未完成,遗传信息还不清楚,与果实发育相关的基因种类和功能尚不明确,这些均阻碍了火龙果果实品质形成机理等相关基础研究的进行。淀粉和蔗糖是果实内在品质形成的主要因子。目前,对火龙果果实发育过程中淀粉和蔗糖代谢途径研究较少,参与淀粉和蔗糖代谢合成的相关酶及酶基因尚未见报道,淀粉和蔗糖代谢过程是如何进行催化反应还不清楚。探究火龙果果肉中淀粉和蔗糖合成代谢途径的分子调控机制,对改善果实品质具有重要的意义。
RNA测序[3](RNA Sequencing,简称RNA- Seq)又称转绿组测序技术,具有灵敏度高、定量准确、可重复性高、检测范围广、分析更可靠等特点,被广泛应用。该技术具有获取全部mRNA转录本的丰度信息,从中挖掘功能基因和未知基因,解析基因调控状况,揭示不同生物学过程与基因表达之间关系等方面具有独特的优势[4-5]。近年来,火龙果在转录水平上的研究取得了一系列进展,主要集中在逆境(低温[6]、干旱[7]、水淹[8]、盐胁迫[9])、火龙果果肉颜色[10-11]转录调控、甜菜碱[12-13]生物合成相关基因表达、病虫害等[14]方面,然而基于火龙果果肉不同发育时期转录组测序方面的研究尚未见报道。
本研究以3个不同发育时期的红肉火龙果果肉为研究对象,进行转录组测序研究,采用生物信息学技术方法,对得到的Unigene进行分类和功能注释,分析差异表达基因富集的代谢通路,对参与火龙果果实发育过程中淀粉和蔗糖代谢过程的差异表达的酶基因进行筛选及qPCR验证,旨在探索火龙果果实发育过程中关于淀粉和蔗糖代谢过程中酶的催化情况及酶基因的表达规律,为进一步实现人为调控火龙果果实糖分积累、提升果实品质提供理论依据。
1 材料与方法
1.1 材料
研究材料采自山西农业大学(山西省农业科学院)棉花研究所南花农场的15株红肉火龙果树,树龄为3 a,品种为‘蜜宝,生长状况良好。通过前期对15株红肉火龙果树物候期观察,于2019年7月15日开始采样,每5 d采1次样,共采5次样,选取3个关键时期进行研究,即:2019年7月15日(幼果期,Y)、2019年7月26日(转色期,C)、2019年7月31日(成熟期,M),每次分别在3株树的相同部位采集果实,采样完成后迅速返回实验室,将3个果实逐一去皮,切片(从果实中部横切约0.3 cm),并立即将果肉放入液氮中冷冻,在?80 ℃保存备用。
1.2 总RNA提取及检测、cDNA文库构建和Illumina测序
1.2.1 总RNA提取及检测 使用TRNzol-A* Reagent提取火龙果果肉中的总RNA。采用琼脂糖凝胶电泳分析火龙果果肉中RNA完整性及是否存在DNA污染,NanoPhotometer spectrophotometer检测RNA纯度,Agilent 2100 bioanalyzer检测RNA完整性,以备合格的火龙果果肉RNA进行转录组测序。
1.2.2 cDNA文库构建、质检及测序 火龙果果肉RNA检测合格后,构建cDNA文库。纯化后的双链cDNA,经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选250~300 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。使用Agilent 2100 bioanalyzer对文库的insert size进行检测。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina测序。
1.3 测序数据分析
1.3.1 数据质控 为了保证数据分析的质量及可靠性,需要对原始数据进行过滤。主要包括去除带接头的reads、含N的reads、低质量reads。同时,对clean data进行Q20、Q30和GC含量计算。后续所有分析均是基于clean data进行高质量分析。
1.3.2 转录本拼接、Corset层次聚类及转录本质量评估 转录组数据使用Trinity[15]软件对clean data进行从头组装获得转录本。Corset[16]层次聚类,在Trinity软件拼接基础上,根据转录本间Shared Reads将转录本聚合为许多cluster,再结合不同样本间的转录本表达水平及H-Cluster算法,将样本间有表达差异的转录本从原cluster分离,建立新的cluster,最终每个cluster被定义为“Gene”。该方法可以聚合冗余转录本,并提高差异表达基因的检出率。本研究采用BUSCO[17]软件进行转录本质量评估。
1.3.3 参考序列比对 将Trinity拼接得到的转录组作为参考序列(Ref),将每个样品的clean reads往Ref上做mapping,分别过滤掉比对质量值低于10的reads,非成对比对上的reads,比對到基因组多个区域的reads。比对采用RSEM[18]软件,RSEM中使用到的bowtie2参数mismatch0 (bowtie2默认参数)。
1.3.4 基因功能注释 基于Nr、Nt、Pfam、Swiss-Prot进行序列相似性检索蛋白质功能进行注释。利用GO、KEGG、KOG数据库分别进行
分子功能及相关代谢通路的比对预测分析。
1.4 差异基因富集分析
本研究采用GOseq[19]和KOBAS[20]软件对差异基因进行GO功能富集分析和KEGG通路富集分析等。
1.5 荧光定量PCR分析
根据qPCR引物设计原则,采用Beacon Designer 7.9软件进行引物设计,设计各候选基因的qPCR引物(表1)。引物由魔獾生物科技(上海)有限公司合成。本研究以火龙果3个发育时期的果肉为材料,YLS8为内参基因[21],采用SYBR GREEN I检测进行qPCR反应,利用2?CT计算各个发育时期果肉的基因相对表达量。反应总体系为10 μL,其中包括2×SYBR? Green Supermix 5 μL、Forward prime 0.5 μL、Reverse primer 0.5 μL、cDNA 1 μL、ddH2O 3 μL。反应程序为:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,39个循环。扩增完毕后,以1 ℃/4 s的速率从60 ℃逐步递增到95 ℃,获得溶解曲线。反应过程中,每个样品设置3个生物学重复。
2 结果与分析
2.1 火龙果果肉转录组测序数据评估统计及拼接
本研究以‘蜜宝火龙果3个不同果肉发育时期即幼果期、转色期、成熟期为样本进行转录组测序,共获得508 793 664个clean reads,包含76.32 Gb的核苷酸序列,Q20、Q30碱基百分比平均值均不小于97.95%、94.02% (表2)。将clean reads进行拼接组装,共获得火龙果果肉Transcripts 115 193条,Unigene 47 855条(表3)。Transcripts的N50和N90分别是2164和682,Genes的N50和N90分别是2000和508(表4)。结果表明,火龙果果肉测序数据质量高,可进行后续的生物信息学分析。
2.2 火龙果3个不同果肉发育时期差异表达基因比较
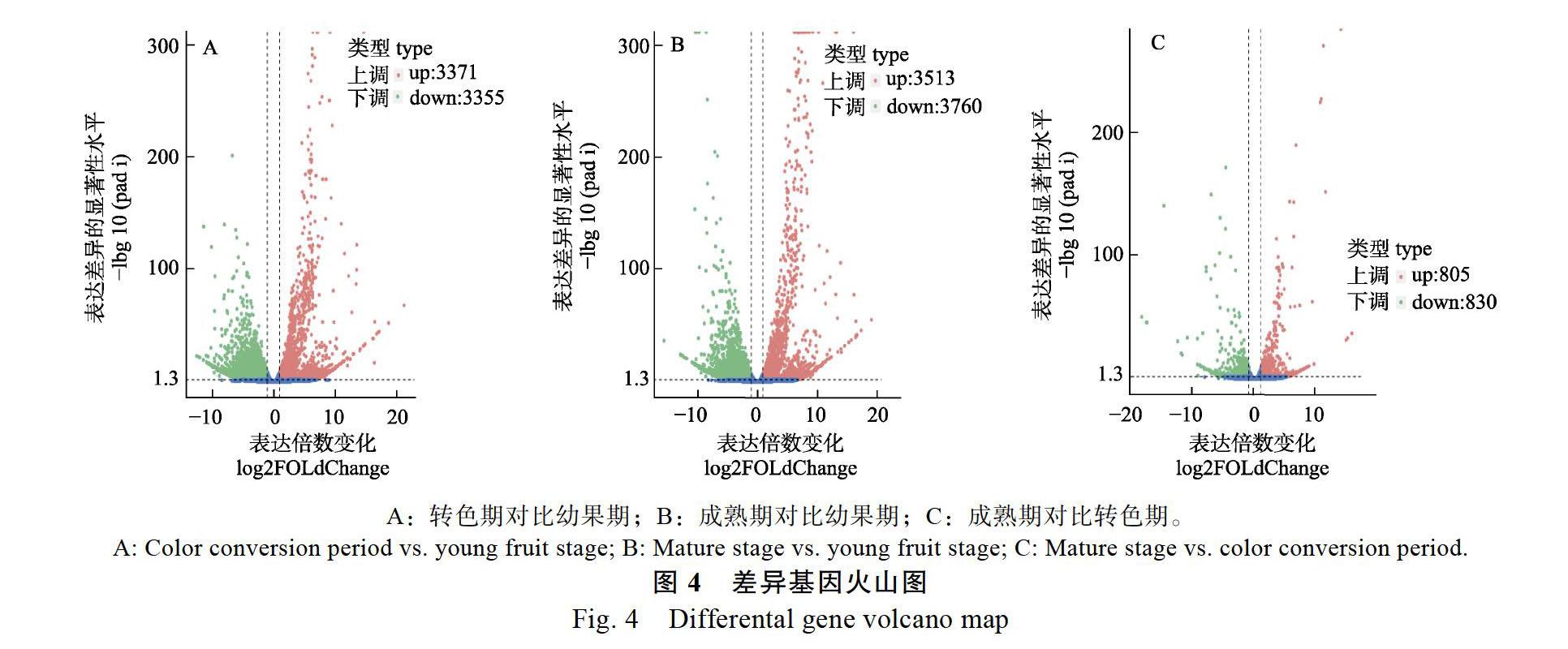
‘蜜宝火龙果3个不同果肉发育时期基因表达差异,两两比对,结果见表5。结果表明:转色期与幼果期相比,有7226条Unigene差异基因表达,其中3371个基因上调表达,3855个基因下调表达;成熟期与幼果期相比,共有7273个差异表达基因,其中上调基因3513个,下调基因3760个;成熟期与转色期相比,共有1635个差异表达基因,其中805个基因上调,830个基因下调。上述结果表明,火龙果果肉在成熟期的差异表达基因所占比例高于其他2个时期,说明DEGs在火龙果成熟期发育阶段起着非常重要的作用。
2.3 基因注释和功能分类
2.3.1 基因注释 获得转录本后,需对转录本进行功能注释,以获得gene的功能信息。为了解火龙果果肉转录本的注释情况,与7大数据库进行比对,共有47 855个Unigene成功注释(表6),由于火龙果的基因组信息尚未公布,缺少参考基因组信息,部分序列未能注释。与NR数据库进行比对获得的基因注释信息最高,占全部注释序列的49.2%。与PFAM和GO数据库比对获得的基因注释信息次之,占全部注释序列均为38.82%。与KOG数据库比对获得的基因注释信息最少,占全部注释序列的12.96%。
2.3.2 火龙果果肉发育过程中差异表达基因GO功能富集 ‘蜜宝火龙果3个不同果肉发育时期差异表达基因经两两比对,18 582个Unigene在GO功能注释中被分为3大类,且每一类注释种类和数量各不相同。由图1可知,生物过程主要集中在细胞过程、代谢过程和单一有机体过程。在生物过程中,多数差异基因主要参与到细胞过程、代谢过程、单一生物过程;细胞组件中,多数差异基因主要参与了细胞、细胞组成、细胞器、细胞器组成、大分子复合物、膜、膜组成;分子功能中,多数差异基因富集到绑定、催化活性。
2.3.3 火龙果果肉发育过程中差异表达基因KOG注释分类统计 对火龙果果肉发育过程中差异表达基因进行KOG数据库比对分析,6203个Unigene在KOG注释中被分为25个group,结果如图2所示。翻譯后修饰、蛋白质周转、伴侣包含的Unigene最多,共854个;其次是一般功能预测,Unigene 803个;翻译,核糖体结构与生物发生,Unigene 538个;细胞内运输,分泌和囊泡运输,Unigene 483个;RNA加工和修饰,Unigene 450个;未知功能,Unigene 426个;信号转导机制,Unigene 420个;能量生产和转换,Unigene 352个;转录,Unigene 351个;脂质转运与代谢,Unigene 307个;碳水化合物转运与代谢,Unigene 298个;氨基酸转运与代谢,Unigene 289个;最少的是细胞运动性,注释到2个Unigene。可见,在火龙果果肉发育过程中,除了转录、翻译、修饰、运输等最基本的生命活动外,信号转导,脂质、碳水化合物及氨基酸转运与代谢占重要地位,说明信号转导,脂质、碳水化合物及氨基酸转运在火龙果果肉发育过程中起到重要作用。
2.4 火龙果果肉发育过程中差异表达基因的KEGG分类
对基因做KO注释后,根据它们参与的KEGG代谢通路进行分类(图3),共分为5类,分别为:细胞过程、环境信息处理、遗传信息处理、代谢及有机系统,其中代谢占的比例最大。在细胞过程中,以运输和分解代谢为主;在环境信息处理中,以信号转导所占比例最高,膜运输所占比例最小;遗传信息处理中,以翻译所占比例最高,复制和修复所占比例最小;代谢中,以碳水化合物代谢所占比列最高,多糖生物合成所占比例最小;在有机系统中,以环境适应为主。
2.5 火龙果3个不同果肉发育时期差异基因(DEGs)富集的代谢通路分析
KEGG是有关Pathway的主要公共数据库,通过Pathway显著性富集,能够确定火龙果果肉在3个不同发育时期的差异表达基因参与的主要代谢途径。
2.5.1 转色期对比幼果期 转色期与幼果期共有7226个差异基因(padj<0.05|&log2FoldChange|> 1),其中上调基因3371个,下调基因3855个(图4A)。转色期对比幼果期的差异基因共参与到119种代谢通路,其中富集于前20的KEGG代谢通路见图5。转色期上调的差异基因主要富集在植物激素信号转导、丙酮酸代谢、光合生物的固碳作用、半乳糖代谢、过氧化物酶体、类黄酮生物合成、类胡萝卜素生物合成中,其中与类胡萝卜素生物合成相关的酶基因表达量均上调,包括胡萝卜素去饱和酶、玉米黄质环氧化酶、9-顺-环氧羰基双加氧酶、花椒毒素脱氢酶,推测转色期果肉颜色形成与类胡萝卜素生物合成有关(图5A)。转色期下调的差异基因主要富集在核糖体、淀粉和蔗糖代谢、苯丙素类生物合成、糖酵解/糖异生、氨基糖和核苷酸代谢、α-亚麻酸代谢、柠檬酸循环、脂肪酸生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成等(图5B)。
2.5.2 成熟期对比幼果期 成熟期与幼果期共有7273个差异基因(padj<0.05|&log2FoldChange|> 1),其中上调基因3513个,下调基因3760个(图4B)。成熟期对比幼果期的差异基因共参与到119种代谢通路,其中富集于前20的KEGG代谢通路见图6。成熟期上调的差异基因主要富集在内质网中的蛋白质加工、淀粉和蔗糖代谢、剪接体、丙酮酸代谢、光合生物的固碳作用等(图6A)。成熟期下调的差异基因主要富集在核糖体、植物激素信号转导、淀粉和蔗糖代谢、苯丙素类生物合成、糖酵解/糖异生等。随着火龙果果实的生长发育,成熟期较幼果期的果实口感甜,这与成熟期上调的差异基因富集在淀粉和蔗糖代谢、光合生物的固碳作用、半乳糖代谢有关(图6B)。
2.5.3 成熟期对比转色期 成熟期与转色期共有1635个差异基因(padj<0.05|&log2FoldChange|> 1),其中上調基因805个,下调基因830个(图4C)。成熟期对比转色期的差异基因共参与到95种代谢通路,其中富集于前20的KEGG代谢通路见图7。成熟期上调的差异基因主要富集在内质网中的蛋白质加工、苯丙素类生物合成、淀粉和蔗糖代谢、光合生物的固碳作用、半胱氨酸和蛋氨酸代谢、类黄酮生物合成、果糖和甘露糖代谢、甘氨酸、丝氨酸和苏氨酸代谢、花青素生物合成等(图7A)。成熟期下调的差异基因主要富集在内质网中的蛋白质加工、植物激素信号转导、半乳糖代谢、糖酵解/糖异生、光合生物的固碳作用等(图7B)。
2.6 火龙果果肉中淀粉和蔗糖代谢途径相关酶的基因统计及表达模式
2.6.1 火龙果果肉中淀粉和蔗糖代谢途径相关的差异基因统计 本研究根据火龙果在3个不同果肉发育时期基因表达水平的显著差异,统计了参与淀粉和蔗糖代谢途径相关的酶基因个数。结果表明:转色期与幼果期比对,参与淀粉和蔗糖代谢途径的差异表达基因共有80个,其中上调基因25个,下调基因55个,下调基因占69%,成熟期与幼果期比对,参与淀粉和蔗糖代谢途径的差异表达基因共有76个,其中上调基因28个,下调基因48个,下调基因占63%;成熟期与转色期比对,参与淀粉和蔗糖代谢途径的差异表达基因共有15个,其中上调基因7个,下调基因8个,下调基因占53%;通过对火龙果3个不同果肉发育时期差异基因比对整体来看,淀粉和蔗糖途径为下调基因富集的通路。
2.6.2 火龙果果肉中淀粉和蔗糖代谢途径相关的酶基因的表达模式 以DESeq2padj<0.05|log2?F?o?l?d?Change|>1为筛选条件,结合KEGG富集通路,在火龙果3个不同果肉发育时期筛选参与淀粉和蔗糖代谢途径的差异表达酶基因5个(表7)。
2.7 qPCR验证
为了验证转录组测序数据的准确性,以YLS8为内参基因,筛选出参与淀粉和蔗糖代谢途径的关键酶基因UGP2、glgC、glgA、Cluster- 12747.5831、Cluster-12747.16617等5个,并采用RT-PCR技术对5个关键的酶基因在火龙果3个不同果肉发育时期进行验证分析。结果表明,RT-PCR验证的5个与淀粉和蔗糖代谢途径相关的酶基因在火龙果3个不同果肉发育时期上调或下调的变化倍数与转录组测序数据不一致,但基因表达量变化趋势与转录组测序结果中基因的表达量趋势基本一致(图8)。即UGP2在幼果期表达量较高,随着果肉发育表达量持续下降(图8A);glgC在转色期表达量较高,幼果期次之,成熟期表达量较低(图8B);glgA在成熟期表达量较高,幼果期次之,转色期表达量较低(图8C);Cluster-12747.5831在幼果期表达量较高,转色期表达量较低,成熟期较转色期的表达量略有回升(图8D);Cluster-12747.16617在幼果期和转色期的表达量较高且一致,成熟期表达量最低(图8E)。以上结果表明,转录组测序数据可靠性较高。同时发现,火龙果果肉中UGP2、glgC、glgA、Cluster-12747.5831、Cluster-12747.16617表达受到明显的发育调控。
3 讨论
本研究针对火龙果3个不同时期的果肉组织进行转录组测序,共得到76.32 Gb测序数据,组装后共得到115 193条转录本,对获得的Unigene进行七大数据库(NR、NT、KO、Swiss-prot、PFAM、GO、KOG)比对,共有47 855个Unigene成功注释。KEGG代谢通路注释结果表明,6554个Unigene获得功能注释,共有119条代谢途径,其中碳水化合物代谢所占比例最高。
结合KEGG分析,关于淀粉和蔗糖代谢途径相关酶发现,合成淀粉和蔗糖的代谢途径主要2条,一条代谢途径为:D-葡萄糖-1-磷酸在UTP-葡萄糖-1-磷酸尿苷酰转移酶(UGP2)催化作用下,生成UDP-葡萄糖,UDP-葡萄糖在糖原合酶(GYS)和颗粒结合型淀粉合成酶(WAXY)的共同催化作用下,生成直链淀粉,直链淀粉在1,4-α-葡聚糖分支酶(GBE1)催化作用下生成淀粉;另一条代谢途径为:D-葡萄糖-1-磷酸在葡萄糖-1-磷酸腺苷酸转移酶(glgC)催化作用下,生成ADP-葡萄糖,ADP-葡萄糖在淀粉合酶(glgA)和颗粒结合型淀粉合成酶(WAXY)共同催化作用下,生成直链淀粉,直链淀粉在1,4-α-葡聚糖分支酶(GBE1)催化作用下生成淀粉。
本试验筛选出了5个参与淀粉和蔗糖代谢途径的酶基因。其中,UTP-葡萄糖-1-磷酸尿苷酰转移酶(UGP2)在一条淀粉和蔗糖代谢途径的早期阶段发挥作用,以D-葡萄糖-1-磷酸为底物,催化形成UDP-葡萄糖。UGP2的表达影响着UGP2的活性及UDP-葡萄糖生成。本研究结果显示UGP2在火龙果果肉幼果期的表达量最高,随着果肉发育表达量持续下降。推测在火龙果果肉幼果期生成的UDP-葡萄糖最多,随着果肉的不断发育成熟,生成的UDP-葡萄糖逐渐减少,成熟期最少。葡萄糖-1-磷酸腺苷酸转移酶(glgC)在另一条淀粉和蔗糖代谢途径的早期阶段发挥作用,催化D-葡萄糖-1-磷酸生成ADP-葡萄糖。glgC的表达影响着glgC的活性及ADP-葡萄糖的生成。本研究中,glgC在火龙果果肉转色期的表达量最高,幼果期的表达量次之,成熟期的表达量较幼果期的略低。推测ADP-葡萄糖在火龙果果肉转色期生成最多,幼果期次之,成熟期ADP-葡萄糖的生成略低于幼果期ADP-葡萄糖的生成。
淀粉合酶(glgA)在淀粉合成中起关键作用。glgA是一种转糖基酶,在马铃薯[22]、荸荠[23]、小麦[24]等上均有研究,但在果树上研究的较少。在火龙果果肉淀粉和蔗糖代谢过程中,ADP-葡萄糖在glgA的催化下,生成直链淀粉,直链淀粉在1,4-α-葡聚糖分支酶(GBE1)催化作用下生成淀粉。glgA的表达影响着glgA的活性及淀粉的合成。本研究表明,在火龍果果肉成熟过程中,glgA的表达量总趋势是先降低后升高,在成熟期时表达量达到高峰。说明在火龙果3个不同果肉发育期均有淀粉的合成,其中以成熟期合成淀粉最多。
β-葡萄糖苷酶是一种水解酶,为纤维素降解过程中的限速酶[25]。在火龙果果肉淀粉和蔗糖代谢过程中,β-葡萄糖苷酶主要催化纤维糊精生成纤维二糖,纤维二糖再次在β-葡萄糖苷酶的催化作用下生成葡萄糖;另外,β-葡萄糖苷酶还可催化β-D-葡萄糖苷生成葡萄糖。Cluster-12747.5831的表达影响着β-葡萄糖苷酶的活性及葡萄糖的合成。本研究表明,Cluster-12747.5831在幼果期的表达量最高,转色期的表达量降至最低,成熟期表达量高于转色期的表达量。这与段朝瑞等[26]以玫瑰香葡萄果肉为研究对象,在其不同成熟时期的VvBG1(β-葡萄糖苷酶基因)的表达趋势相似。
蔗糖合酶具有分解和合成蔗糖的作用[27],既可催化蔗糖合成又可催化蔗糖分解,是植物蔗糖代谢的关键酶。在火龙果果肉淀粉和蔗糖代谢途径中,蔗糖在蔗糖合酶的分解作用下生成UDP-葡萄糖、D-果糖;UDP-葡萄糖在蔗糖合酶的合成作用下生成蔗糖。Cluster-12747.16617的表达影响着蔗糖合酶的活性及蔗糖的分解和合成。张春华等[28]研究桃果实不同发育时期蔗糖合成酶基因表达情况,结果表明:花后45~65 d,蔗糖合成酶基因表达量略微提高,85 d时,表达量下降至最低,105 d时,表达量迅速提高。本研究表明,Cluster-12747.16617在火龙果果肉幼果期和转色期的表达量最高且一致,成熟期降低。这可能是由于不同种或火龙果为非跃变型果实的的原因。推测幼果期和转色期的果肉中以蔗糖合成为主,成熟期的果肉中以分解蔗糖为主。
综上所述,在火龙果果肉淀粉和蔗糖代谢途径中,5个基因在3个果肉发育时期的表达情况各不相同。UGP2、glgC在淀粉和蔗糖代谢途径的早期阶段发挥作用,为淀粉和蔗糖的合成提供中间产物;glgA调控淀粉的合成;Cluster-12747. 5831调控葡萄糖的合成;Cluster-12747.16617调控蔗糖的分解和合成。
参考文献
[65] 王 壮, 王立娟, 蔡永强, 等. 火龙果营养成分及功能性物质研究进展[J]. 中国南方果树, 2014, 43(5): 25-29.
[66] 蔡永强, 向青云, 陈家龙, 等. 火龙果的营养成分分析[J]. 经济林研究, 2008, 26(4): 53-56.
[67] 吴小梅, 张 昕, 李南羿. 双孢蘑菇子实体不同发育时期的转录组分析[J]. 菌物学报, 2017, 36(2): 193-203.
[68] 涂美艳, 李明章, 孙淑霞, 等. 红肉猕猴桃果实发育期不同果肉部位比较转录组分析[J]. 分子植物育种, 2019, 17(3): 729-738.
[69] 张 雪, 唐铭浩, 陈 蒙, 等. 山葡萄不同着色时期果皮转录组测序分析[J]. 果树学报, 2017, 34(7): 781-789.
[70] 陆 涵. 低温胁迫下火龙果生理响应特征及转录组差异基因分析[D]. 成都: 四川农业大学, 2017.
[71] 齐 钊, 闫 臻, 徐 敏, 等. 火龙果干旱胁迫下根和茎的基因差异表达[J]. 热带生物学报, 2018, 9(3): 320-327.
[72] 闫 臻, 齐 钊, 熊 睿, 等. 火龙果根系在淹水胁迫下的基因差异表达[J]. 热带生物学报, 2018, 9(3): 312-319.
[73] Nong Q D, Zhang M Y, Chen J T, et al. RNA-seq de novo assembly of red pitaya (Hylocereus polyrhizus) roots and differential transcriptome analysis in response to salt stress[J]. Tropical Plant Biology, 2019, 12(2): 55-66.
[74] 曾灿彬, 徐 敏, 齐 钊, 等. 火龙果果肉颜色相关MYB转录因子的表达分析[J]. 热带生物学报, 2017, 8(2): 153-158.
[75] 吳亚维, 徐 娟, 韩秀梅, 等. 红白果肉颜色火龙果果肉转录组分析和基因功能注释[J]. 分子植物育种, 2019, 17(2): 400-410.
[76] 郑乾明, 王 壮, 蔡永强, 等. 红肉火龙果(Hylocereus polyrhizus)果实与茎转录组测序分析[J]. 分子植物育种, 2019, 17(1): 55-64.
[77] Xi X, Zong Y, Li S, et al. Transcriptome analysis clarified genes involved in betalain biosynthesis in the fruit of red pitayas (Hylocereus costaricensis)[J]. Molecules, 2019, 24(3): 445.
[78] Xu M, Liu C L, Luo J, et al. Transcriptomic de novo analysis of pitaya (Hylocereus polyrhizus) canker disease caused by
Neoscytalidium dimidiatum[J]. BMC Genomics, 2019, 20(1): 10.
[79] Grabherr M G, Haas B J, Yassour M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome[J]. Nature Biotechnology, 2011, 29(7): 644-652.
[80] Davidson N M, Oshlack A. Corset: enabling differential gene expression analysis for de novo assembled transcriptomes[J]. Genome Biology, 2014, 15(7): 410.
[81] Seppey M, Manni M, Zdobnov E M. BUSCO: assessing genome assembly and annotation completeness[J]. Methods in Molecular Biology, 2019, 1962: 227-245.
[82] Li B, Dewey C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics, 2011, 12: 323.
[83] Young M D, Wakefield M J, Smyth G K, et al. Gene ontology analysis for RNA-seq: accounting for selection bias[J]. Genome Biol, 2010, 11(2): R14.
[84] Mao X, Cai T, Olyarchuk J G, et al. Automated genome annotation and pathway identification using the KEGG Orthology (KO) as a controlled vocabulary[J]. Bioinformatics, 2005, 21(19): 3787-3793.
[85] 崇慧影, 文晓鹏. 发育期火龙果内参基因的筛选和验证[J]. 生物技术, 2019, 29(1): 39-45, 56.
[86] 石 瑛, 王金明, 唐宏亮, 等. 马铃薯块茎淀粉合成酶基因表达与淀粉积累[C]//中国作物学会马铃薯专业委员会, 马铃薯产业与健康消费. 哈尔滨: 黑龙江科学技术出版社, 2019: 342-343.
[87] 俞梅珍. 荸荠颗粒结合型淀粉合成酶基因的克隆与表达分析[D]. 扬州: 扬州大学, 2017.
[88] 谭彩霞. 小麦籽粒淀粉合成酶基因表达与淀粉合成的关系[D]. 扬州: 扬州大学, 2009.
[89] 王国泽, 方 杰, 王志国, 等. 地稍瓜β-葡萄糖苷酶和多聚半乳糖醛酸酶基因克隆[J]. 内蒙古科技大学学报, 2019, 38(4): 327-330.
[90] 段朝瑞, 陈 佩, 张国军, 等. 葡萄成熟过程中生理特征与β-葡萄糖苷酶基因的表达分析[J]. 中国农业大学学报, 2013, 18(2): 50-55.
[91] 王永章, 蒋家慧, 李培环, 等. 肉质果实碳水化合物代谢及调控研究进展[J]. 莱阳农学院学报, 2001, 18(4): 288-296, 279.
[92] 张春华, 俞明亮, 马瑞娟, 等. 桃不同发育时期主要糖类含量和蔗糖合成酶基因表达水平的动态变化[J]. 江苏农业学报, 2014, 30(6): 1456-1463.
责任编辑:黄东杰

