高密度悬浮转染方式高效获得重组杆状病毒
尹坤,王同燕,宋欢欢,白露露,李胜强,谭菲菲,田克恭,3*
(1. 国家兽用药品工程技术研究中心,河南 洛阳 471003;2. 普莱柯生物工程股份有限公司,河南 洛阳 471003;3. 洛阳普泰生物技术有限公司,河南 洛阳 471003)
杆状病毒表达载体系统(Baculovirus expression vector system, BEVS)是近年来被广泛用于高效表达外源蛋白的载体系统,为重组蛋白单体、多聚体蛋白复合物、病毒样颗粒、膜蛋白以及对哺乳动物细胞有毒的蛋白提供了通用的表达平台,广泛应用于医学、农学和兽医学等各个领域[1]。相对于原核、酵母和CHO等表达系统,BEVS具有一定优势:杆状病毒专一寄生于无脊椎动物,安全性高;可对重组蛋白进行正确折叠和翻译后修饰,获得具有生物活性的蛋白;适应于多基因表达如病毒样颗粒 (virus-like particle) 的复杂设计;适用于大规模无血清培养等[2-6]。在实际生产过程中,贴壁转染获得的P0代重组病毒滴度低,需要进一步病毒扩繁来获得高滴度的重组病毒,但由于重组杆状病毒在传代过程中基因组存在不稳定性,在重组病毒扩繁中会导致目的基因片段的丢失,成为重组杆状病毒产品产业化过程中的限制因素之一[7-8]。将传统贴壁转染方式获得的P0代重组病毒传代放大,使重组病毒滴度与外源蛋白表达均达到最优,此过程需要12~20 d传代周期[9]。
本研究利用ExpiFectamineTMSf Transfection Reagent和ExpiSf9对重组Bacmid进行高密度悬浮转染,可在6~10 d内获得足量、高病毒滴度和高表达量的低代次重组杆状病毒,为利用重组杆状病毒表达外源蛋白的产业化生产提供了一条可行的路径。
1 材料与方法
1.1 试验材料
ExpiSf9细胞、Sf-900TMⅡ SFM、Opti-MEM、DAB Kit、ExpiFectamineTMSf Transfection Reagent、CellfectinTMⅡ Reagent、HRP标记羊抗鼠IgG均购自于赛默飞世尔科技(中国)有限公司;NC膜购自上海生工;细胞板、细胞瓶购自康宁公司;台盼蓝细胞染色液购自于西格玛奥德里奇(上海)贸易有限公司;表达猪细小病毒VP2蛋白的重组Bacmid、Sf9细胞和猪细小病毒多克隆抗体由国家兽用药品工程技术研究中心制备并保存。
1.2 表达猪细小病毒VP2重组杆状病毒拯救
1.2.1 悬浮转染
将悬浮Expisf9细胞稀释至密度为2.50×106个/mL,置于27~28 ℃振荡培养箱备用;取120 μL ExpiFectaminTMSf Transfection Reagent加入到1 mL opti-MEM无血清培养基中,颠倒混匀10 次,室温静置5 min,然后加入50 μg含有猪细小病毒 VP2基因的重组 Bacmid,轻柔混匀10次,室温孵育5 min后,将混合液加入到100 mL 准备好的Expisf9细胞中,在27~28 ℃条件下继续培养;转染后24、48、72、96和120 h,分别取悬浮细胞100 μL,与0.4%的台盼蓝等体积混匀,使用细胞计数仪进行细胞密度和细胞活率的监测,待悬浮转染细胞活率降至70%~80%时,收获重组杆状病毒,并记为P0代。
1.2.2 贴壁转染
6孔板中每孔接种Sf9细胞0.9×106~1×106个,室温静置30 min~1 h;取8 μL CellfectinTMⅡ Reagent 加入到100 μL Sf-900TMⅡ SFM中并充分混匀,取3 μg含有猪细小病毒 VP2基因的重组Bacmid加入到另一管100 μL Sf-900 Ⅱ SFM培养基中并充分混匀;将上述两管合并混匀,置于室温静置孵育15~30 min;孵育结束后将混合液轻柔加入到细胞培养液中,置于27~28 ℃条件下继续培养,转染3~5 h后换为含有10%血清的昆虫细胞培养基,继续放入27 ℃培养箱继续培养;转染后每天观察细胞状态,待细胞出现明显病变时收获P0代重组杆状病毒。
1.3 重组杆状病毒P0代滴度测定
将两种转染方式收获的P0代重组杆状病毒10倍梯度稀释后,分别接种于铺有Sf9细胞的96孔板,每孔6.5×104个细胞,27 ℃培养箱吸附1 h后,换为甲基纤维素的半固体培养基继续培养43~48 h,吸弃半固体培养基,80%丙酮固定细胞后加入杆状病毒囊膜蛋白gp64的单克隆抗体,孵育1 h后洗3 次,然后加入HRP标记的羊抗鼠二抗孵育1 h,最后通过底物显色,在显微镜下对出现蓝色斑点的数量进行统计,计算不同转染方式获得的P0代重组杆状病毒滴度(PFU/mL)。
1.4 P0代重组杆状病毒的蛋白表达鉴定
将不同转染方式获得的P0代重组杆状病毒培养物进行超声破碎4 ℃,12 000 r/min,离心10 min,取上清进行SDS-PAGE、Western blot等鉴定。SDS-PAGE和Western blot的具体步骤为:制备电泳样品进行SDS-PAGE,同时将蛋白转印至NC膜上,以鼠源猪细小病毒多抗血清按照 1∶1 000稀释后作为一抗,37 ℃ 孵育1 h,PBST 洗涤后,使用HRP标记羊抗鼠IgG(1∶5 000稀释)作为二抗,孵育1 h,使用DAB显色试剂盒避光显色2 min,终止显色后分析蛋白的反应性。
1.5 重组杆状病毒传代及HA效价测定
将收获的P0代重组杆状病毒以体积比1∶100接种Sf9细胞,接种72 h待细胞病变明显时,收获上清即为P1代重组杆状病毒毒种,按照此方法依此获得P2~P5代重组杆状病毒,对P0~P5代重组杆状病毒表达猪细小病毒VP2的HA效价进行测定。
HA效价测定具体方法为:在96孔V型微量反应板每孔均加25 μL PBS,吸取25 μL离心,上清加入第1孔混匀;从第1孔吸取25 μL混合液加入第2孔混匀,依次倍比稀释,最后一孔不加抗原作为空白对照,每孔加入25 μL 0.5%豚鼠红细胞悬液,轻轻震荡均匀,室温静置1 h后观察结果。在空白对照成立的条件下,以出现100%凝集的最高稀释倍数为HA效价。
2 结果
2.1 不同转染方式对细胞增殖及细胞活率的影响
提取的PPV VP2 Bacmid分别进行贴壁转染Sf9或高密度悬浮转染ExpiSf9细胞,使用细胞计数仪对细胞数和细胞活率进行统计,结果如图1和图2所示。转染后第3天ExpiSf9细胞密度由初始的2.50×106个/mL增加至6.53×106个/mL,并在转染后第4天达到至7.47×106个/mL,且细胞活率都保持在95% 以上。在转染后第3天,Sf9细胞的细胞密度增加到0.95×106个/mL,细胞活率同样保持在95%以上,但转染第4天后细胞密度下降至0.76×106个/mL,活率也下降至89.2%。通过对比不同转染方式后细胞密度和活率变化,结果表明,无论使用Cellfectin Ⅱ Reagent 对Sf9细胞进行贴壁转染,还是ExpiFectamineTMSf Transfection Reagent对ExpiSf 9进行悬浮转染后细胞数量依然在进行生长,表明转染试剂并没有对细胞增殖造成伤害。
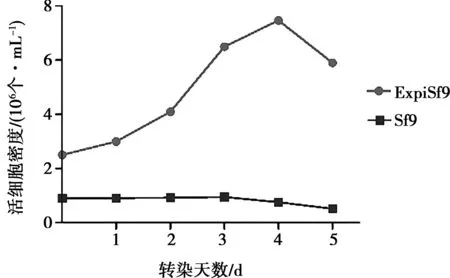
图1 悬浮或贴壁转染对细胞密度的影响

图2 不同转染方式细胞活率变化
2.2 不同转染方式对P0代重组杆状病毒滴度的影响
对贴壁转染Sf9和高密度悬浮转染ExpiSf9获得的P0代重组病毒进行病毒滴度测定,使用针对杆状病毒gp64抗体作为一抗,测定结果如图3所示。贴壁转染方式P0代病毒滴度为1.8×107PFU/mL,而悬浮转染ExpiSf9 获得的P0代病毒滴度为1.2×108PFU/mL,高密度悬浮转染方式获得的P0代重组杆状病毒滴度要明显高于贴壁转染方式。
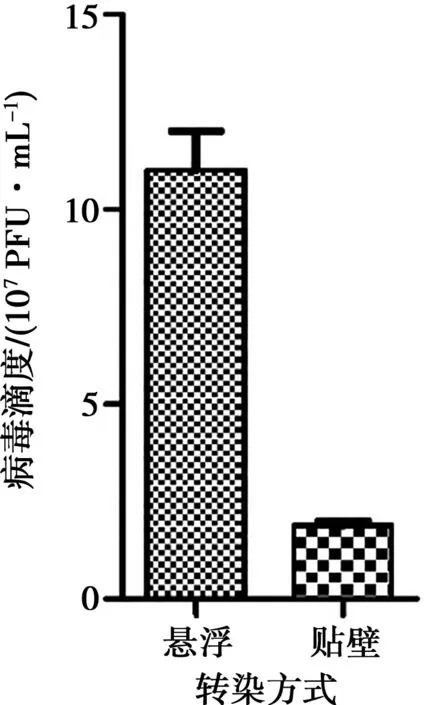
图3 不同转染方式获得的P0重组病毒滴度
2.3 不同转染方式对P0代重组杆状病毒蛋白表达量的影响
对不同转染方式收获的P0代重组杆状病毒进行VP2蛋白表达鉴定,通过SDS-PAGE和Western blot分别检测外源蛋白的表达情况。SDS-PAGE鉴定表明不同转染方式获得的重组杆状病毒均有条带,大小与预期蛋白大小(65 kDa)一致。高密度悬浮转染获得的P0代重组杆状病毒所表达的VP2蛋白量要高于贴壁转染所获得的重组蛋白量(图4)。Western blot鉴定结果如图5所示,两种P0代重组杆状病毒表达的猪细小病毒VP2蛋白均能够与鼠源猪细小病毒多抗血清反应,表明重组PPV VP2蛋白具有良好反应原性。

M.蛋白分子标准质量;1.Sf9细胞对照;2.贴壁转染获得的PPV VP2蛋白;3.高密度悬浮转染获得的PPV VP2蛋白

M.蛋白分子标准质量;1.Sf9细胞对照;2.贴壁转染获得的PPV VP2蛋白;3.高密度悬浮转染获得的PPV VP2蛋白
2.4 不同转染方式对不同代次病毒外源蛋白HA效价的影响
对收获的贴壁转染和高密度悬浮转染获得的P0代重组杆状病毒,分别传代至P5代,测定P0~P5代重组杆状病毒表达PPV VP2的HA效价。不同代次重组PPV VP2 蛋白的HA效价变化如图6所示。相对于贴壁转染方式,悬浮转染获得的P0代和P1代重组病毒,所表达的重组PPV VP2、HA效价提高极显著(P<0.01)获得的P0代重组病毒,高密度悬浮转染获得的P0代重组病毒接种Sf9细胞表达的重组PPV VP2蛋白的HA效价提高8倍,且高密度悬浮转染获得重组病毒通过传代获得的P1~P5代表达的重组PPV VP2 HA效价均较高,P1代就能达到19 log2,而贴壁转染方式获得的重组病毒需要传至P3代时才能达到此水平。
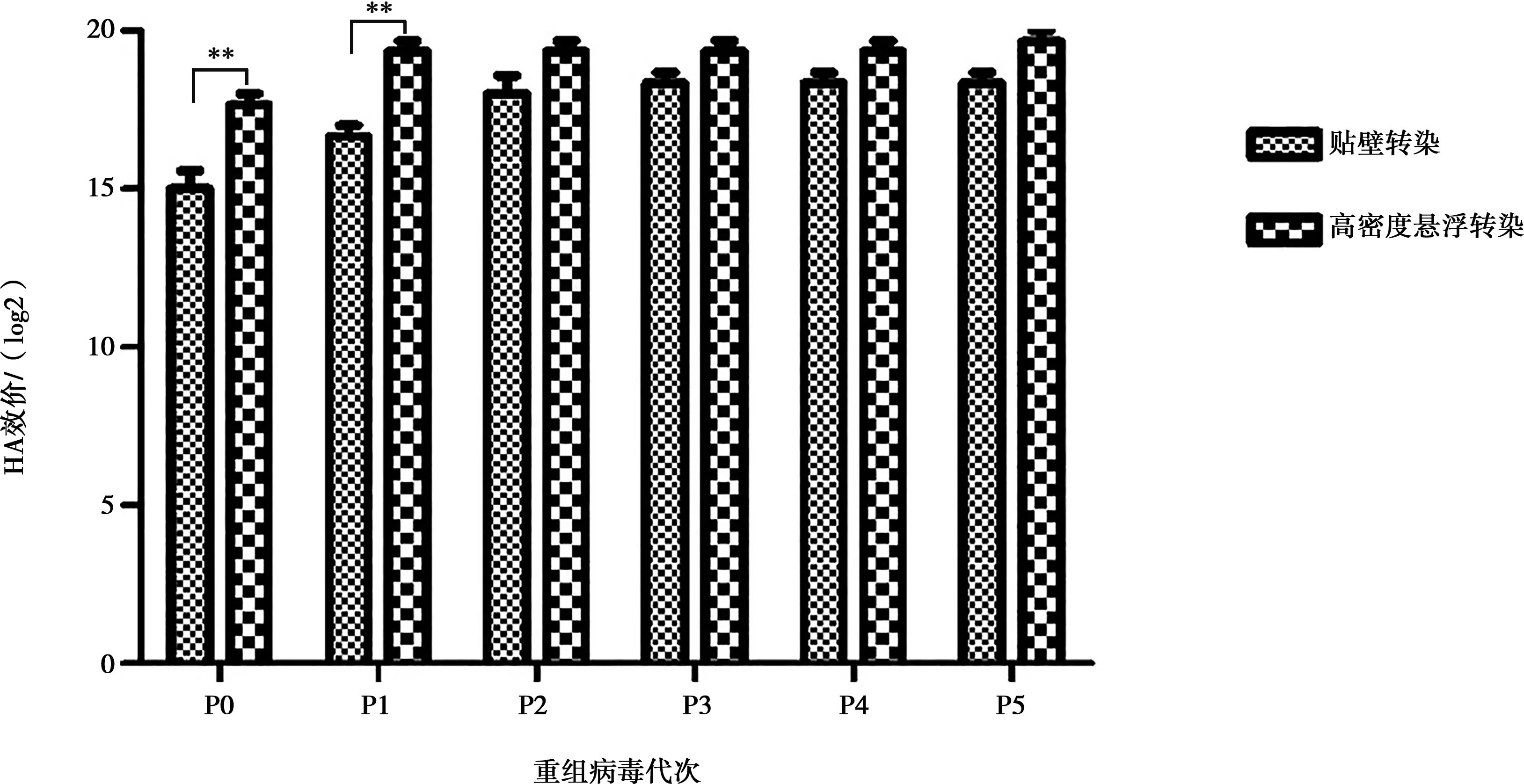
**差异极显著,P<0.01
3 讨论
杆状病毒表达系统具有外源基因容量大、翻译后修饰功能、生物安全性好、体外培养简单等特点,被广泛地应用于不同物种来源的重组蛋白的表达[10-11]。目前使用昆虫细胞体外培养是获得大量重组杆状病毒简便有效的方法,常采用重组Bacmid贴壁转染Sf9细胞以获得重组杆状病毒,但由于贴壁Sf9细胞数量有限,且获得的P0代重组杆状病毒体积较小病毒滴度较低,需要多次传代才能到达所需的体积和病毒滴度,然而,重组杆状病毒在连续生产或按比例扩繁过程中会形成和积累DI(defective interfering particle,DI)颗粒,这些不能自主复制的缺陷干扰颗粒的基因组比例缺失高达40%[12-14]。随着缺陷型重组杆状病毒在摇瓶培养/或生物反应器中的连续传代,占比逐渐增加,结果导致外源蛋白产量下降[7,15]。因此,采用传统的转染方法,对于实验室进行蛋白表达可能不受影响,但对于重组杆状病毒产品的产业化仍然存在问题。
为了减少由于DI颗粒的产生导致外源蛋白表达量降低的影响,近些年来科学家们不断对载体进行基因改造以期望获得更加稳定的杆状病毒载体,同时也在不断的进行培养基改良,生物反应器的使用以及工艺方面的优化等多方面的努力,为后续产业化生产奠定理论和实践基础。我们在实际生产过程也尝试多种优化方案,其中包括高密度悬浮转染,这种转染方式获得的低代次高滴度的重组杆状病毒,便于在后续使用过程中以低感染复数进行感染,可以减少传代效应对外源蛋白表达量的影响。在当前无法完全克服由于传代产生DI颗粒,并导致外源蛋白表达量大幅度降低的条件下,选择高密度悬浮转染在低代次提供足量种子批,为后续生产提供保障,为产业化生产提供了一条可行的路径。

