酸碱中和滴定曲线解析
魏凤琴
(河北省秦皇岛市北戴河中学 066100)
一、典例分析
例1常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液所得滴定曲线如图1所示.下列说法正确的( ).

图1
A.由图可知HA是强酸
B.点②所示溶液中:c(Na+)=c(HA)+c(A-)
C.水的电离程度:①>②>③
D.点①所示溶液中:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
解析本题答案为D.由题干可知,假如一元酸HA为强酸,则其pH应等于1,而图像显示,曲线起点的pH=3,所以HA为弱酸,A选项不正确;通过观察图像的横、纵坐标还可得出,曲线上②点的pH=7,是中性点,③点为酸碱滴定终点,是中和点,①点为酸被中和一半的点,属一半点,且③点溶质为NaA,其物料守恒式为c(Na+)=c(HA)+c(A-),②点溶质为HA和NaA的混合物,故B选项不正确;①点溶质为HA和NaA(物质的量的比为1∶1)且pH<7,说明HA的电离程度大于NaA中A-的水解程度,此点抑制水的电离,而③点促进水的电离,②点对水的电离既不促进也不抑制,所以C项不正确,由①点的溶质及pH,可判断出D项正确.
例225℃时,进行如图2所示滴定并得到对应曲线(如图3所示).下列说法错误的是 ( ).

图2 图3
A.Ka2(H2C2O4)=10-4.19
C.Ⅰ、Ⅱ两条直线的斜率均为1
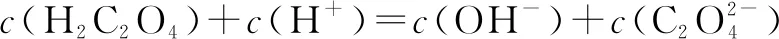
解析答案为B,解决本题的关键是利用好Ⅰ、Ⅱ两条直线与pH轴的两个交点.
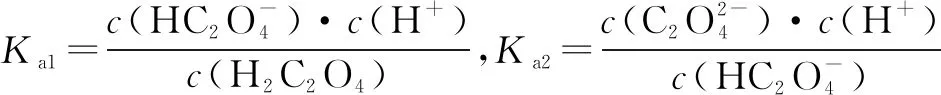
例3将 0.1 mol·L-1的硫酸溶液滴加到体积为VmL,物质的量浓度为0.1 mol·L-1氨水中.随着所加硫酸溶液体积的变化,混合溶液的温度和pOH[pOH=-lgc(OH-)]的变化曲线如图4所示(实线为温度变化曲线,虚线为pOH变化曲线),下列说法不正确的是( ).
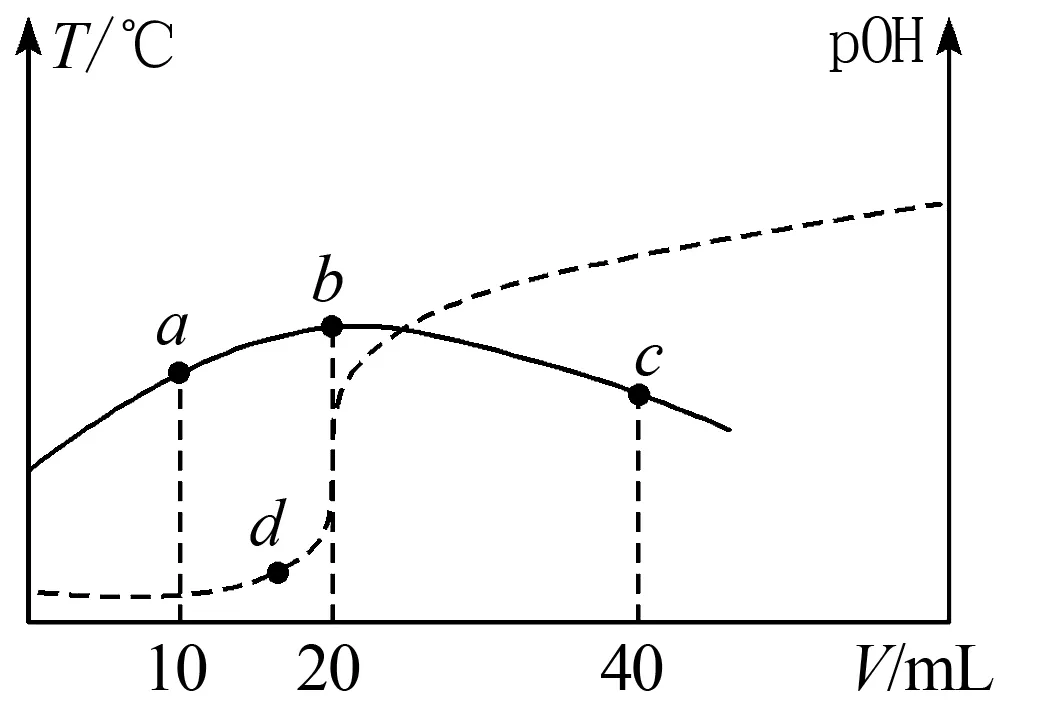
图4
A.V=40
B.b点时溶液的pOH>pH
C.c、b、a三点由水电离的c(OH-)依次增大
D.a、d、b各点对应NH3·H2O的电离常数:K(a) 解析答案为C,本题的关键是利用好曲线的拐点b,因为b点时溶液的温度最高,表明此时酸碱恰好反应完全,因1 mol H2SO4与2 mol NH3·H2O完全反应,可求氨水体积V=40,A正确;B项,b点恰好完全反应生成(NH4)2SO4,溶液呈酸性,c(H+)>c(OH-),所以pH 图5 A.Ka1(H3PO4)=1.0×10-2.1 通过以上分析,可得出解决酸碱中和滴定曲线的一般思路和方法:首先,要关注题干和图像的横、纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次,要充分利用好常见的特殊点:如利用起点可看出酸性或碱性的强弱,这在判断滴定终点时至关重要;利用滴定终点(中和点)、pH=7的点(中性点)、酸碱中和一半的点(一半点)、过量点、曲线的交点及拐点等,可准确判断溶液的酸碱性、比较微粒浓度的大小、计算电离常数和水解常数、列出电荷、物料及质子守恒式等;再次,要明确酸碱滴定过程中的定量关系:①电荷守恒关系在曲线的任何点均存在,②物料守恒可以根据所加酸或碱的物质的量进行确定,但不一定为等量关系;③质子守恒式可根据某点的电荷守恒式和物料守恒式经过变换,消去不水解的离子得出.



二、方法整合

