铜绿假单胞菌噬菌体的分离筛选和体内外抗菌活性研究*
陈全顺,陈向东,汪 辉,杨 景,强俊磊,田宇航,李弘远,蒲培熙
中国药科大学 生命科学与技术学院,南京211198
铜绿假单胞菌一直是医院感染的主要致病菌,该病原体高水平耐药性严重威胁人类生命健康。噬菌体是特异性感染细菌的活病毒,也是地球上数量最多的生物体[1],具有裂解耐药菌、杀菌特异性强、对人体无副作用等独特性的优势[2],可能成为治疗耐药菌感染的新型抗菌剂。
本实验以临床分离的铜绿假单胞菌为宿主菌,从污水土壤样品中分离筛选出强裂解性宽谱噬菌体进行生物学特性和体外抗菌活性分析,并进一步探索其治疗小鼠全身感染的效果,为深入研究噬菌体应用于铜绿假单胞菌感染奠定基础。
1 材 料
1.1 样品和菌株
污水和土壤样品采集于南京市江宁区自然环境。铜绿假单胞菌(Pseudomonas aeruginosa)由广州南方医院临床检验室提供,大肠埃希菌ATCC25922由中国药科大学微生物学教研室提供。
1.2 实验动物
18~20 g 清洁级ICR 雌性小鼠,购买于扬州大学比较医学中心,生产许可:SCXK(苏)2017-0007,由中国药科大学动物实验中心饲养。
1.3 主要试剂和仪器
营养肉汤培养基NB、琼脂粉、MHA 培养基(北京三药科技有限公司);上层和下层培养基为NB 中分别添加0.7%和1.5%琼脂;SM 缓冲液参照文献[3]配制;药敏纸片(温州市康泰生物技术有限公司)。
高速低温离心机(Thermo 公司);酶标仪(美国Bio-Rad 公司);GHX-9080B 恒温培养箱(上海福玛实验设备有限公司);数显恒温水浴锅(国华电器有限公司);振荡培养箱(上海知楚仪器有限公司);高压灭菌锅(日本Hirayama 公司);JEM-1400 透射电子显微镜(日本电子株式会社)。
2 方 法
2.1 噬菌体的分离筛选
2.1.1 药敏纸片法筛选临床耐药菌过夜培养的菌液(铜绿假单胞菌和大肠埃希菌)用无菌生理盐水稀释到浓度为0.5 号麦氏比浊管,棉拭子沾取菌液,均匀涂布整个MHA 培养基表面,室温静置3 min,用无菌镊子夹取药敏纸片贴在培养基表面,每个平皿贴5 片,培养16~20 h,测量抑菌圈直径。
将筛选到的铜绿假单胞菌的耐药菌株培养到对数生长期,各取3 mL 培养液混匀,作为分离噬菌体的混合菌液。
2.1.2 噬菌体的分离纯化采集的污水和土壤样品充分混匀,300 mL 的样品混合液与NB 培养基干粉混合,加入新鲜的铜绿假单胞菌混合液,37 ℃、30 r·min-1轻微振荡培养24 h,此步为噬菌体的富集培养。富集培养液8000 r·min-1离心10 min,上清液用0.22 μm 过滤器过滤除菌,滤液用SM 缓冲液倍比稀释。双层平板法[4]进行噬菌体的分离纯化,在上层培养基中加入适宜稀释梯度的滤液与铜绿假单胞菌菌液各0.2 mL,混匀后倾倒于下层培养基,倒置培养。次日挑取单个噬菌斑于SM 缓冲液,4 ℃冰箱静置过夜,稀释后作双层平板,重复挑单斑3~5 次纯化噬菌体。
2.1.3 噬菌体的筛选采用斑点法[5]筛选强裂解性噬菌体,取0.2 mL 菌液与上层培养基充分混匀,倾倒于下层培养基,凝固后滴加5 μL 噬菌体液,37 ℃培养。次日,滴有噬菌体处无菌生长且清晰透亮的即为强裂解性噬菌体。另外接种40 株铜绿假单胞菌作为指示菌,斑点法测定裂解谱。
2.2 噬菌体的主要生物学特性
2.2.1 透射电镜观察噬菌体纯化后的高滴度噬菌体悬液(109~1010PFU·mL-1)滴在覆有碳膜的铜网上,2%(w/v)磷钨酸(pH7.2)进行负染色,电镜观察并采集图像。
2.2.2 热稳定性和pH 稳定性检测噬菌体在不同温度下的稳定性,取0.5 mL 噬菌体液于35 ℃、45 ℃、55 ℃、65 ℃、75 ℃孵育1 h,每个温度作3 组重复,双层平板法计数噬菌斑。
检测噬菌体在不同pH 值下的稳定性,将NB培养液调至不同pH 值(2、4、6、7、8、10、12),过滤除菌,与0.1 mL 噬菌体液混匀,每个pH 值作3 组重复,37 ℃孵育1 h,双层平板法计数噬菌斑。
2.2.3 最佳感染复数和一步生长曲线将宿主菌培养至对数生长期,按照感染复数为0.001、0.01、0.1、1、10 比例分别加入噬菌体和宿主菌,每个比例3 组重复,摇床培养3 h,离心取上清液测滴度,产生最高噬菌体滴度的比例为最佳感染复数(the optimal multiplicity of infection,MOI)。
按最佳感染复数的比例混合宿主菌和噬菌体,37 ℃孵育15 min 后,离心弃上清液,沉淀物洗涤两次再重悬沉淀,摇床培养,每间隔10 min 直至120 min取样0.2 mL,离心取上清液测滴度。绘制噬菌体一步生长曲线,计算噬菌体的潜伏期、裂解期、裂解量(平台期噬菌体的滴度/宿主菌初始浓度)。
2.3 噬菌体的体外抗菌活性
宿主菌培养至对数生长期,噬菌体处理组按最佳感染复数的比例加入噬菌体,宿主菌对照组加入等量生理盐水,37 ℃培养,分别在1、2、3、4、5、6、7、8、9、10 h 定时取样检测OD600值,每个时间点3 组重复。
2.4 噬菌体治疗小鼠全身感染的效果
体重为18~20 g ICR 雌性小鼠20 只,随机分为4 组,每组5 只。腹腔注射不同剂量的铜绿假单胞菌Pa24 菌液(2×107、2×108、2×109、2×1010CFU/只),观察小鼠7 天,引起一个组小鼠全部死亡的剂量为最小致死量。
体重为18~20 g ICR 雌性小鼠30 只,随机分为3 组。噬菌体治疗组(13 只):注射最小致死量的铜绿假单胞菌菌液和噬菌体PPa24;模型对照组(13只):注射最小致死量的铜绿假单胞菌菌液和生理盐水;噬菌体对照组(4 只):仅注射噬菌体PPa24。注射最小致死量的菌液5 h 后,噬菌体治疗组和模型对照组随机各选取5 只小鼠,眼眶采血100~200 μL 与肝素混合,梯度稀释后进行平板菌落计数。其余小鼠持续观察7 天,记录每日死亡情况。
2.5 统计分析
3 结果
3.1 噬菌体的分离筛选
3.1.1 临床耐药菌的筛选结果结合《临床实验标准研究所(CLSI)指南》,根据抑菌圈直径,将每株菌的药敏性分为敏感(S)、中介耐药(I)、耐药(R)三个级别,共筛选到27 株铜绿假单胞菌的耐药菌株。本实验分离到噬菌体的3 株铜绿假单胞菌Pa3、Pa24、Pa27 是分离自医院患者伤口感染的病原菌,药敏实验结果如表1 所示,对5 类抗生素表现出不同程度的耐药性。质控菌株大肠埃希菌ATCC25922 形成的抑菌圈符合药敏标准。

表1 抑菌圈直径(mm)和药敏性
3.1.2 噬菌体的分离筛选结果噬菌体的富集培养液与铜绿假单胞菌Pa3、Pa24、Pa27 作双层平板时出现了噬菌斑,说明噬菌体富集培养液中有针对这3 株铜绿假单胞菌的噬菌体。反复挑单斑纯化,获得3 株较纯的噬菌体,分别命名为铜绿假单胞菌噬菌体PPa3、PPa24、PPa27。
噬菌体PPa24 的噬菌斑清晰且边缘整齐,直径0.80~1.21 mm,如图1 所示。斑点法形成的噬菌斑完全清透,如图2 所示,呈现出裂解性噬菌体特征。噬菌体PPa3、PPa24、PPa27 对40 株铜绿假单胞菌的裂解比例分别是2/40、20/40、15/40。综合比对3 株噬菌体的裂解活性和裂解谱,最终选定铜绿假单胞菌噬菌体PPa24 作为下一步研究重点。

图1 双层琼脂平板法形成的噬菌斑(PPa24)

图2 斑点法形成的噬菌斑(PPa24)
3.2 噬菌体的主要生物学特性
3.2.1 噬菌体的微观形态噬菌体PPa24 的形态如图3 所示,有一个正二十面体头部,直径为(75±3)nm,连接长度(220±4)nm 的非可收缩性尾巴。根据国际病毒分类委员会的分类标准,PPa24 属于长尾噬菌体科(Siphoviridae)。

图3 噬菌体PPa24 的电镜图
3.2.2 热稳定性和pH 稳定性噬菌体PPa24 的热稳定性如图4 所示,在35 ℃、45 ℃、55 ℃温度下作用1 h 仍保持初始滴度,能耐受55 ℃的温度,热稳定性较高。PPa24 的pH 稳定性如图5 所示,在pH6~10 条件下滴度不变,甚至在pH 值为12 的强碱条件下依然保持一定的活性,说明其对酸碱度的适应范围较宽。
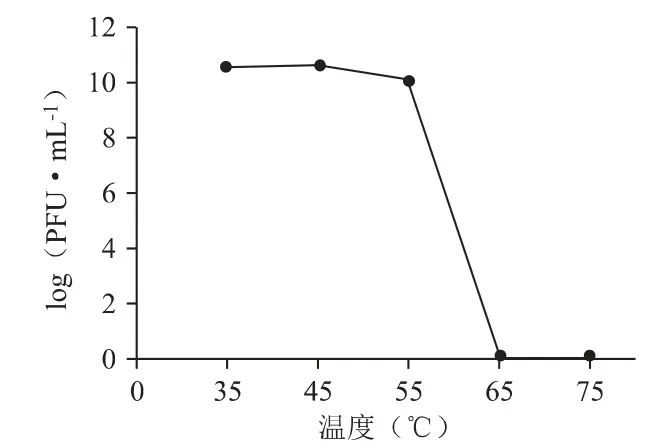
图4 噬菌体PPa24 的热稳定性
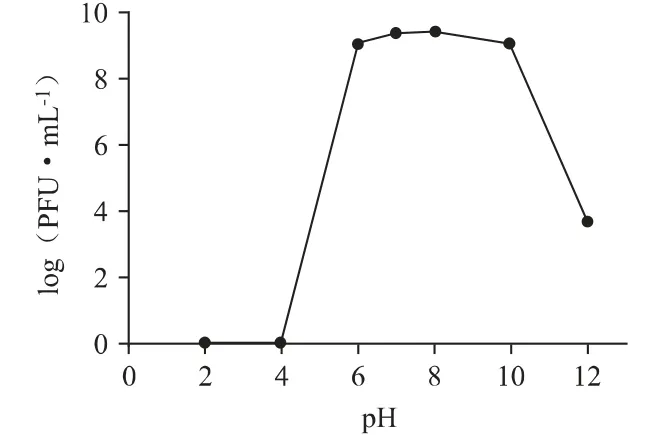
图5 噬菌体PPa24 的pH 稳定性
3.2.3 最佳感染复数和一步生长曲线最佳感染复数测定结果如表2 所示,噬菌体PPa24 以0.1 的比例扩增时,能产生最高滴度的子代噬菌体,其感染宿主菌的最佳感染复数为0.1。一步生长曲线如图6所示,从曲线可知噬菌体PPa24 的潜伏期为20 min,裂解期为70 min,裂解量为62 PFU·cell-1。

表2 噬菌体PPa24 最佳感染复数的测定结果
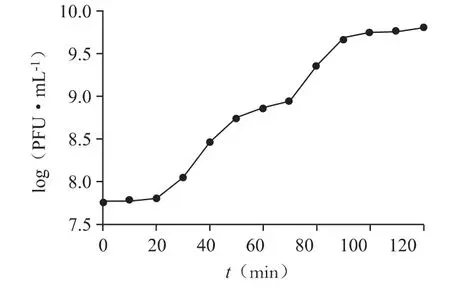
图6 噬菌体PPa24 的一步生长曲线
3.3 噬菌体的体外抗菌活性
噬菌体PPa24 对宿主菌的体外裂解曲线如图7所示,宿主菌对照组的OD600值一直处于上升趋势,菌液逐渐浑浊,而加入噬菌体PPa24 的细菌培养液后,OD600值先保持初始吸光度值,之后有缓和下降的趋势,肉眼可见菌液逐渐澄清,说明噬菌体PPa24大量裂解培养液中的细菌,有效抑制宿主菌的生长。
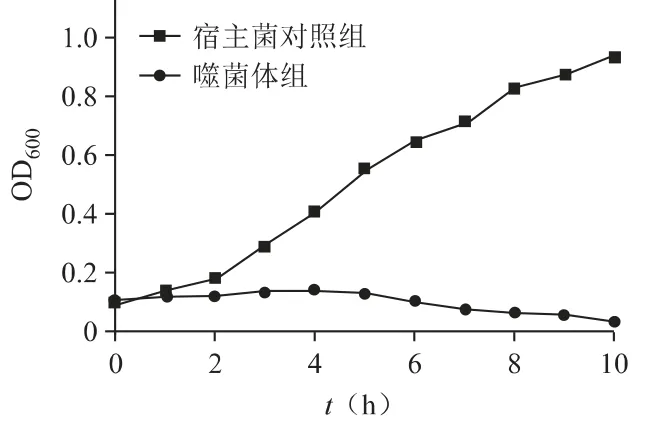
图7 噬菌体PPa24 对宿主菌的裂解曲线
3.4 噬菌体治疗小鼠全身感染的效果
腹腔注射最小致死量的菌液(2×109CFU/只)建立小鼠全身感染模型,感染5 h 后,计数血液载菌量的结果如图8 所示,噬菌体治疗组PPa24 的血液载菌量相对于模型对照组显著降低了约3.8 个对数单位(P<0.01)。小鼠7 天存活率结果如图9 所示,噬菌体治疗组PPa24 的存活率显著提高到75%(P<0.001),模型对照组小鼠全部死亡,噬菌体对照组小鼠全部存活。
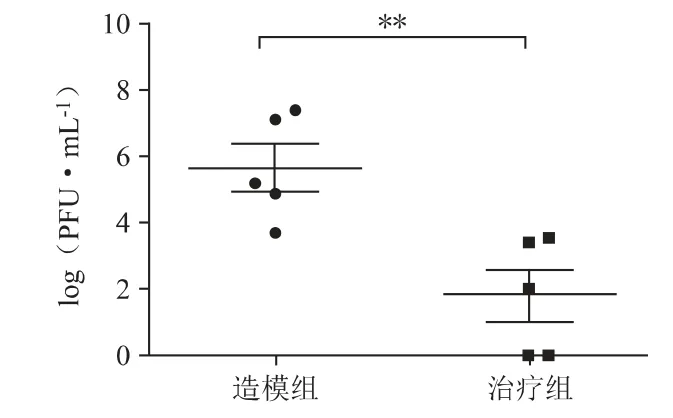
图8 5 h 后的血液载菌量
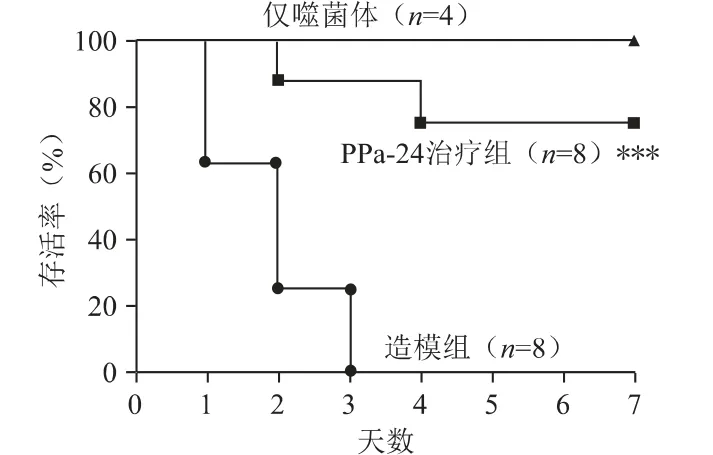
图9 小鼠7 天存活率
4 讨论
铜绿假单胞菌的耐药问题日益严重[6],一方面是由于对多种抗生素固有耐药,另一方面是存在获得性耐药机制,主要包括产生水解酶和主动外排泵等。故迫切需要开发新的治疗手段。噬菌体具有完全不同于抗生素的抗菌机制,控制耐药菌感染有巨大的应用潜力[7]。
从自然资源中成功分离到一株铜绿假单胞菌噬菌体PPa24,噬菌斑清晰透亮,具有裂解性噬菌体的典型特征,对临床分离的铜绿假单胞菌的裂解比例为20/40,比文献[8]报道的铜绿假单胞菌噬菌体的裂解谱更宽(12/27)。PPa24 在35 ℃~55 ℃温度下和pH6~10 条件下作用1 h 仍能保持较好的抗菌活性,文献报道的铜绿假单胞菌噬菌体也在60 ℃温度下基本失活,适宜的酸碱度范围为pH4~9[9]。PPa24 的热稳定性和pH 稳定性与文献报道的基本一致,支持了其在噬菌体治疗中储存和使用的可行性。PPa24 的潜伏期为20 min,裂解量为62,比文献报道的铜绿假单胞菌噬菌体潜伏期(30 min)更短[10],裂解量(20)也更大[11],说明PPa24 裂解宿主菌的速度快且能力强。
噬菌体PPa24 可以明显降低细菌培养液的OD600值,有效抑制宿主菌的生长,这一结果与Dong Z 等[12]报道的噬菌体抑制宿主菌在液体培养基中生长的研究结果相似。PPa24 治疗小鼠全身感染可显著降低血液载菌量,并使小鼠存活率提高至75%,优于文献报道的噬菌体(存活率为40%)的保护作用[13],也有文献报道了噬菌体通过不同给药途径治疗铜绿假单胞菌感染[14],结果显示肌肉注射、皮下注射、腹腔注射的小鼠存活率分别为22%、16%、82%,保护作用最显著的腹腔注射组与噬菌体PPa24 的体内疗效相当。
本实验分离获得的新型噬菌体PPa24 具有较好的生物学特性,在抗击铜绿假单胞菌感染方面初步显示了良好的体内外活性,有望成为治疗铜绿假单胞菌感染的候选噬菌体。