PRRSV HeN-3弱毒株不同途径感染仔猪诱导天然免疫因子差异性比较
孙杨杨,李 闻,赵士杰,苗信永,孔令昊,崔志莹,徐朋丽,陈 雨,张改平,2,陈 静,张宜娜*,夏平安*
(1.河南农业大学 动物医学院,河南 郑州 450002;2.河南农业大学 生命科学学院,河南 郑州 450002)
繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的主要以母猪的繁殖障碍和仔猪的呼吸系统症状为临床特征的传染病[1]。PRRSV感染猪只后诱导产生的免疫抑制[2]、抗体依赖性增强作用[3]和持续感染[4]等现象给PRRS的防控造成了极大的困难,猪场一旦感染,很难彻底消除,潜在危害极大,给养猪业带来极大的损失[5]。
目前有关PRRSV感染仔猪的研究资料表明,强毒株感染仔猪后,病毒血症明显,拷贝数高,诱导猪只产生干扰素的水平低,炎性因子水平高,临床症状及病理变化明显,弱毒株感染仔猪后免疫抑制较弱,猪只临床症状及病理变化不明显[6-9]。然而,对PRRSV经不同途径感染仔猪诱导免疫反应的差异尚未有系统的研究。本课题组前期研究证明PRRSV VR2332弱毒株经滴鼻与注射两种途径感染仔猪,病毒血症出现时间、病毒拷贝数及中和抗体水平都存在一定的差异,注射组病毒血症出现早,病毒拷贝数高,注射组血清中的中和抗体效价也比滴鼻组高,其中和抗体效价最高可达到l∶8,可以对病毒起到一定的中和作用[10]。为了进一步了解PRRSV弱毒株经滴鼻和注射两种途径感染仔猪后诱导天然免疫因子产生的规律及差异,使用本实验室分离保存的弱毒株PRRSV HeN-3,经滴鼻和注射两种途径感染仔猪,通过荧光定量PCR方法检测两种途径感染后血清中病毒拷贝数及外周血淋巴细胞中天然免疫因子IFN-α、TNF-α、IL-1β的相对表达量,通过ELISA Kit 检测血清中干扰素蛋白水平,通过制作肝脏、脾脏、肾脏的病理切片,观察滴鼻与注射两种途径感染仔猪后对机体造成的损伤。
1 材料与方法
1.1 细胞株、病毒毒株和实验动物20日龄健康大白仔猪购自郑州郊区某猪场,其中PRRSV、猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)和圆环病毒2型(PCV2)抗原、抗体均为阴性;Marc-145细胞和PRRSV HeN-3弱毒株均由本实验室保存。
1.2 主要试剂RNA提取和反转录试剂购自北京宝日医生物技术有限公司;外周血淋巴细胞分离液购自北京索莱宝科技有限公司;Porcine IFN-alpha ELISA Kit 购自美国 Sigma 公司;RPIM 1640培养液和DMEM培养液购自北京索莱宝科技有限公司;枸橼酸钠购自国药集团化学试剂有限公司。
1.3 病毒增殖选择生长状态良好的Marc-145细胞,待其长至80%左右的单层后,将适量的PRRSV HeN-3株接种于细胞上,37℃吸附作用1 h后,加入含2%胎牛血清的DEME培养液,于5% CO2、37℃条件下培养至细胞病变达到80%时收获病毒,反复冻融3次,离心收获上清即为病毒液,根据Karber法[11]计算病毒的 TCID50为10-4/100 mL。
1.4 试验设计将 12 头 20 日龄健康仔猪随机分为滴鼻组、注射组和对照组3组,各组之间隔离饲养。将PRRSV HeN-3弱毒株分别以滴鼻和肌肉注射方式感染仔猪(1×106TCID50/头),对照组接种健康Marc-145细胞培养物。分别于感染后0,3,7,11,15,19,23,27,31,35,39,43 d前腔静脉采取抗凝血及凝血,分离外周血淋巴细胞及血清。用ELISA Kit 检测血清中干扰素蛋白水平,用实验室建立的荧光定量方法[12]检测PRRSV的拷贝数和细胞因子IFN-α、TNF-α、IL-1β的mRNA相对表达量。43 d 后剖杀仔猪,取淋巴结等免疫组织检测病毒拷贝数,取肝脏、脾脏、肾脏制作病理切片。
2 结果
2.1 血清中病毒拷贝数检测结果接种前仔猪血液中的病毒核酸常规RT-PCR检测结果均为阴性,滴鼻组于感染后7 d出现病毒血症并持续到15~19 d,在27~31 d再次出现后又迅速消失;注射组于感染后3 d出现病毒血症并持续到19 d,于31 d再次出现后又迅速消失;对照组未出现病毒血症。
滴鼻组于免疫后7 d,注射组于3 d,病毒拷贝数均达到103拷贝/μL。在免疫后15 d病毒拷贝数最高,滴鼻组达到104拷贝/μL,注射组达到105拷贝/μL,之后逐渐降低。滴鼻组、注射组分别于免疫后27,35 d病毒血症消失。病毒血症的变化规律表明注射组比滴鼻组的病毒血症持续时间长并且病毒含量高。病毒含量及增殖规律如图1所示。

图1 不同时间段病毒拷贝数检测结果
2.2 外周血及淋巴细胞中天然免疫因子检测结果
2.2.1IFN-α蛋白水平及mRNA的表达量 IFN-α蛋白水平的检测结果显示,滴鼻组IFN-α 蛋白水平从3 d开始升高,19 d后恢复正常水平,3~15 d显著高于对照组。注射组与滴鼻组变化趋势一致,在3~15 d时注射组的IFN-α水平低于滴鼻组水平且有显著性差异(图2)。
IFN-α相对表达量结果显示,注射组在免疫后3 d 相对表达量迅速降低,之后呈上升趋势,到11 d 时达到最高,随之下降,19 d时显著低于对照组,23 d 后缓慢上升,27 d与对照组的相对表达量趋于同一水平;滴鼻组在免疫后3 d开始下降,7 d降到最低,19 d时达到最高,之后下降在27 d后基本与对照组趋于相平。两组试验结果相比,滴鼻组IFN-α表达量下调持续的时间比注射组长,并且也提前达到最高,在27 d时相对表达量基本在同一水平上(图3)。
2.2.2炎性因子TNF-α mRNA的表达量 滴鼻组TNF-α mRNA表达量在感染后3 d显著升高,在7 d 达到最高,之后虽呈现降低趋势但至15 d都显著高于对照组,19~23 d与对照组趋于相同水平,27~35 d又再次呈现升高趋势,且显著高于对照组,39 d后与对照组趋于相同水平。注射组TNF-α mRNA表达量在感染后变化趋势与滴鼻组相似,只是注射组在3 d就达到最高水平。两种不同途径感染的结果相比,虽变化趋势基本相似,但整体来看,除个别时间段,滴鼻组的表达量一直高于注射组(图4)。
2.2.3炎性因子IL-1β mRNA表达量 滴鼻组IL-1β mRNA表达量在感染后3 d开始升高,7 d达到最高水平,随后降低,15 d时与对照组趋于相同水平。注射组IL-1β mRNA表达量的变化趋势与滴鼻组相似。两种不同途径感染结果相比,虽变化趋势基本相似,但整体来看,升高趋势时段内(3,7 d)滴鼻组的IL-1β mRNA水平高于注射组(图5)。

*.与对照组相比差异不显著(P>0.05);**.与对照组相比差异显著(P<0.05);***.与对照组差异极显著(P<0.01)。下同

图3 试验组IFN-α mRNA转录水平变化
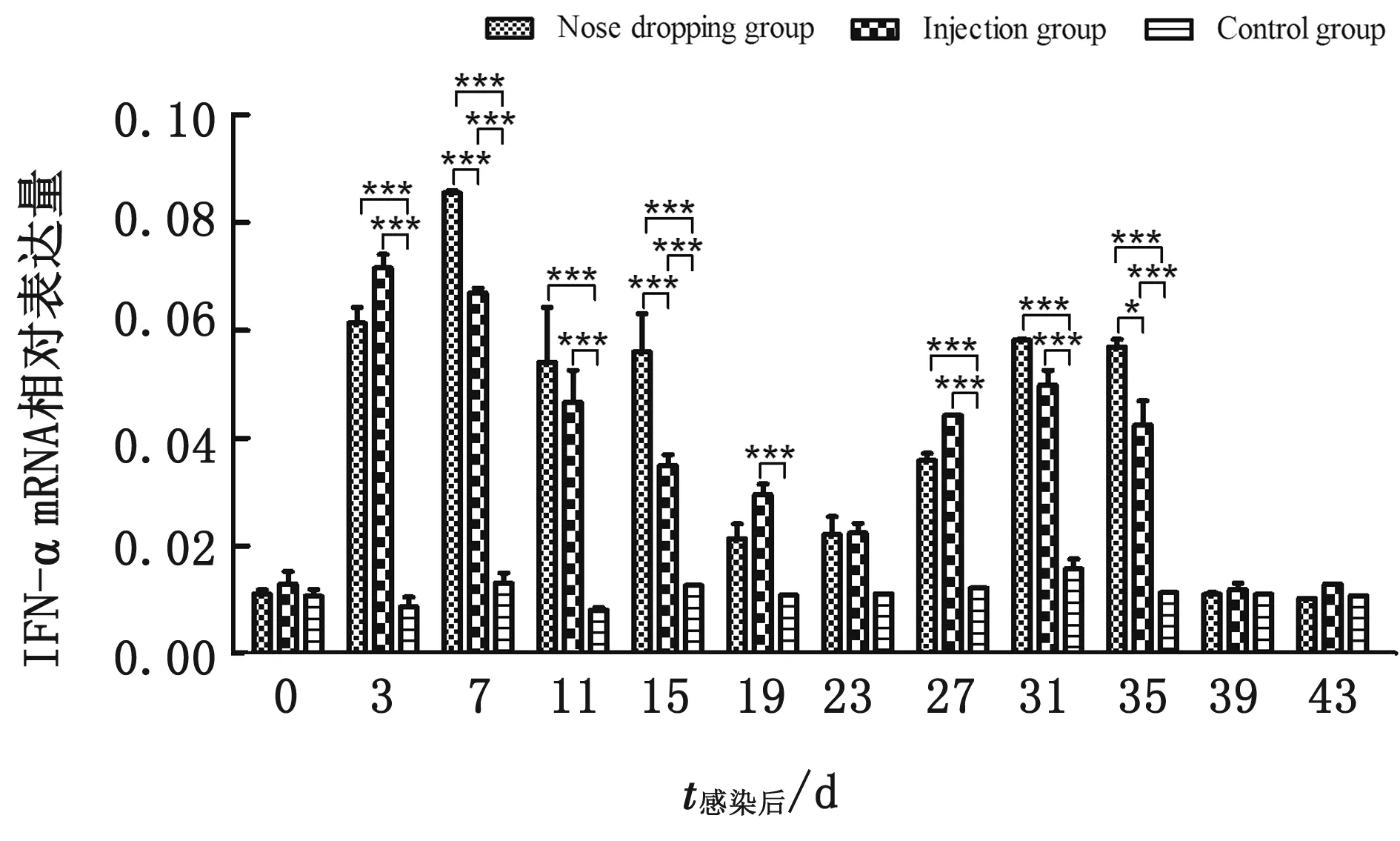
图4 试验组TNF-α mRNA转录水平变化
2.3 组织病理切片结果肝脏病理切片结果显示,滴鼻组肝脏肝索结构清晰,肝细胞排列紧密、着色均匀、界限清晰、形态正常,组织未见明显异常。注射组肝脏肝小叶结构清晰,肝细胞排列紧密,较多肝细胞胞质疏松淡染,部分呈空泡状(黑色箭头)(图6B),局部可见少量炎性细胞浸润(黄色箭头),未见其他明显异常(图6C)。
脾脏病理切片结果显示,滴鼻组脾脏红白髓分界清晰、局部白髓消失、红髓淋巴细胞排列疏松,可见较多椭圆体,未见其他明显异常(图7B)。注射组脾脏红白髓分界清晰,白髓淋巴细胞丰富、排列紧密、红髓结构紧密,可见少量中性粒细胞散在浸润(黑色箭头)(图7C)。

图5 试验组IL-1β的mRNA转录水平变化
肾脏病理切片结果显示,注射组肾脏皮髓质分界清晰,肾小球毛细血管较清晰,肾皮质多见肾小管扩张(黑色箭头),局部肾小管管腔内可见嗜酸性物质(黄色箭头)(图8C)。

A.对照组;B.滴鼻组;C.注射组

A.对照组;B.滴鼻组;C.注射组

A.对照组;B.滴鼻组;C.注射组
3 讨论
整个试验期间,对照组猪只精神状态良好、食欲旺盛,背毛顺滑,两种途径感染后试验组部分猪只除背毛稍显粗乱外,健康状况与对照组基本一致,未呈现明显的病态;有研究表明,分离的野毒株攻毒后仔猪持续高热,精神沉郁,食欲不振,被毛粗乱,猪只消瘦后肢无力[13]。与强毒株相比,本试验中所用的弱毒株的致病力很弱,对仔猪健康和生长无明显影响。
滴鼻组于感染后3或7 d出现病毒血症并持续到15或19 d,27或31 d出现后又迅速消失,拷贝数一直为103拷贝/μL,在感染后11 d达到高峰,之后逐渐降低;注射组于感染后3 d出现病毒血症并持续到19 d,于31 d也再次出现随后又迅速消失,感染后11或15 d病毒拷贝数最高为104拷贝/μL,之后逐渐降低。滴鼻组与注射组相比滴鼻组病毒血症持续时间短且病毒含量低,但两试验组的病毒血症都会在消失后再次出现。43 d时检测仔猪免疫器官及组织病毒拷贝数时,颌下、腹股沟淋巴结PRRSV拷贝数均可达103拷贝/μL,PAM中PRRSV拷贝数可达到106拷贝/μL。这表明弱毒株感染仔猪后,虽然病毒血症消失,但病毒仍会在仔猪体内持续存在。LAMONTAGNE等[14]证实PRRSV强毒株感染仔猪,猪体内能出现较长时间的病毒血症且病毒在免疫器官和肺脏中持续增殖。与强毒株相比PRRSV HeN-3弱毒株感染仔猪后其病毒血症的持续时间及病毒载量都比强毒株低,散毒风险更弱。
干扰素(IFN)是体内一种重要的干扰病毒繁殖的天然免疫因子,具有广谱的抗病毒活性。其中最具代表性的是Ⅰ型IFN,即 IFN-α/β。研究表明,Ⅰ型IFN在阻止PRRSV复制中起重要作用[15-16]。试验结果表明,两试验组都在病毒血症刚出现时IFN-α表达量下调,在病毒血症持续的其他时间内IFN-α表达量上调,11 d 后两组变化趋势基本一致,两组IFN-α表达量在病毒血症刚出现时抑制而后升高,滴鼻组诱导的IFN-α峰值高于注射组;滴鼻组的IFN-α mRNA水平从感染后3 d开始升高,7 d降低,11 d又升高,15 d达到最高水平,19 d后与对照组趋于相同水平。注射组与滴鼻组变化趋势相似,但在 3,11,15 d升高时段内滴鼻组的水平高于注射组。IFN-α的蛋白水平和mRNA变化规律说明 PRRSV HeN-3 弱毒株感染仔猪后可以诱导猪体中 IFN-α产生,而且滴鼻免疫促进作用较注射组更强。研究表明,PRRSV 强毒株感染后可能会通过干扰 RIG-I、TLR3 和 IPS-1 信号通路阻抑 IFN-β产生来抑制IFN-α的表达量[17],从而减弱天然免疫应答水平,进而降低特异性免疫应答水平。在 PRRSV 强毒株感染的猪肺脏中几乎检测不到Ⅰ型 IFN[18],在PRRSV强毒感染 PAM 和 Marc-145 细胞中Ⅰ型 IFN表达受到明显地抑制[19]。与强毒株相比,弱毒株感染能诱导仔猪产生一定水平的Ⅰ型IFN-α,显示弱毒株免疫抑制作用比强毒株弱,对仔猪有一定的保护作用。
TNF-α是一种非常重要的炎性因子,其主要作用是调节免疫细胞,可以作为内源性的致热源促使机体发热,引起细胞新陈代谢,也可诱导产生大量白细胞介素因子,阻断病毒的复制和肿瘤的发生。在PRRSV HeN-3感染后滴鼻组与注射组的TNF-α mRNA水平从3 d开始升高,到7 d达到最高水平,7~15 d时TNF-α mRNA水平滴鼻组显著高于注射组,两试验组在19 d后与对照组无明显差异, TNF-α表达量在病毒血症再次出现时也有所提高,随着病毒血症的消失又降至对照组水平。血清中的病毒拷贝数高的时间段与TNF-α的升高趋势是相符合的;IL-1β是一种重要促炎性细胞因子,主要表达于单核细胞和巨噬细胞,可以全身分泌并循环作用,促进炎症反应的发生。试验结果表明,在3 d时滴鼻组IL-1β的相对表达量比注射组高,滴鼻组在7 d 时达到最高并且高于注射组,两组在19 d后都与对照组基本处于相同水平。通过试验结果可以看出滴鼻组的炎性细胞因子变化趋势都提前于注射组。据报道,在感染 PRRSV 后,猪体血清、巨噬细胞或外周血单核细胞中的 IL-1β和 TNF-α的表达量均显著升高[20-21],也有报道显示,感染 PRRSV 后,猪体血清中的 IL-1β水平在 7~14 d保持较高水平[22]。弱毒株与强毒株相比诱导仔猪产生较低水平的炎性因子,仔猪炎症反应较轻。
病理切片结果表明,PRRSV HeN-3弱毒株感染仔猪较对照组的肝脏、脾脏和肾脏只有较轻微的病理变化,而且滴鼻感染组和注射感染组之间无明显病理差异。分离的PRRSV野毒株感染会导致仔猪肝脏表面白色坏死、脾脏肿大、肾脏肿大淤血,病理切片显示肝细胞变性,脾小体轮廓不清,巨噬细胞增生[23]。弱毒株与野毒株相比引起的病变较轻对仔猪的致病性弱。
PRRSV HeN-3弱毒株无论以哪种方式感染,都无明显的临床症状和病理变化;滴鼻试验组的细胞因子变化趋势要提前于注射组,两种免疫方式引起的细胞因子变化趋势是相似的。本试验所用弱毒株致病力较弱,病毒血症持续时间较短,炎性细胞因子水平和炎症反应比强毒株低此外PRRSV HeN-3弱毒株能诱导一定水平的IFN,可以为仔猪提供一定的保护作用。

