盖塔病毒E2结构域蛋白的原核表达及抗血清制备
仇相书,史 宁,朱翔宇,任世斌,张海森,李 海,鲁会军,金宁一*
(1.西北农林科技大学 动物医学院,陕西 杨凌712100;2.军事科学院 军事医学研究院 军事兽医研究所,吉林 长春130122;3.吉林农业大学 动物医学院,吉林 长春130122;4.昭苏县西域马业有限责任公司,新疆 伊犁 835600)
GETV在分类上属于披膜病毒科(Togaviridae)甲病毒属(Alphavirus)的单股正链RNA病毒,其基因组长度约为11 689 nt,包含2个独立的开放阅读框架(open reading frames,ORF),分别位于基因组5′端2/3部分(约7 407 nt)和后1/3部分(约3 759 nt)。前者负责非结构蛋白(non-structural protein,NSP)NSP1~NSP4的编码,NSP参与病毒RNA转录和复制、RNA capping以及多聚蛋白切割等过程;后者则负责编码结构蛋白,包括Capsid、E3、E2、6K和E1[10]。值得注意的是,由E基因编码的结构蛋白不仅构成了病毒粒子的表面突起,而且是GETV吸附靶细胞及诱发机体抗感染免疫的关键蛋白[11]。E2蛋白主要由3个结构域(A、B和C)组成,其中A和B包含影响免疫原性、病毒吸附和组织噬性的大部分残基[12]。
本研究对GETV毒株序列进行比对分析后,选择结构蛋白E2结构域保守区段为靶基因,参照实验室保存的GETV SD17/09株(GenBank登录号为MH106780.1)E2基因序列,扩增E2d结构域基因,克隆至原核表达载体,在大肠杆菌表达系统中实现重组蛋白E2d表达;E2d蛋白经纯化和透析后,免疫新西兰兔,以期获得抗E2d蛋白多克隆抗体,为开展E2蛋白功能研究、GETV检测方法的建立和病原学研究提供科学依据。
1 材料与方法
1.1 毒株、菌株与细胞株GETV毒株SD17/09、Vero细胞株由本实验室保存;感受态细胞BL21(DE3)、DH5α购自大连TaKaRa公司。
1.2 试剂及其他反转录试剂盒Vazyme HiS-criptⅡ1st Strand cDNA Synthesis Kit购自诺唯赞;Ex Taq PCR酶、T4DNA Ligase、DL5000 DNA Marker、载体pMDTM19-T、载体pET-22b(+)购自大连TaKaRa公司;胶回收试剂盒购自BioFluX公司;质粒小提试剂盒购自杭州AXYGEN公司;NedⅠ和XhoⅠ、氨苄青霉素、20 000透析袋购自赛默飞公司;Anti-6×His tag抗体Abcam公司产品;山羊抗鼠IgG、BCA蛋白定量试剂盒购自碧云天生物公司;尿素、包涵体蛋白纯化试剂盒购自大连TaKaRa;完全弗氏佐剂、不完全弗氏佐剂购自Sigma公司。
1.3 引物设计选择GETV结构蛋白E2结构域保守区段为靶基因,参考GETV SD17/09株中的E2基因序列,设计含酶切位点的Getah-E2 domian片段扩增引物。上游引物Getah-E2d-F添加NdeⅠ酶切位点:cgcatatgACGAAACCGTACCTAGCGTA;下游引物GetahE2d-R添加XhoⅠ酶切位点:CTCGAGTTTGCCTTCAGTTGtc-agctga,斜体下划线为限制性核酸内切酶识别位点。扩增片段全长1 017 bp,引物由吉林省库美生物科技有限公司合成。
1.4 目的基因获取与扩增以GETV SD17/09株为模板,使用Vazyme HiS-criptⅡ1st Strand cDNA Synthesis Kit将RNA反转录成cDNA,具体操作按试剂盒说明书进行。使用上述合成引物将反转录产物通过PCR进行扩增,PCR反应体系:ddH2O 13.75 μL,10×Ex Taq Buffer 2.5 μL,2.5 mmol/L dNTPs Mixture 2.5 μL,10 μmol/L上、下游引物各1 μL,模板4 μL、Ex Taq PCR酶0.25 μL。PCR反应条件:95℃ 预变性5 min;94℃ 30 s,60℃ 30 s,72℃ 50 s,35个循环;72℃延伸10 min。扩增结束后,通过1%琼脂糖凝胶电泳分离回收目的片段,克隆至pMDTM19-T载体。将其转化至DH5α感受态细胞并涂布于含有氨苄青霉素抗性的固体LB培养基,挑取单克隆菌株在液体LB中培养14~16 h。提取质粒后使用NdeⅠ和XhoⅠ进行双酶切鉴定并测序,将测序正确的质粒命名为pMD-Getah-E2d。
1.5 重组质粒pET22b-Getah-E2d的构建将验证正确的pMD-Getah-E2d质粒与原核表达载体pET-22b(+)分别用NdeⅠ和XhoⅠ进行双酶切鉴定,1%琼脂糖凝胶电泳分离回收目的片段,T4DNA 连接酶连接过夜,转化至BL21(DE3)感受态细胞中,涂布于含有氨苄青霉素抗性的固体LB平板上,挑取单克隆菌株在液体LB中培养14~16 h,保存菌种并提取质粒后分别用NdeⅠ和XhoⅠ进行双酶切鉴定,将测序验证正确的重组质粒命名为pET22b -Getah-E2d,保存菌种。
沟通的目的不是为了说服或压制对方,而是要达成共识。所以很多父母其实并不懂得沟通的真正意义,他们认为好的沟通就是让孩子变的听话,如果不听,那就是沟通不到位。这样的沟通只会造成父母和子女之间内心的隔阂,最终造成的结果就是,孩子对父母逐渐丧失了信任,那些原来可以和家长说的事情,以后再也不愿意和家长分享了。
1.6 重组蛋白Getah-E2d表达形式及鉴定将含有重组质粒的BL-21(DE3)菌种以1∶100的比例接种至10 mL含有氨苄青霉素抗性的LB液体培养基内,37℃ 220 r/min振荡培养2~3 h至D600值为0.4~0.6时,加入终浓度为0.5 mmol/L IPTG继续培养6 h。12 000 r/min离心10 min弃去上清,用原培养基1/5体积的PBS将沉淀充分重悬,在冰浴条件下进行超声破碎至菌液澄清透亮,离心收集上清,并将沉淀完全重悬于与上清等体积的包涵体重悬液中(20 mmol/L Tris-HCl、5 mmol/L Imidazol、0.5 mol/L NaCl、8 mol/L Urea、pH7.6)。分别取上清液和沉淀重悬液进行SDS-PAGE电泳和Western blot鉴定,其中,以鼠源His抗体(1∶2 000稀释)为一抗,以HRP标记的山羊抗小鼠抗体(1∶4 000 稀释)为二抗。
1.7 Getah-E2d重组蛋白表达条件优化
1.7.1最佳诱导时间确定 向试管中加入等量的pET22b-Getah-E2d重组菌,37℃ 220 r/min振荡培养2~3 h至D600值为0.4~0.6时,加入终浓度为0.5 mmol/L IPTG,分别于37℃条件下诱导表达0,2,4,6,8,10,12 h,收集菌体、超声处理后进行SDS-PAGE电泳鉴定。
1.7.2最佳诱导温度确定 前期处理同1.7.1,分别于16,26,37℃条件下诱导表达相同时间,收集菌体,超声处理后进行SDS-PAGE电泳鉴定。
1.7.3最佳IPTG浓度确定 前期处理同1.7.1,分别加入终浓度为0.0,0.2,0.4,0.6,0.8,1.0,2.0 mmol/L 的IPTG诱导表达,收集菌体,超声处理后进行SDS-PAGE电泳鉴定。
1.8 Getah-E2d重组蛋白的纯化及复性复苏pET-22b-Getah-E2d重组菌,按1∶100比例接种至200 mL含氨苄青霉素抗性的液体LB培养基中,37℃ 220 r/min振荡培养2~3 h至D600值为0.4~0.6时,按上述优化的诱导条件进行表达。收集超声处理后的蛋白样品,参照包涵体蛋白纯化试剂盒说明书使用His-bind纯化柱对目的蛋白进行纯化,取纯化过程各个步骤的蛋白样品通过SDS-PAGE进行鉴定,分析蛋白纯化效果。
将纯化后的包涵体蛋白装入透析袋中,使用复性缓冲液(50 mmol/L Tris-HCl、pH7.9、250 mmol/L NaCl、6 mol/L Urea)于4℃条件下透析6~8 h,并使用磁悬搅拌器低速搅拌;通过逐步降低复性液中Urea的含量:4,2,1,0 mol/L,并保持其他成分浓度不变,最后透析至PBS溶液中,达到包涵体复性的目的。收集复性后的蛋白,通过SDS-PAGE进行鉴定,并使用BCA蛋白定量试剂盒测定其浓度。
1.9 兔源多克隆抗体的制备选择3只3月龄、体质量2.0 kg的新西兰兔,适应性饲养3 d,确认饮食饮水正常后,耳缘静脉采集血清,通过中和抗体试验确定血清中无GETV抗体(效价小于1∶4)后作为阴性血清。首免时(0 d)按800 μg/只的剂量,将复性后的Getah-E2d蛋白配伍等体积的完全弗氏佐剂,充分乳化成油包水制剂,背部多点皮下注射和肌肉注射。于首免后7,14,21 d将复性蛋白配伍等体积的不完全弗氏佐剂,进行3次加强免疫,免疫剂量为首免的50%。每次加强免疫前收集耳缘静脉血,通过血清中和方法检测血清效价。在24 d对兔进行心脏采血,收集血清,—20℃分装保存。
1.10 兔源血清中和效价的检测参考文献[13],将本实验室保存的GETV SD17/09株用于本次血清中和试验,通过用“固定病毒-稀释血清”法检测制备的兔源血清中和效价。将血清倍比稀释(稀释倍数从1∶4至1∶8 192),分别与等体积的GETV病毒液(每孔100 TCID50/50 μL)混合,37℃、5% CO2孵育1 h。取混合液按100 μL/孔接种到单层Vero细胞(5×104个/孔),37℃、5% CO2继续孵育。3 d 后观察细胞病变情况,按Reed-Muench方法计算并以完全抑制病毒生长的最高稀释倍数的倒数定义为中和抗体效价。
1.11 兔源多抗多克隆抗体的Western blot检测以复性后的Getah-E2d重组蛋白和ETV为抗原,以本试验制备的兔源抗Getah-E2d多抗血清(1∶2 000 稀释)为一抗,以HRP标记的山羊抗兔抗体为二抗(1∶4 000稀释),进行Western blot检测,同时设置阴性血清对照组。
2 结果
2.1 Getah-E2d基因PCR扩增1%琼脂糖凝胶电泳结果显示,扩增产物在预期大小1 017 bp处出现条带(图1)。胶回收后经TA连接克隆至pMDTM19-T载体,双酶切鉴定和DNA测序结果显示,该片段与原序列完全一致,表明目的基因扩增成功。
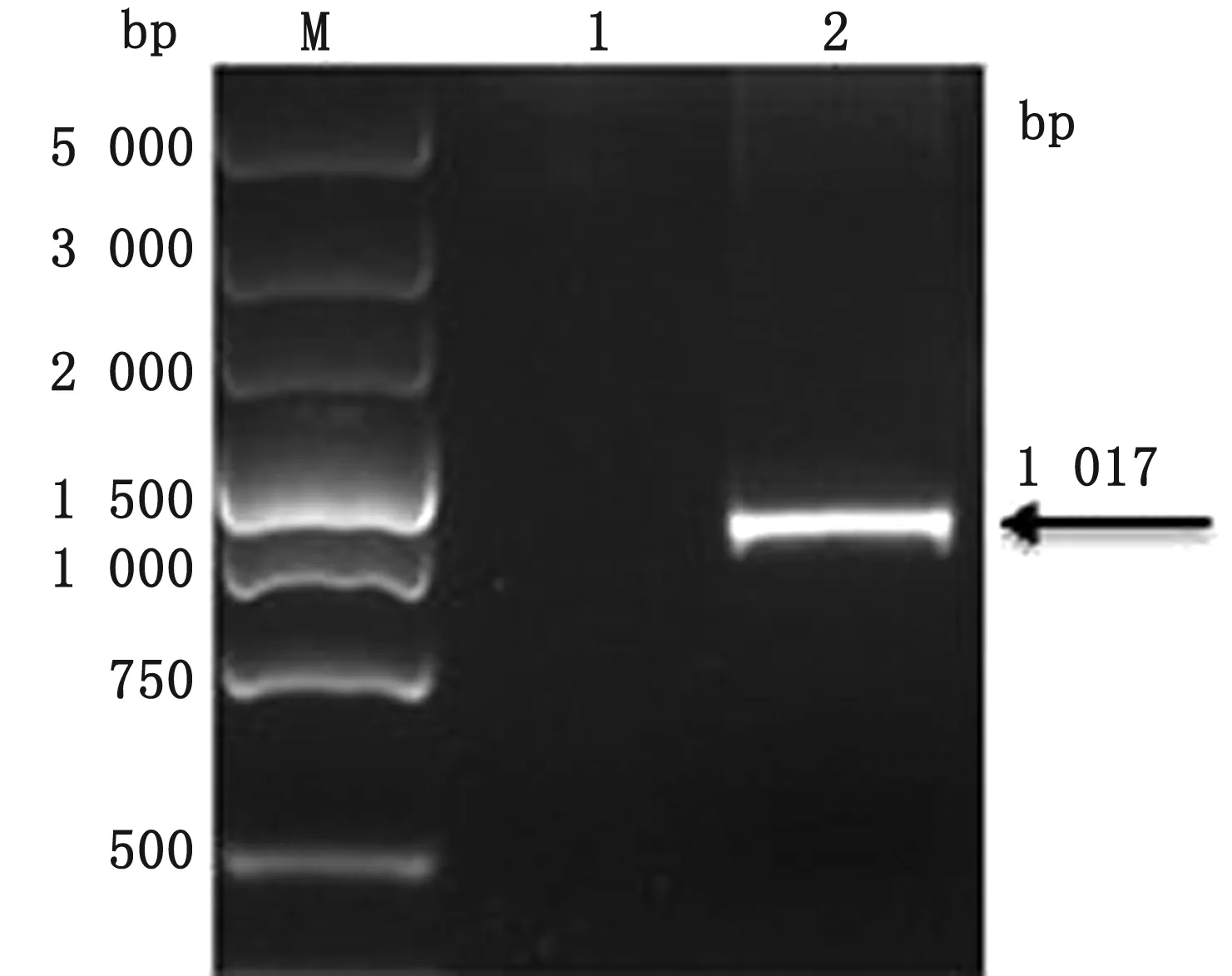
M.DL5000 DNA Marker;1.阴性对照;2.Getah-E2d PCR产物
2.2 重组质粒pET22b-Getah-E2d的构建与鉴定将测序正确的Getah-E2d基因连接至原核表达载体pET-22b(+),使用NdeⅠ和XhoⅠ双酶切鉴定,切出1条大小约1 000 bp的条带(图2),测序结果表明,Getah-E2d基因成功克隆至pET-22b(+)载体。
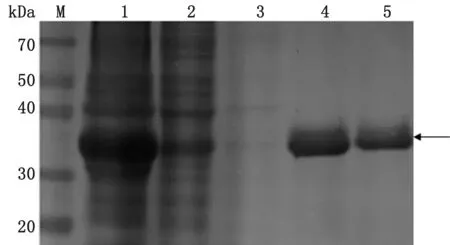
2.3 重组蛋白Getah-E2d表达形式及鉴定超声破碎菌液后,分别对离心后的上清液和沉淀进行SDS-PAGE电泳,结果显示,上清液和沉淀皆能观察到大小约38 kDa条带,符合重组蛋白Getah-E2d预期大小,重组蛋白主要以包涵体形式表达(图3A);Western blot结果显示,沉淀条带单一,信号强,表明重组蛋白Getah-E2d具有良好的反应原性(图3B)。
2.4 Getah-E2d重组蛋白表达条件优化通过对比不同诱导温度,不同诱导时间和不同浓度IPTG诱导结果,最终确定最佳诱导条件为37℃、IPTG浓度0.8 mmol/L、诱导表达12 h(图4)。

M.DL10000 DNA Marker;1.pET22b-Getah-E2d对照;2.pET22b-Getah-E2d双酶切

A.SDS-PAGE;B.Western blot。1.BL-21对照;2.pET-22b空载体对照;3.重组蛋白pET22b-Getah-E2d上清;4.pET22b-Getah-E2d包涵体;M.蛋白Marker
2.5 Getah-E2d重组蛋白的纯化及复性使用His-bind层析柱对Getah-E2d重组蛋白进行纯化,纯化后的蛋白进行SDS-PAGE鉴定,经含500 mmol/L咪唑的洗脱液洗脱后,可见约38 kDa的目的蛋白条带(图5)。经梯度透析后,测得重组蛋白质量浓度为0.5 g/L。
2.6 兔源多抗多克隆抗体中和效价的检测以“固定病毒-稀释血清”法对收集的兔血清进行中和抗体检测,结果显示,免疫后7,14,21,24 d血清中和效价分别为1∶128,1∶512,1∶1 024,1∶4 096。

A.不同诱导时间(A2~A8.诱导时间分别为0,2,4,6,8,10,12 h);B.不同诱导温度(B2~B4.诱导温度分别为16,26,37℃);C.不同诱导剂浓度(C2~C8.诱导剂浓度分别为0.2,0.4,0.6,0.8,1.0,2.0,0.0 mmol/L)。M.蛋白Marker;1.Pet-22b空载体对照
M.蛋白Marker;1.pET22b-Getah-E2d纯化前;2.穿流液;3.洗杂液;4.洗脱后;5.透析后
2.7 兔源多抗多克隆抗体的Western blot检测分别以Getah-E2d重组蛋白和GETV全病毒为抗原,以制备的兔源抗Getah-E2d多抗血清(1∶2 000稀释)和阴性血清为一抗进行Western blot检测。结果显示,阴性血清作用下,Getah-E2d组和Getah组均没有出现条带;而在制备的多抗血清作用下(免后24 d),两组在预期大小处均出现明显的单一条带,蛋白大小分别为38,46 kDa(图6)

图6 抗Getah-E2d兔源多抗对重组蛋白Getah-E2d及GETV的检测
3 讨论
近年来,我国GETV病的流行问题日益突出,对动物和公众健康构成极大威胁。虽然目前尚未证实GETV可引起人类疾病,但血清学研究显示,流行区发热病人或健康人群中存在该病毒特异性抗体[3]。长久以来,GETV被认为主要由伊蚊和库蚊携带和传播,但也有在按蚊和阿蚊中发现GETV的报道[14-15],而这些种类的蚊虫在中国广泛分布,数量众多。李元元等[16]将41株2014年以前分离的GETV毒株与1955年马来西亚蚊虫标本分离的GETV-MM2021株比对,发现核苷酸和氨基酸同源性分别为93.8~100.0%和96.0~100.0%,这提示GETV E2结构基因序列较为保守。基于E2基因核苷酸序列的进化分析,GETV毒株可分为Ⅰ~Ⅳ 4个群,1964年以后世界流行的大部分毒株属于Ⅲ群[16]。
甲病毒属病毒E2糖蛋白是一种嚢膜蛋白,具有很强的免疫原性[17]。该蛋白含有3个功能结构域(A、B和C),结构域A和B暴露在病毒嚢膜上,参与病毒吸附过程。这些区域包含中和抗体的抗原表位,在临床上已作为研发基孔肯雅病毒血清学诊断试验的靶位点[18]。李向茸等[19]将GETV的E2部分基因(381 bp)克隆到表达载体pGEX-4T-1进行表达并以此为诊断抗原,建立了检测猪GETV抗体的E2-ELISA方法,但可能由于靶基因不包含E2结构域,导致诊断的特异性较低,且未见生产应用。
本研究对GETV毒株序列进行比对分析后,选择E2结构域保守区段,截去结构域两端β带状结构,扩增出1 017 bp的Getah-E2d基因片段,并克隆至带有His标签的原核表达载体,成功构建重组质粒pET22b-Getah-E2d。经SDS-PAGE和Western blot鉴定,重组蛋白E2d主要以包涵体形式表达;经纯化、透析后,将其免疫新西兰兔制备多克隆抗体。中和试验结果显示,免疫后24 d血清中和抗体效价达到最高,为1∶4 096;BANNAI等[20]将GETV毒株接种试验马获得抗GETV马源多抗血清,制备的多抗血清能与该GETV毒株发生反应,在30,46,57 kDa出现条带,分别与Capsid、E1或E2、NSP1或NSP3蛋白大小相对应。Western blot显示,本试验制备的多抗血清能与Getah-E2d重组蛋白(约38 kDa)发生特异性反应,同时能与GETV发生反应,在约46 kDa处出现单一条带,提示该血清与GETV的E1或E2发生特异性反应,表明重组蛋白E2d具有良好的免疫原性,兔源多抗血清制备成功。综上,本研究成功制备出Getah-E2d重组蛋白及兔源多抗血清,为开展GETV E2蛋白结构域的功能研究、诊断方法的建立和疫苗研发奠定基础。

