重组溶瘤腺病毒对肺癌干细胞的抑制作用
李文杰,兰 添,王茂鹏,李一权,尚 超,肖朋朋*,孙文超*,金宁一 *, 李 霄*
(1.温州大学 病毒学研究所,浙江 温州 325000;2.长春中医药大学 吉林省院士工作站,吉林 长春 130122)
癌症是人类死亡的主要病因之一。2020年,全球大约有1 930万例新发癌症病例和近1 000万癌症死亡病例,其中肺癌新发病例大约220万,发病率仅次于乳腺癌居第二位,并且肺癌的死亡率在癌症中排名第一,大约每年有 180 万人因肺癌死亡(18%)[1]。在癌症内部有一部分细胞被称为癌症干细胞,这部分细胞在癌症起始、治疗抵抗、转移和复发中起关键作用[2]。这意味着,以肺癌干细胞为靶标可能是根除肺癌的有效治疗策略。靶向杀伤癌症干细胞可能有助于开发针对癌症的新型治疗策略,在治疗癌症时可能具有临床优势。
本课题组前期构建了对肿瘤细胞具有特异性杀伤作用的重组溶瘤腺病毒Ad-Apoptin-hTERTp-E1a(Ad-VT)[3],Ad-VT使用肿瘤特异性启动子 hTERTp来诱导其在肿瘤细胞中的特异性复制,同时含有 VP3 基因,表达具有肿瘤特异性杀伤作用的 Apoptin 蛋白,能够同时实现在肿瘤细胞中的特异性复制及对肿瘤细胞的特异性杀伤作用。Ad-Mock 为不含 hTERTp和 Apoptin 基因的腺病毒载体。本研究拟利用课题组前期构建的Ad-VT作用于肺癌干细胞,分析重组溶瘤腺病毒对肺癌干细胞的杀伤作用,探讨Ad-VT对肺癌干细胞的抑制作用。
1 材料与方法
1.1 材料重组溶瘤腺病毒由本实验室构建并保存;人肺癌干细胞A549-CSC由本实验室经磁珠分选所得并保存;CCK-8购自日本同仁;JC-1购自美国 Life 公司; Transwell Permeable Support购自美国 Corning公司;BIOCOAT Matrigel 侵袭小室、Annexin Ⅴ-FITC/PI 试剂盒购自美国 BD 公司。
1.2 CCK-8法检测重组溶瘤腺病毒Ad-VT对肺癌干细胞存活率的影响制备肺癌干细胞A549-CSC 细胞96孔板,每孔5×103个细胞,将制备好的96孔板置于 37℃、5% CO2培养箱中培养 12~24 h。根据 Ad-VT、Ad-Mock 的毒价计算出每孔细胞 100 MOI 的剂量所需的病毒体积。将96孔板取出,分别感染 100 MOI 的重组腺病毒 Ad-VT、Ad-Mock。另外设置未感染病毒的细胞对照组以及无细胞空白组。将感染病毒后的A549-CSC细胞96孔板继续培养 24~72 h,分别在感染重组腺病毒后24,48,72 h 各取出1个96孔板,避光条件下加入CCK-8,置于 37℃避光孵育4 h后将96孔板放入酶标仪中测定 450 nm 处的D值,计算各组细胞存活率。细胞存活率=[(D试验孔-D空白孔)/(D对照孔-D空白孔)]×100%。
1.3 Annexin Ⅴ-FITC/PI染色检测Ad-VT诱导肺癌干细胞凋亡的作用制备肺癌干细胞A549-CSC 细胞6孔板,每孔5×105个细胞,将制备好的6孔板置于 37℃、5% CO2培养箱中培养 12~24 h。将6孔板取出,分别感染 100 MOI 的重组腺病毒 Ad-VT、Ad-Mock,另外设置未感染病毒的 Control 组。将感染病毒后的A549-CSC细胞6孔板继续培养 24~72 h,分别在感染重组腺病毒后 24,48,72 h 各取出1个6孔板,收集各孔中的细胞,消化为单细胞后,3 000 r/min 离心 5 min,弃掉上清液,使用 500 μL 的 l×Binding Buffer 悬浮细胞,避光条件下,每个样品中加入 5 μL 的 AnnexinⅤ-FITC 和 5 μL 的 PI 混匀,避光室温染色 15 min。染色结束后,使用流式细胞仪检测细胞凋亡水平。
1.4 JC-1染色检测Ad-VT对肺癌干细胞线粒体膜电位的影响按照1.3中方法制备A549-CSC细胞6孔板并感染腺病毒,培养24~72 h,分别在感染重组腺病毒后24,48,72 h 各取出1个6孔板,收集各孔中的细胞,消化为单细胞后,3 000 r/min 离心 5 min,弃掉上清液,加入1 mL双无F12培养基悬浮细胞,避光加入1 μL浓度5 mmol/L的JC-1染液,混合均匀,此时JC-1工作浓度为5 μmol/L,37℃避光孵育30 min。孵育结束后,3 000 r/min 离心 5 min,弃掉上清,双无F12清洗一次。离心去除上清后,使用500 μL的双无 F12培养基悬浮细胞,分别使用荧光显微镜及流式细胞仪进行线粒体膜电位检测。
1.5 Transwell 迁移试验检测Ad-VT对肺癌干细胞的迁移抑制使用肺癌干细胞A549-CSC 制备24孔板,每孔5×104个细胞,将制备好的24孔板置于 37℃、5% CO2培养箱中培养 12~24 h。将 24 孔板取出,分别感染100 MOI 的重组腺病毒 Ad-VT、Ad-Mock。另外设置未感染病毒的 Control 组。将感染病毒后的 A549-CSC细胞 24 孔板继续培养24~72 h,分别在感染重组腺病毒后 24,48,72 h 各取出1个24孔板,收集孔中的细胞,消化为单细胞后离心,取一块新的 24 孔板,每孔加入 500 μL 10% F12,此为下室。放入 Transwell 小室,将细胞转移至 Transwell小室中,200 μL/孔,此为上室。将 24 孔板继续培养 24 h后取出,弃去上室中的液体,使用无菌棉签轻柔地将上层未穿膜的细胞全部拭去,避光在下室中加入 60 μL 的 CCK-8,置于 37℃避光孵育4 h,放入酶标仪中测定 450 nm 处的D值。之后取出 24 孔板,对小室进行结晶紫染色。将 Transwell 小室放入4%多聚甲醛溶液,室温固定细胞10 min。使用 ddH2O 进行清洗后,将 Transwell 小室放入结晶紫溶液中,室温下染色 10 min。结晶紫染色结束后,使用 ddH2O 进行清洗,将 Transwell 小室倒置放于室温下晾干,然后于显微镜下拍照,统计穿膜细胞数。
1.6 Biocoat 侵袭试验检测Ad-VT对肺癌干细胞的侵袭抑制按照1.5方法制备A549-CSC细胞24孔板并感染腺病毒,培养24~72 h,分别在感染重组腺病毒后 24,48,72 h 各取出1个24孔板,收集孔中的细胞,消化为单细胞后离心,取一块新的 24 孔板,每孔加入 500 μL 的10% F12,此为下室。放入Biocoat Matrigel 侵袭小室,将细胞转移至 BIOCOAT Matrigel侵袭小室中,此为上室。将制备好的 24孔板继续培养24 h,按照1.5的试验方法进行穿膜细胞的 CCK-8 检测及结晶紫染色。将BIOCOAT Matrigel 侵袭小室倒置放于室温下晾干,然后于显微镜下拍照,统计穿膜细胞数。
1.7 统计分析数据处理使用统计学软件SPSS 22.0,数据表示为均数±标准差,结果分析采用t检验。P<0.05具有显著性差异,P<0.01具有极显著差异(*P<0.05,**P<0.01)。
2 结果
2.1 重组溶瘤腺病毒Ad-VT能够降低肺癌干细胞A549-CSC的存活率结果见图1。Ad-VT作用于A549-CSC后24~72 h,细胞存活率均显著低于Control组(P<0.01),而Ad-Mock作用后细胞的存活率与Control组无显著性差异。Ad-VT作用于A549-CSC后,细胞存活率随时间延长而逐渐降低,说明Ad-VT对A549-CSC细胞的作用具有时间效应。
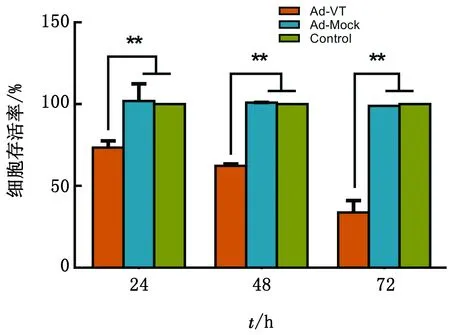
图1 重组腺病毒对细胞存活率的影响(**P<0.01)
2.2 Ad-VT诱导肺癌干细胞A549-CSC凋亡用Annexin Ⅴ-FITC/PI对凋亡的肺癌干细胞染色后,使用流式细胞仪检测细胞凋亡率,检测结果见图2。Ad-Mock作用后,A549-CSC细胞未发生明显凋亡,细胞凋亡率与Control组相比无显著性差异;Ad-VT作用于A549-CSC细胞后,与Control组相比,细胞发生了不同程度的凋亡(P<0.01),且细胞凋亡率随Ad-VT作用时间延长而逐渐增加;说明重组溶瘤腺病毒Ad-VT能够诱导肺癌干细胞发生凋亡。
2.3 Ad-VT降低肺癌干细胞线粒体膜电位用JC-1对细胞进行染色后,JC-1能够根据细胞线粒体状态不同以不同的形式存在从而发射不同颜色的荧光,结果见图3。使用荧光显微镜观察JC-1染色的细胞,Ad-Mock与Control组细胞线粒体状态良好,细胞中的JC-1以多聚体形式存在发出红色荧光;而Ad-VT感染后的细胞红色荧光减少,绿色荧光增加,说明细胞线粒体膜电位降低,细胞中的JC-1以单体形式存在。经流式细胞仪对细胞荧光强度进行检测,Ad-VT 组细胞红色荧光值随时间延长而逐渐降低。对细胞荧光值统计结果显示,与 Control 组相比,Ad-VT 组细胞红色荧光值/绿色荧光值显著降低(P<0.01),说明线粒体膜电位发生显著变化,即 Ad-VT引起A549-CSC细胞线粒体膜电位降低,诱导细胞发生凋亡。以上结果表明重组溶瘤腺病毒Ad-VT能够通过线粒体途径诱导肺癌干细胞凋亡。
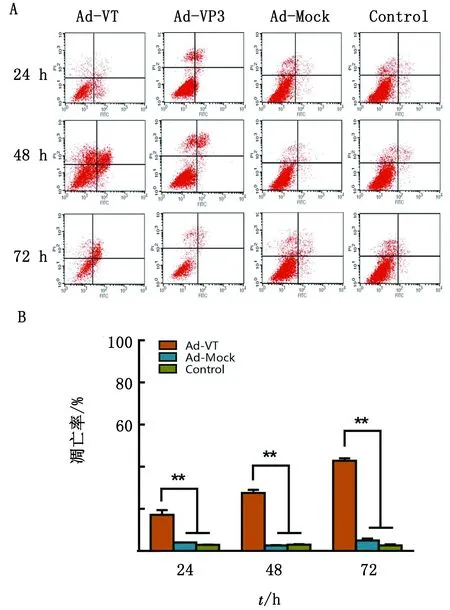
A.流式细胞仪分析A549-CSC细胞凋亡;B.对A549-CSC 细胞的凋亡定量结果
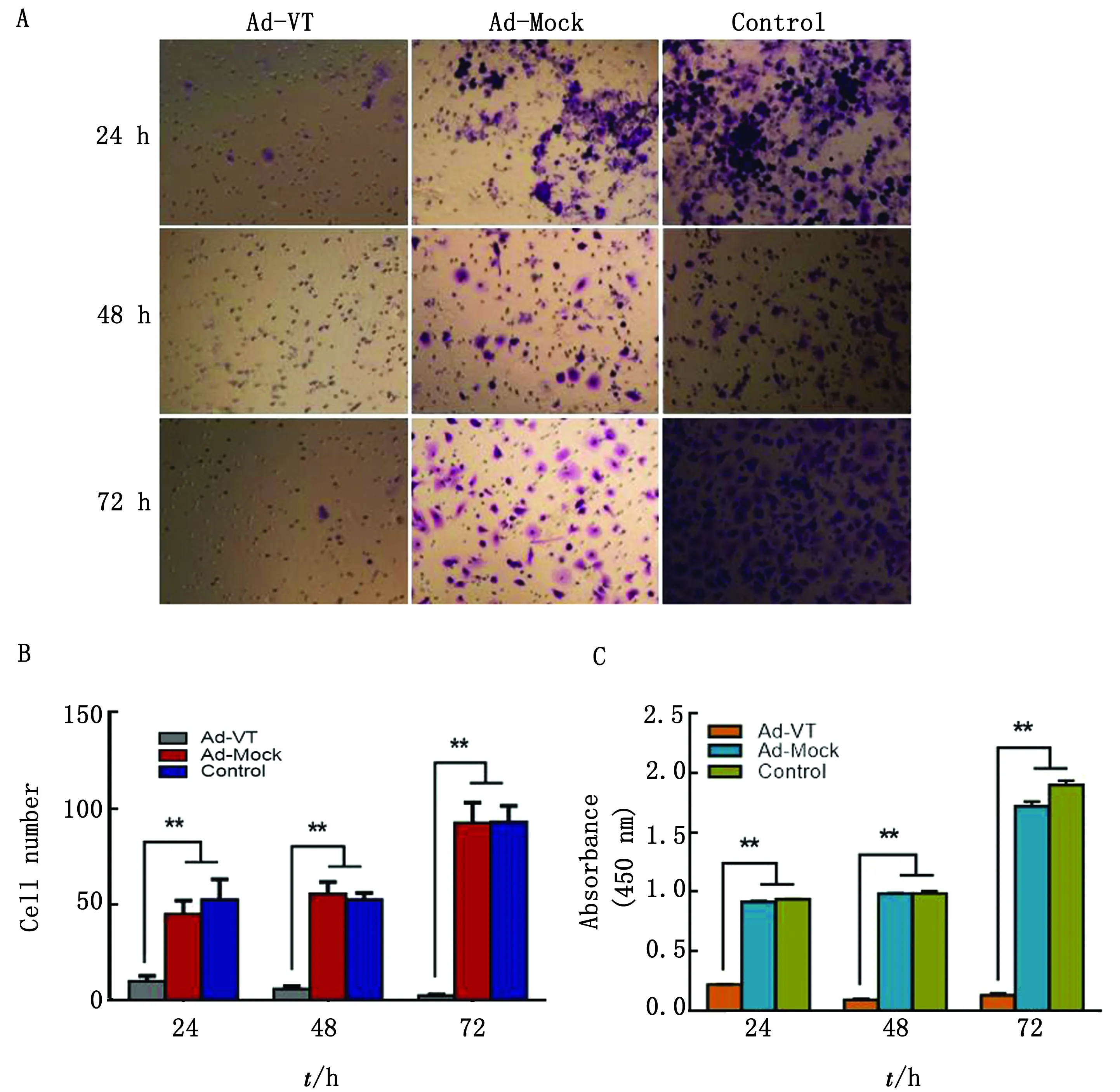
2.4 Ad-VT抑制肺癌干细胞迁移使用Transwell迁移试验对细胞的迁移能力进行评价。对迁移细胞进行结晶紫染色,穿膜细胞数统计结果如图4 所示,Ad-Mock 组与 Control 组细胞随着时间延长,穿膜细胞逐渐增多;Ad-VT作用A549-CSC后,穿膜细胞逐渐减少,Ad-VT 组穿膜细胞数显著少于Ad-Mock 组与 Control 组(P<0.01)。CCK-8法检测结果显示,Ad-VT 组细胞吸光度值显著小于 Control 组(P<0.01),即其穿膜细胞显著少于 Control 组,说明Ad-VT抑制了A549-CSC 细胞的迁移能力。
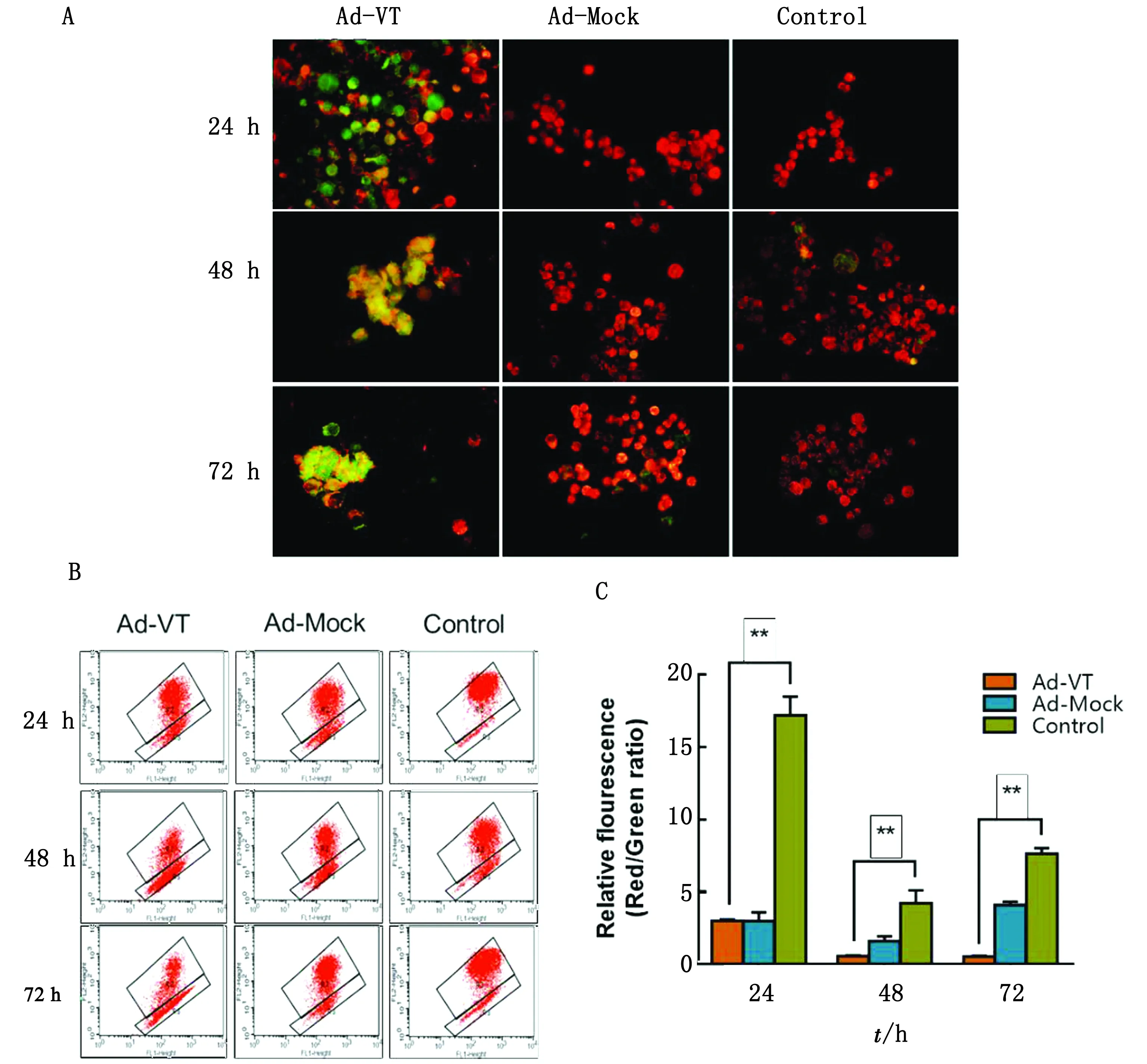
A.JC-1染色后通过荧光显微镜观察细胞形态变化;B.A549-CSC细胞的JC-1染色定量结果;C.A549-CSC细胞线粒体膜电位变化
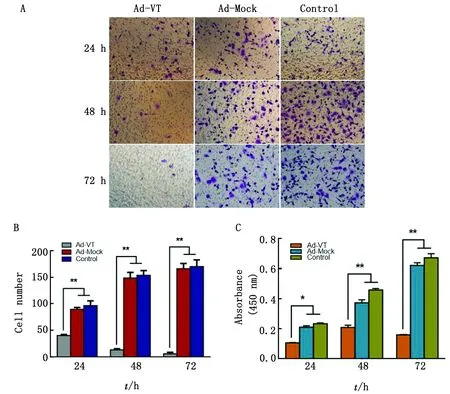
A.迁移穿膜细胞结晶紫染色;B.迁移穿膜细胞数;C.迁移穿膜细胞吸光度值
2.5 Ad-VT抑制肺癌干细胞侵袭使用Biocoat侵袭试验对细胞的侵袭能力进行评价,结果如图5所示。对侵袭穿膜细胞进行结晶紫染色,穿膜细胞数统计结果显示,Ad-Mock 组与 Control 组穿膜细胞逐渐增多;而Ad-VT作用A549-CSC细胞后,穿膜细胞逐渐减少,Ad-VT 组穿膜细胞数显著少于Ad-Mock 组与 Control 组(P<0.01)。CCK-8法检测结果显示,Ad-VT 组细胞吸光度值显著小于 Control 组(P<0.01),说明穿膜细胞显著少于 Control 组,Ad-VT抑制了A549-CSC 细胞的侵袭能力。
A.侵袭穿膜细胞结晶紫染色;B.侵袭穿膜细胞数;C.侵袭穿膜细胞吸光度值
3 讨论
尽管化疗和放射疗法仍然是临床癌症治疗的主要选择,但放化疗缺乏肿瘤特异性,能够导致全身毒性及一系列严重的不良反应,降低患者的生活质量,且如果不进行手术根治性切除,只有少数癌症能够被有效治疗。肺癌是严重威胁人类健康的主要恶性肿瘤之一,发病率和死亡率居高不下[1]。肺癌干细胞是肺癌组织内存在的一群具有干细胞样特性的细胞,其与癌症的发生、发展、转移、耐药和复发密切相关。尽管放化疗能够破坏大部分肿瘤块,但仍有一部分癌症干细胞可以存活并促进癌症复发,从而导致侵袭性和对疗法的抵抗力[4-6]。开发诱导癌症干细胞选择性和程序性死亡的治疗方法至关重要。重组 DNA 技术是研究病毒生物学的重要工具,从而推进了针对癌症的生物疗法。溶瘤病毒代表着一类新的癌症治疗方法,具有极大的灵活性。作为基因治疗和溶瘤病毒的媒介物,腺病毒是流行的基因传递载体。
重组溶瘤腺病毒Ad-VT能够诱导肺癌、肝癌、卵巢癌、乳腺癌等多种肿瘤细胞凋亡[3,7-9],诱导细胞凋亡的途径主要是通过线粒体途径[10-11]。Ad-VT不仅能够诱导肿瘤细胞凋亡,对肿瘤干细胞也具有抑制作用,能够诱导乳腺癌干细胞凋亡从而杀伤细胞,并且能够抑制乳腺癌干细胞的迁移侵袭功能,降低乳腺癌干细胞的比例[12]。本研究使用重组溶瘤腺病毒Ad-VT感染肺癌干细胞A549-CSC后,细胞存活率逐渐降低,线粒体膜电位显著降低,细胞凋亡率随Ad-VT感染时间延长而逐渐增高。对A549-CSC细胞的迁移及侵袭功能检测结果同样提示,Ad-VT能够抑制肺癌干细胞的迁移侵袭功能。癌症干细胞参与癌症发展的所有阶段,包括原发肿瘤的发生、发展、转移及癌症的复发。Ad-VT能够杀伤肺癌干细胞,诱导肺癌干细胞发生线粒体途径的凋亡以及抑制其迁移侵袭能力,经过 Ad-VT针对肺癌干细胞的治疗,将使肺癌干细胞失去在肺癌的发展、转移以及复发中发挥作用的能力。

