巨型艾美耳球虫微线蛋白3结构域蛋白的免疫保护作用
刘佳斌,张 杨,王茗悦,黄剑眉,靖传旭,宋小凯,徐立新,严若峰,李祥瑞
(南京农业大学 动物医学院,江苏 南京 210095)
鸡球虫病(coccidiosis)是一种全球范围内流行的,寄生于鸡的肠道引起的重要寄生性原虫病,并且不同的艾美耳球虫表现出高度的位点特异性[1-2],其对养禽业造成巨大的经济损失[3]。流行病学调查显示鸡球虫病发病率高达50%~70%,死亡率可以达到20%~30%,急性病例中死亡率甚至高达80% 以上[4]。鸡球虫病每年在世界范围内对家禽养殖业所造成的经济损失约30亿美元[5-6],继而引起全球性兽医卫生问题。目前世界上得到普遍公认的鸡球虫种有7个,其中巨型艾美耳球虫(Eimeriamaxima)、堆形艾美耳球虫(E.acervulina)、柔嫩艾美耳球虫(E.tenella)、毒害艾美耳球虫(E.nectrix)在世界范围内危害最为严重[4]。
鸡的艾美耳球虫具有严格宿主特异性,不同种的鸡艾美耳球虫对寄生部位也存在有特异性,如柔嫩艾美耳球虫只专性寄生于鸡的盲肠,而巨型艾美耳球虫只专一寄生于鸡的小肠中段,入侵并在肠上皮细胞内发育。迄今为止已有大量的研究显示微线蛋白(microneme,MIC)与鸡艾美耳球虫入侵宿主靶细胞的能力息息相关[7-11]。鸡艾美耳球虫入侵宿主细胞时,最关键的就是特异性受体在恰当的时机与虫体入侵相关细胞器(如微线体和棒状体)常规分泌释出的入侵相关蛋白的结合与脱离。鉴于微线蛋白在鸡球虫子孢子入侵宿主细胞过程中的重要性,及本实验前期研究发现[12],巨型艾美耳球虫的微线蛋白3(EmMIC3)能够特异性结合小肠中段上皮细胞,且该蛋白对巨型艾美耳球虫的入侵具有较好的免疫保护力,同时针对EmMIC3的5个微线蛋白黏附重复结构域(microneme adhesive regions,MARR)的研究中发现,EmMAR2与鸡小肠中段的结合能力最强,而EmMAR5与小肠中段的结合能力较弱。因此,本研究针对巨型艾美耳球虫侵入过程中的关键蛋白EmMIC3,及其结构域蛋白,开展动物免疫保护试验,对比EmMIC3蛋白和结构域蛋白的免疫保护效果,进一步为研制鸡球虫亚单位疫苗提供参考。
1 材料与方法
1.1 实验动物与虫株1日龄海兰白蛋鸡购自江苏省海安市某鸡场;新西兰白兔购自江苏省南京市某养殖场。本项研究中所有试验方案符合南京农业大学动物伦理、福利等相关条例规定,符合江苏省科技厅动物福利保护条例,许可证编号:SCXK(苏)2014-0004。
巨型艾美耳球虫江苏分离株(JS strain)由南京农业大学兽医寄生虫病实验室分离、纯化并保存于重铬酸钾(2.5%)溶液中,放置于4℃,每3个月复苏1次,确保卵囊的活性。
1.2 主要试剂弗氏完全佐剂、弗氏不完全佐剂、氨苄抗生素为南京生兴公司产品;脱脂奶粉购自DSBIO公司;IPTG购自上海生工生物公司;山羊抗兔IgG(Y)抗体购自BioWorld公司;TMB购自Sigma公司;6×Protein Loading 购自Thermo scientific 公司;His标签蛋白纯化镍柱(HisTrapTMFF crude)为GE Healthcare公司产品。
1.3 EmMIC3、EmMAR2、EmMAR5重组蛋白的诱导表达及纯化将含有pET-32a-EmMIC3、pET-32a-EmMAR2、pET-32a-EmMAR5质粒的菌液和pET-32a菌液(实验室张杨博士提供)按1∶100的比例分别接种至含终质量浓度为50 mg/L的氨苄青霉素的1 L培养基中,培养至细菌生长对数期(D600≈0.6),加入终浓度为1 mmol/L的IPTG诱导表达。离心收集菌体沉淀,用pH7.4 的PBS洗涤菌体3次,弃上清,用binding buffer 重悬沉淀,-20℃ 反复冻融3次,超声破碎,7 500 r/min,离心15 min;上清转移至新的50 mL离心管,上清用上清binding buffer重悬、沉淀用包涵体binding buffer重悬,4℃溶解过夜。分别取上清和包涵体,加入5×Protein loading buffer,沸水作用5~8 min,进行SDS-PAGE。检测上清和包涵体的表达情况,以确定蛋白的表达部位。
包涵体binding buffer溶解的蛋白沉淀于4℃7 500 r/min 离心15 min,收集上清,经0.22 μm滤器过滤杂质后进行蛋白纯化(若蛋白在上清,则直接用0.22 μm滤器过滤)。采用His标签蛋白纯化柱(His-Trap FF)纯化重组蛋白。
1.4 EmMIC3、EmMAR2、EmMAR5重组蛋白多克隆抗体制备将纯化后的pET-32a标签蛋白、pET-32a-EmMIC3、pET-32a-EmMAR2、pET-32a-EmMAR5重组蛋白(500 μg/只)分别免疫6周龄雄性健康新西兰白兔制备抗血清,每种蛋白免疫2只新西兰白兔。初次免疫时,加入等量的弗氏完全佐剂,在乳化仪中乳化10~15 min,采用背部多点注射法皮下注射。间隔2周后,加入等量的弗氏不完全佐剂混匀后充分乳化,加强免疫。每周免疫1次,5次免疫后采用心脏采血法收集血液,分离血清,获得多克隆抗体。
1.5 多克隆抗体效价检测用3种重组蛋白溶于0.05 mol/L碳酸盐溶液(pH9.6),调节其蛋白质量浓度为50 mg/L。在96孔酶标板中每孔加入100 μL含50 mg/L重组蛋白的碳酸盐包被液,放置4℃过夜;弃去包被液,用PBST洗3次,每次5 min;每孔加入200 μL含5%脱脂奶粉的PBST,37℃孵育封闭1 h;弃去封闭液,用PBST洗涤3次,每次5 min;每孔加入100 μL,1∶50稀释过的待测血清样品,37℃孵育2 h;弃去液体,用PBST洗涤3次,每次5 min;每孔添加100 μL封闭液稀释过(1∶10 000)的HRP标记的二抗,室温反应1 h(37℃);弃去液体,用PBST洗涤3次,每次5 min,每孔添加100 μL TMB,室温避光5 min;每孔添加100 μL 2 mol/L 的H2SO4,终止反应,放入酶标仪中,测D450值。
1.6 巨型艾美耳球虫孢子化卵囊收集取2周龄海兰白鸡20只,每只鸡经口灌服2×104个孢子化卵囊,收集感染后5~8 d的粪便,采用饱和盐水漂浮法从粪便中收集卵囊,存于2.5%重铬酸钾中并在28℃恒温培养箱中孢子化,待孢子化率达到90%时,收集卵囊。
1.7 分组与免疫重组蛋白免疫:将体质量差异不显著,健康状况良好的14日龄雏鸡随机分为6组,每组20只。其中3组分别用原核表达蛋白EmMIC3、EmMAR2、EmMAR5免疫雏鸡,并且设置pET32a载体蛋白、感染非免疫和非感染非免疫3个对照组。14日龄时进行第1次免疫,腿部肌肉注射,1 200 μL/羽。21日龄时进行第2次免疫,200 μL/羽,28日龄时进行攻虫,经口感染1.0×105个巨型艾美耳球虫孢子化卵囊,7 d后剖杀。
重组蛋白抗血清免疫:将体质量差异不显著,健康状况良好的28日龄雏鸡攻虫,经口感染1.0×105个巨型艾美耳球虫孢子化卵囊,并随机分为6组,每组20只。连续7 d进行翅静脉注射,每羽注射0.5 mL效价为212抗重组蛋白多抗血清,并且设置抗pET-32a标签蛋白多抗组、感染非免疫和非感染非免疫组,7 d 后剖杀。
1.8 免疫保护效果观察巨型艾美耳球虫致病性的程度与鸡感染球虫卵囊数和其他的指标相关,通过观察增体质量效果、统计克肠内容物卵囊数、卵囊减少率、肉眼肠道病变记分等指标结合抗球虫指数等,对此次动物试验的免疫效果进行全面的评价。
1.8.1增体质量效果 每个试验组逐只测体质量、攻虫时体质量(m1)和剖杀时体质量(m2)并记录数据,计算平均增体质量(W1)、增体质量率和相对增体质量率。参照索勋等[13]的计算方法进行。
1.8.2克肠内容物卵囊数(oocysts per gram feces,OPG) 使用麦克马斯特法(McMaster’s method)计算每克肠道内容物的卵囊数。
1.8.3卵囊减少率 参照索勋等[13]的方法计算卵囊的减少率。
1.8.4肉眼肠道病变记分 因为组织损伤产生于球虫生活史的末期,致病性的迹象是短暂的出现,所以选择在感染后6~7 d进行观察。巨型艾美耳球虫病变位置为小肠中段。肉眼病变计分方法参照索勋等[13]。
1.8.5抗球虫指数(anticoccidial index,ACI) ACI是将存活率、增体质量变化效果、肠道病变分值和卵囊数量等多项参数综合进行分析和评定,是判定球虫耐药性、药物抗球虫效力或球虫疫苗免疫效果等的指标。但是不同的研究者在不同的试验研究中所采用的参数不同,本试验所采用参数和判定公式如下:
ACI=(存活率+相对增体质量率)-(病变值+卵囊值)。ACI ≥ 180,则保护效果明显;160 ≤ ACI ≤ 179,则保护效果一般;ACI ≤ 160,则无保护效果。
1.8.6数据的统计分析 使用SPSS 20.0统计分析软件进行分析,组间差异显著性分析使用单因素邓肯多重范围检验的方差分析(ANOVA)。P>0.05为差异不显著;P<0.05为差异显著;P<0.01为差异特别显著;P<0.001为差异极显著。
2 结果
2.1 EmMIC3、EmMAR2、EmMAR5重组蛋白的诱导表达及纯化构建成功的原核重组质粒pET-32a-EmMIC3、pET-32a-EmMAR2、pET-32a-EmMAR5转入BL21大肠杆菌,用诱导剂IPTG小量表达,以pET-32a为空载体对照,探索表达条件。诱导表达结果如图1。
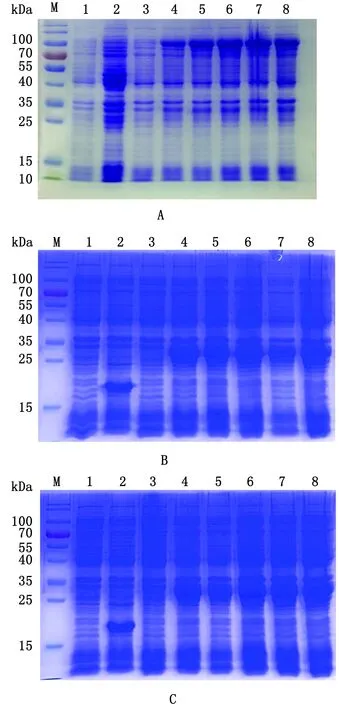
A.SDS-PAGE分析pET-32a(+)-EmMIC3的时相表达;B.SDS-PAGE分析pET-32a(+)-EmMAR2的时相表达;C.SDS-PAGE分析pET-32a(+)-EmMAR5的时相表达。M.蛋白Marker;1.pET-32a(+)在诱导表达0 h后的BL21裂解物;2.pET-32a(+)在诱导表达5 h 后的BL21裂解物;3~8.pET-32a(+)-EmMIC3(A)、EmMAR2(B)、EmMAR5(C)在诱导表达0~5 h后的BL21裂解1 EmMIC3、EmMAR2、EmMAR5重组蛋白的诱导表达及纯化
纯化结果如图2,在91,28,26 kDa附近出现单一条带,纯化效果良好。
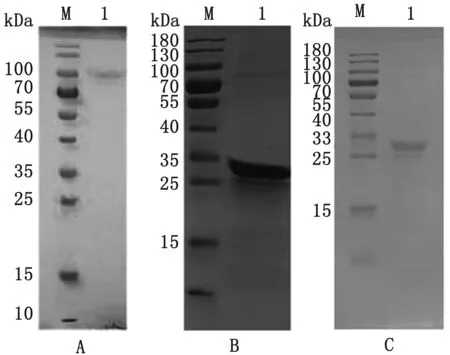
A.纯化后的EmMIC3重组蛋白;B.纯化后的EmMAR2重组蛋白;C.纯化后的EmMAR5重组蛋白;M.蛋白Marker
2.2 EmMIC3、EmMAR2、EmMAR5重组蛋白兔抗血清效价检测第5次免疫后间接ELISA法检测兔血清中pET-32a-EmMIC3、pET-32a-EmMAR2、pET-32a-EmMAR5蛋白的效价分别为220,220,216。
2.3 重组蛋白EmMIC3、EmMAR2、EmMAR5抗巨型艾美耳球虫免疫保护效果
2.3.1增体质量变化 平均增体质量(表1)表示攻虫前后每组鸡的体质量变化,用来评估重组蛋白对鸡增体质量的影响,感染非免疫与非感染组相比差异显著,说明每组实验动物成功感染巨型艾美耳球虫。pET-32a标签蛋白组与感染非免疫组比较差异不显著,说明其对感染球虫鸡的体质量无显著影响。每个试验组鸡的体质量与感染非免疫组比较差异显著,说明3种重组蛋白对感染鸡巨型艾美耳球虫具有保护效果。
2.3.2克肠内容物卵囊数(OPG) 攻虫后7 d取肠内容物进行卵囊计数(表1),经过分析比较发现pET-32a标签蛋白组与感染非免疫组比较卵囊差异不显著,说明pET-32a标签蛋白没有抗球虫作用。每个试验组鸡的卵囊数与感染非免疫组比较显著减少,说明重组蛋白免疫均能够减少感染鸡卵囊排出量。
2.3.3肠病变计分 肠道病变记分(表1)表示的是肠道受损伤程度。攻虫后7 d观察肠道病变,pET-32a标签蛋白组与感染非免疫组比较差异不显著,说明pET-32a标签蛋白没有抗球虫作用。每个试验组鸡的病变记分与感染非免疫组比较差异显著,说明重组蛋白对鸡具有抗球虫保护效果。
2.3.4ACI检测 ACI是将存活率、增体质量情况、病变记分值及卵囊值多项参数进行综合分析。从表1可以看出pET-32a标签蛋白组与感染非免疫组比较ACI差异不显著,说明pET-32a标签蛋白没有抗球虫作用。其中试验组EmMIC3、EmMAR2组ACI都在160以上,说明其对鸡具有抗球虫保护效果。EmMAR5组的ACI在160以下,说明其对鸡不具有抗球虫保护效果。
表1 免疫鸡于巨型艾美耳球虫攻虫后的抗球虫保护效果
2.3.5鸡血清中抗重组蛋白特异性抗体水平 血清样品于雏鸡2次免疫后7 d采集,使用ELISA方法检测血清中EmMIC3、EmMAR2、EmMAR5特异性IgG浓度,试验结果如图3所示。重组蛋白EmMIC3免疫组血清特异性抗体水平在2次免疫后7 d均显著高于各对照组(P<0.05)。试验证实EmMIC3、EmMAR2、EmMAR5可刺激机体产生体液免疫。
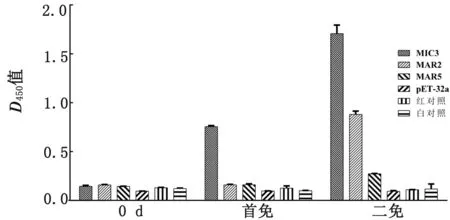
图3 鸡血清中EmMIC3 EmMAR2 EmMAR5特异性IgG水平
2.4 重组蛋白EmMIC3、EmMAR2、EmMAR5抗血清免疫保护效果
2.4.1增体质量变化 感染非免疫与非感染组相比差异显著(表2),说明每组实验动物成功感染巨型艾美耳球虫。pET-32a标签蛋白血清组与感染非免疫组比较差异不显著,说明其对感染球虫鸡的体质量无显著影响。每个试验组鸡的体质量与感染非免疫组比较差异显著,说明3种抗重组蛋白血清对感染鸡巨型艾美耳球虫具有保护效果。
2.4.2克肠内容物卵囊数(OPG) 经过分析比较发现抗pET-32a标签蛋白血清组与感染非免疫组比较卵囊差异不显著(表2),说明抗pET-32a标签蛋白血清没有抗球虫作用。每个试验组鸡的卵囊数与感染非免疫组比较显著减少,说明抗重组蛋白血清免疫均能够减少感染鸡卵囊排出量。
2.4.3肠病变计分 攻虫后7 d观察肠道病变,抗pET-32a标签蛋白血清组与感染非免疫组比较差异不显著(表2),说明抗pET-32a标签蛋白血清没有抗球虫作用。每个试验组鸡的病变记分与感染非免疫组比较差异显著,说明抗重组蛋白血清对鸡具有抗球虫保护效果。
2.4.4ACI检测 从表2可以看出抗pET-32a标签蛋白血清组与感染非免疫组比较ACI差异不显著,说明pET-32a标签蛋白没有抗球虫作用。其中试验组抗重组蛋白EmMIC3、EmMAR2血清组的ACI都在160以上,说明其对鸡具有抗球虫保护效果。抗重组蛋白EmMAR5血清组的ACI在160以下,说明其对鸡不具有抗球虫保护效果。
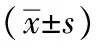
表2 重组蛋白EmMIC3、EmMAR2、EmMAR5抗血清免疫保护性效果
3 讨论
鸡球虫病危害甚广,呈世界性分布,其中巨型艾美耳球虫感染鸡的小肠中段,进而使鸡的生长性能和饲料消化率降低,造成巨大经济损失。在对球虫防治方面,目前基本通过使用化学药物进行预防治疗,然而,随着耐药性的产生和食品安全问题的日益突出,有效的疫苗预防措施备受关注[14]。BEACH等[12]首次报道了感染过的鸡再次感染会产生抵抗力,此研究为现代鸡球虫疫苗的研究奠定基础。然而27年后第1个商品化的抗球虫活疫苗CocciVac才在美国注册成功并上市。在过去20年中,多项关于抗球虫疫苗及其在家禽养殖中应用的研究被报道。虽然越来越多关于亚单位疫苗抗球虫的可行性研究被发表,但是除了CoxAbic以外至今没有其他任何商业化产品上市[15-22]。近年来,国外巨型艾美耳球虫疫苗,主要有以色列雅贝克公司从巨型艾美耳球虫的配子体中分离而得的亚单位疫苗 CoxAbic[23],而国内则相对缺少巨型艾美耳球虫疫苗研发的信息。
因此本试验从其入侵机制出发,依据巨型艾美耳球虫的微线蛋白3,在子孢子侵入肠上皮细胞中发挥重要作用,及其结构域蛋白在子孢子侵入试验中表现出的结合能力,选择研究EmMIC3和EmMARS蛋白,尝试将球虫感染阻断在入侵阶段,利用重组蛋白及抗重组蛋白血清,使其产生抗球虫免疫,以期得到良好的免疫保护作用,为亚单位疫苗筛选提供参考。
本试验中,分别采用肌肉注射重组蛋白和翅静脉注射抗重组蛋白血清2种方法评价重组蛋白EmMIC3、EmMAR2、EmMAR5对巨型艾美耳球虫感染的免疫保护作用,重组蛋白免疫方面,感染非免疫组与pET-32a载体蛋白组的ACI值均远远小于100,说明这2组未产生保护效果。而重组蛋白EmMIC3免疫组的ACI≥180,提示EmMIC3免疫鸡,可以对巨型艾美耳球虫的入侵提供优秀的免疫保护力;重组蛋白EmMAR2免疫组的ACI为170,提示其免疫保护一般;重组EmMAR5免疫组的ACI<160,提示其无保护作用。
抗重组蛋白血清免疫方面,感染非免疫组与抗pET-32a载体蛋白血清组的ACI值均远远小于100,说明这2组未产生保护效果。而抗rEmMIC3血清免疫组的ACI≥180,提示EmMIC3免疫鸡,可以对巨型艾美耳球虫的入侵提供优秀的免疫保护力;抗rEmMAR2血清免疫组的ACI为165,提示其免疫保护一般;抗rEmMAR5血清免疫组的ACI<160,提示其无保护作用。
综上,动物免疫保护数据显示,EmMIC3和结构域蛋白的免疫保护作用有所差异,且全蛋白表现出良好的免疫保护作用,结构域蛋白的免疫保护能力与其同小肠上皮细胞的结合能力以及子孢子侵入能力有相关性,即在子孢子侵入试验及细胞ELISA试验中与小肠上皮结合能力最强的结构域蛋白EmMAR2表现出较强的免疫保护作用,而结合能力较弱的EmMAR5则未显示出免疫保护作用,二者免疫效果与EmMIC3全蛋白进行比较,虽然某些结构域具有较好的免疫保护效果,但是要发挥更好的抗球虫感染的免疫作用,可能需要其他结构域蛋白的共同作用。

