免疫检查点抑制剂治疗晚期非小细胞肺癌的疗效观察
周 艳
(南通大学附属肿瘤医院内科 江苏 南通 226300)
免疫检查点抑制剂(immune checkpoint inhibitor,ICPi)改变了肺癌治疗格局,成为继化疗、靶向治疗后的新手段[1]。与化疗和靶向治疗不同,肿瘤免疫治疗以免疫细胞为靶点。T细胞介导的细胞免疫是抗肿瘤免疫的主要免疫反应。肺癌细胞能够表达靶向程序性死亡蛋白-1及其配体(PD1/PDL1),与效应T细胞上的PD1/B7.1相结合,传递负性调控信号,导致T细胞诱导凋亡和免疫无能,T效应细胞及T记忆细胞分化受损,抑制T细胞免疫效应,发生免疫耐受。而ICPi主要作用于PD1/PDL1,阻断该信号通路,增强T细胞的免疫应答,从而抑制肿瘤细胞的免疫耐受,进而消除肿瘤。目前临床上应用的ICPi主要有PD-1(keytruda、Nivolumab、特瑞普利单抗、信迪利单抗、替雷利珠单抗)、PD-L1(Durvalumab、Atezolizumab)、细胞毒性T细胞相关抗原-4(CTLA-4)。在晚期非小细胞肺癌、恶性黑色素瘤、复发难治的霍奇金淋巴瘤、肝癌、肾癌、胃癌、卵巢癌、宫颈癌、MSI-H的肿瘤中取得了令人满意的效果[2-4]。本文回顾性分析2017年3月—2020年3月在南通大学附属肿瘤医院内科采用免疫检查点抑制剂治疗的36例晚期恶性肿瘤患者的相关临床资料,现将结果报道如下。
1.资料与方法
1.1 一般资料
回顾性分析2017年3月—2020年3月南通大学附属肿瘤医院内科36例应用免疫治疗的晚期非小细胞肺癌患者的临床资料。所有患者均有明确的病理诊断,均无自身免疫性疾病。其中腺癌23例,鳞癌11例,腺鳞癌1例,低分化神经内分泌癌1例。患者年龄40~81岁,平均年龄(60.58±12.73)岁,男性26例,女性10例。免疫单药免疫治疗或免疫联合治疗,其中一线治疗8例,二线治疗15例,三线及以上治疗13例。分为单药免疫治疗组12例,免疫联合治疗组24例。
1.2 观察指标
疗效分析采用iRECIST评价标准,不良反应采用CTCAE分级。随访患者1年的无进展生存期(progress free survival, PFS)和总生存期(overall survival, OS)。无失访者。
1.3 统计学方法
应用SSPS 21.0软件进行统计分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率[n(%)]表示,采用χ2检验,组间比较应用Fisher确切概率法。PFS和OS组间比较应用Kaplan-Meier生存函数进行分析。以P<0.05为差异有统计学意义。
2.结果
2.1 两组患者临床疗效情况
单药免疫治疗组CR 0例,PR 4例,SD 4例,PD 4例,ORR为33.33%,DCR为66.66%,免疫联合治疗组的CR 1例,PR 10例,SD 7例,PD 6例,ORR为45.83%,DCR为75.00%,免疫联合治疗组的ORR、DCR高于单药免疫治疗组,但组间差异无统计学意义(P>0.05),见表1。
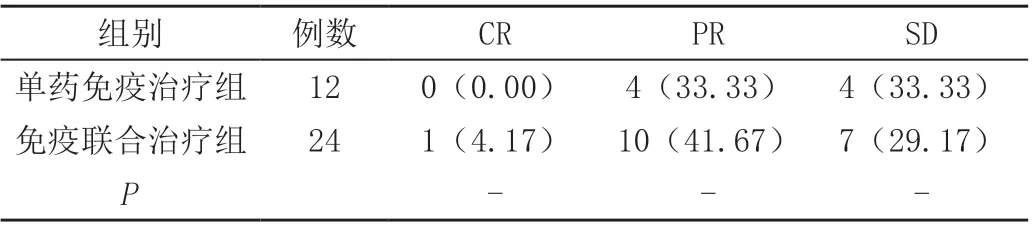
表1 两组患者临床疗效情况比较[n(%)]

表1(续)
2.2 两组患者随访1年的PFS、OS情况
单药免疫治疗组平均PFS、OS分别为5.89个月、7.67个月,免疫联合治疗组平均PFS、OS分别为7.22个月、11.08个月,免疫联合治疗组的PFS、OS高于单药免疫治疗组,差异有统计学意义(P<0.05),见表2。
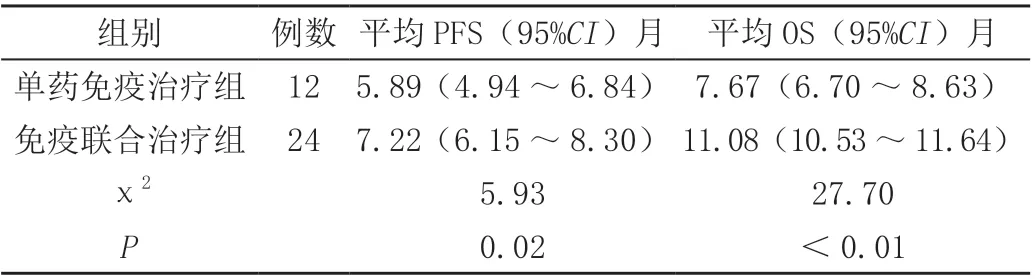
表2 两组患者PFS、OS比较
2.3 两组患者不良反应发生情况
单药免疫治疗组发生不良反应患者共8例,其中主要为1~2级不良反应6例、3~4级不良反应2例,免疫联合治疗组发生不良反应患者共18例,其中主要为1~2级不良反应14例、3~4级不良反应4例,免疫联合治疗组发生不良反应发生率(75.00%)高于单药免疫治疗组(66.67%),但差异无统计学意义(P>0.05),见表3。

表3 两组患者不良副反应情况比较(例)
3.讨论
随着日益增多的临床研究证实了ICPi在肺癌治疗中的显著疗效,免疫治疗药物获批适应证逐步扩大,药品大幅度降价并进入医保,ICPi的临床应用大幅度增加,免疫治疗已成为肺癌治疗的新的方向。PD-1抑制剂代表药物keytruda在治疗NSCLC中表现出了良好的疗效与安全性,已被推荐与培美曲塞和铂类化疗药物联合作为一线治疗非鳞状无驱动基因突变的晚期NSCLC的选择之一,联合卡铂和紫杉醇适用于转移性鳞状非小细胞肺癌一线治疗。肿瘤免疫治疗在临床应用中面临一个重大挑战,即激活免疫系统对于正常器官的过度免疫,称之为免疫相关不良反应(irAE)。随着免疫治疗的使用越来越广泛,每年报道的irAE数量逐渐增加,引起了临床医生和患者的关注。当发生irAE时,如不能及时识别并给予积极有效的干预,可能会导致进展恶化,危及生命,因此早发现、早诊断及早治疗至关重要,急需提高认识和总结经验。目前免疫治疗也面临着难题及瓶颈。ICPi双药联合、ICPi联合抑制血管生成药物(安罗替尼、贝伐珠单抗)±化疗治疗、靶向药物失败后选择ICPi等临床试验进行中,期间后期数据。同时,预测irAE发生及预后相关的标志物也在不断探索中[5]。
本文结果显示,单药免疫治疗组ORR为33.33%、DCR为66.66%,免疫联合治疗组ORR为45.83%、DCR为75.00%,免疫联合治疗组的ORR、DCR高于单药免疫治疗组,但组间差异无统计学意义(P>0.05)。这与其他学者研究结果基本一致[6]。但是,本研究在随访患者1年的PFS以及OS的相关数据分析显示,单药免疫治疗组平均PFS、OS分别为5.89个月(95%CI:4.94~6.84)、7.67个月(95%CI:6.70~8.63),免疫联合治疗组平均PFS、OS分别为7.22个月(95%CI:6.15~8.30)、11.08(95%CI:10.53~11.64),免疫联合治疗组的PFS、OS高于单药免疫治疗组,结果提示免疫联合治疗能明显提高患者的生存率。这与其他学者的研究结果基本一致[2]。
本研究观察irAE结果显示,单药免疫治疗组发生不良反应患者共8例,irAE发生率为66.67%,免疫联合治疗组发生不良反应患者共18例,irAE发生率为75.00%免疫联合治疗组发生不良反应发生率高于单药免疫治疗组,但差异无统计学意义(P>0.05)。本研究中的irAE发生率与其他学者报道的54%~76%基本一致[7]。irAE可见于任何器官,比较容易累及有皮肤、呼吸、消化道、内分泌系统、肝脏、肌肉骨骼等靶器官,而心脏、造血系统、肾脏、神经及眼部累及的发生率相对少见,大多数为轻-中度[8]。相关文献报道,irAEs累及器官与原发肿瘤的类型及部位暂无明确相关性[9]。本研究中无论是单药免疫治疗组还是免疫联合治疗组,不良反应主要为1~2级。
综上所述,免疫检查点抑制剂免疫联合治疗晚期非小细胞肺癌临床获得显著疗效,不良反应可以耐受,能够明显改善患者预后,值得临床应用。但本次观察例数偏少,还需今后加大样本量继续观察加以证实这一结论。

