甜菜DAMD引物筛选及品种快速鉴定
丁刘慧子,邳植,吴则东
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
糖甜菜是我国北方的重要经济作物和糖料作物,我国甜菜集中产区主要分布在内蒙古、黑龙江和新疆等地区[1]。甜菜在我国的栽培历史只有100 多年,甜菜制糖工业和种植业的发展,在很大程度上取决于甜菜品种的质量。目前我国的甜菜品种主要由世界上三大育种公司控制,国内使用的甜菜种子都依靠进口[2]。生产上偶尔会出现品种的假冒现象,而鉴别品种真实性的主要方法依然是形态学鉴定法。由于糖甜菜基本来源于白西里西亚这个品种[3],其遗传基础相对较窄,遗传差异较小,因此利用形态学方法对糖甜菜进行鉴定非常困难,而且鉴定过程往往需要经历整个甜菜生长期。
分子标记技术在20世纪80年代就已经开始应用,它是继形态学标记、细胞学标记和生化标记技术之后发展起来的一种新型的遗传标记[4]。近几十年以来,已经有SNP[5]、EST[6]、ISSR[7-8]、RFLP[9]、RAPD[10]、AFLP[11]、SRAP[12]和SSR[13-14]等多种分子标记技术被运用于甜菜遗传图谱的构建或遗传多样性分析。
DAMD 分子标记技术(Direct amplification of minisatellite region DNA)全称为基于聚合酶链式反应的小卫星DNA 定向扩增[15]。小卫星又称超可变重复序列(HVR)或可变数目串联重复序列(VNTR),是由10~60 bp碱基组成的串联重复序列,含有小卫星的区域通常表现出较高水平的限制性片段长度多态性(RFLP)。小卫星位点串联重复拷贝数中的极端变异被认为是人类观察到的多态性来源。由于小卫星或VNTR 序列广泛存在于不同种类的动植物中,以孟德尔的方式遗传,并具有较高的特异性,因此,可利用小卫星序列作为引物,采用PCR 技术扩增到小卫星之间的序列,用以区分不同的物种。目前该技术已经应用于石竹[16]、兰花[17]、毛蕨[18]、丝瓜[19]等植物的多样性分析中。本研究利用3个核心DAMD 引物对40个甜菜品种进行鉴定,以实现快速鉴定甜菜品种并建立其指纹图谱的目的。
1 材料与方法
1.1 试验材料
甜菜品种名称及品种编号如表1所示,表1 中所有甜菜品种的种子均由农业农村部全国农技中心提供,所有品种均为已经登记的品种。40 个甜菜品种均种植于黑龙江大学农作物研究院试验基地,当甜菜长至4对真叶时采集其嫩叶用于试验测定。
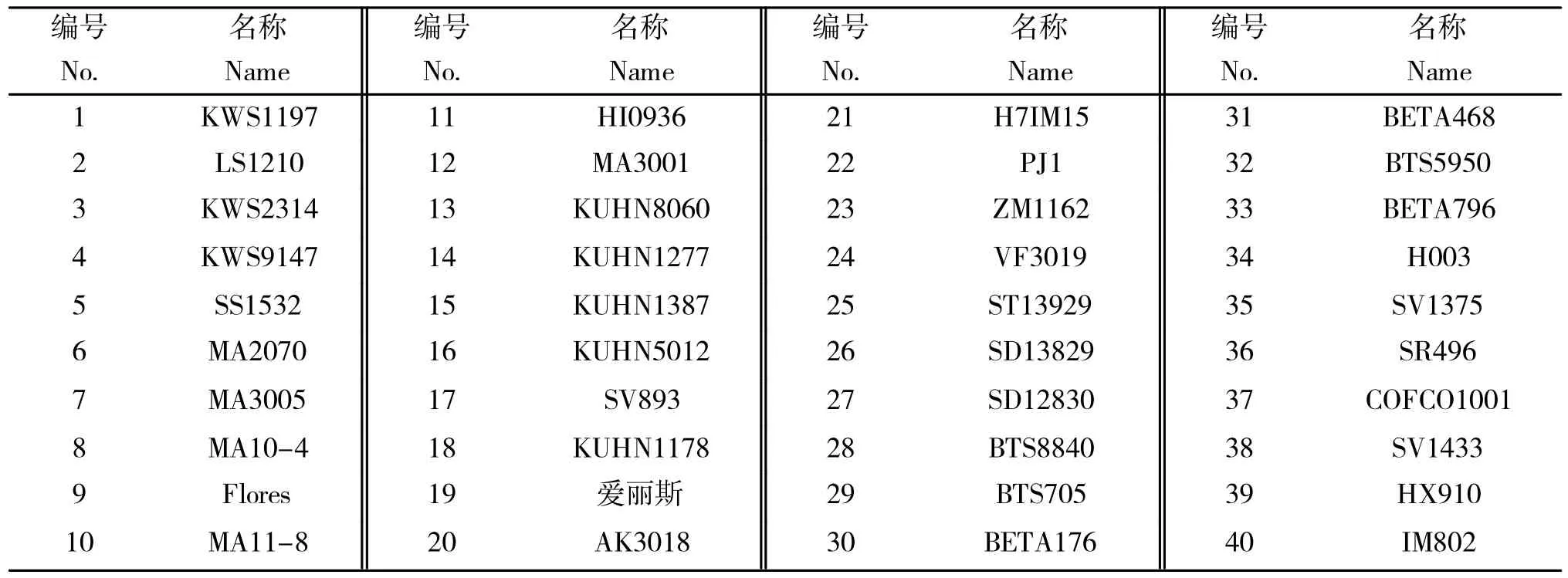
表1 40 个甜菜品种名称及品种编号Table1 Name and number of 40 sugar beet varieties
1.2 试验方法
1.2.1 DNA 的提取
甜菜基因组DNA 的提取采用改良的CTAB法[20],提取后利用核酸蛋白测定仪检测提取的DNA 浓度和纯度,并稀释到10 ng/µL。
1.2.2 DAMD引物
试验中所用的引物由上海生工生物工程有限公司合成,采用HAP方式纯化。引物序列来源于文献[21]。
1.2.3 PCR扩增体系及程序
PCR 扩增体系:5µL 体系中包含2×PCR Master Mix 2.5µL、模板DAN 1µL、引物0.4µL 以及1.1µL 的去离子水。
PCR 程序:采用Touchdown 程序,即94 ℃预变性3 min;94 ℃变性30 s,退火(65~56 ℃每降一度2 个循环)30 s,72 ℃延伸30 s。以后每个循环的退火温度依次降低2 ℃,直到56 ℃;再94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 min,15个循环;最后72 ℃延伸5 min。
1.2.4 PCR产物凝胶电泳
PCR 产物采用8%非变性聚丙烯酰胺凝胶进行电泳检测,电泳仪为BIORADPowerPac200。凝胶每孔点样量2µL,缓冲液为0.5×TBE,恒压180 V,电泳时间90 min。电泳结束后使用硝酸银法进行凝胶染色[22]。将胶放入到染色液中(180 mL蒸馏水、20 mL无水乙醇、0.4 g 硝酸银)5 min,然后取出放入装有100 mL蒸馏水的塑料盆中漂洗60 s,最后放入显影液(200 mL蒸馏水、6 g氢氧化钠、1 mL甲醛)中,直至出现清晰条带,立即拍摄图像保存。
1.3 数据统计
利用Mega7.0 软件计算品种间遗传距离,选择参数:Bootstrap Relications(1000),Gaps/Missing Date(Pairwise Deletion)用于设置空位处理原则,在计算两条序列的遗传距离时不仅不计算两条序列中任一条的空位位点,即使存在也不删除。Codon 1st+2nd+3rd+noncoding,用于设置计算遗传距离使用的密码子位点,选择为1~3 位和非编码的位点。Model(Nucleotide:p-distances)选择计算遗传距离的模型即核苷酸的遗传距离。D:Transitions+Transversion 表示同时利用转换和颠换值来计算遗传距离,根据计算结果建立UPGMA 聚类图。
2 结果与分析
2.1 甜菜DNA浓度及纯度测定
利用CTAB 法对40 个甜菜品种叶片进行DNA 提取,使用Thermo 公司NanoDrop 2000/2000c 紫外分光光度计测定提取的DNA 浓度和纯度。结果表明所有DNA 样品的OD260/OD280值均在1.7~1.8,符合进一步用于PCR扩增的要求,可用于甜菜DAMD指纹图谱的构建。
2.2 DAMD 引物的筛选
每个样品的DAMD扩增条带以0、1数据记录,在相同的迁移率位置上,有带记为1,无带记为0,利用降落PCR技术对适宜于甜菜基因组扩增的DAMD引物进行筛选,结果从29条DAMD 引物中筛选出8条核心引物,这8 条引物分别为URP1F、OGRB01、URP4R、URP13R、URP6R、URP2R、URP17R 和URP32F。筛选的引物名称、引物序列、扩增的总条带数、多态性条带数及多态性百分比见表2。从表2可以看出,8条引物扩增的多态性条带数最低7条,最多23条,8条引物共扩增多态性条带数为99条,扩增总条带数为101条,总的多态性百分比为97.22%。
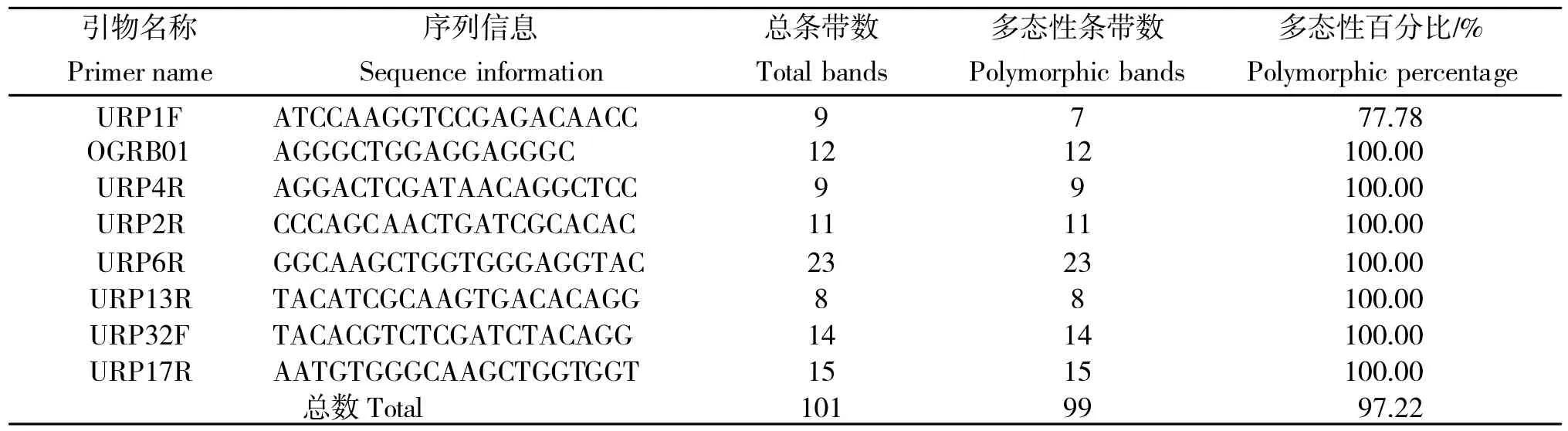
表2 筛选引物的基本信息及扩增产物信息Table2 The basic information and amplification product information of the selected primers
2.3 利用DAMD引物鉴别40个甜菜品种
以40个甜菜品种的DNA 为模板,从8条核心引物中随机选取URP1F、URP6R 和URP17R这3条引物作为鉴定40 个甜菜品种的DAMD 引物,进行PCR 扩增,产物经聚丙烯酰胺凝胶电泳后,如图1、2 和3 所示。由于DAMD 引物的多态性较高,在所用甜菜品种较少的情况下,非常适合采用特征谱带法实现对甜菜品种的鉴别。特征谱带法不需要构建0、1数据,每个品种都有一个属于自己的特征谱带,因此极其方便。引物URP6R的扩增结果如图1 所示,经过不同品种扩增的谱带进行一一比对可以看出,40个泳道的扩增条带均不一致,即利用引物URP6R 可以将40个甜菜品种一次性全部鉴定出来。引物URP17R 的扩增结果如图2 所示,经过对不同品种扩增的谱带进行一一比对后发现,40个泳道的扩增条带中,除了无法鉴别15号与29 号品种以及4 号与33 号品种外,其余泳道的条带均不一致,每个品种均具有自己独特的带型。引物URP1F 的扩增结果如图3 所示,利用特征谱带法可看出,15 号与29号泳道的扩增条带不一致,4 号与33号泳道的扩增谱带也不相同。因此利用引物URP17R与引物URP1F组合可以将40个甜菜品种全部鉴定出来。
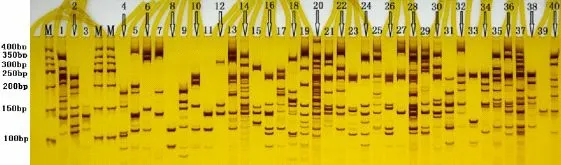
图1 引物URP6R扩增图Fig.1 Fingerprint of primer URP6R amplification

图2 引物URP17R扩增图Fig.2 Fingerprint of primer URP17R amplification
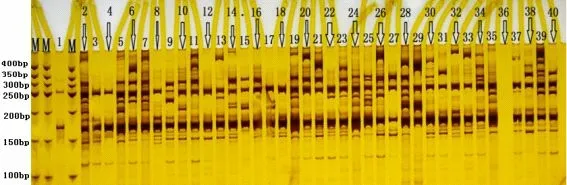
图3 引物URP1F扩增图Fig.3 Fingerprint of primer URP1F amplification
2.4 UPGMA聚类分析
每个样品的DAMD 扩增条带型以0、1统计建立数据记录库。在相同的迁移率位置上,以有带记为1,无带记为0,记录每个样品的扩增带。利用Mega7.0软件计算品种间遗传距离,根据计算结果建立UPGMA聚类图。由图4可以看出,在遗传距离为0.25时,可将40个品种分为2个类群。第I个类群为14号品种,第II个类群在遗传距离为0.21 时,又被分为2 个亚群,II-1包括品种25 号,II-2 包括剩余的38 个品种。遗传距离范围为0.01~0.25,其中31 号与36 号品种最相近,遗传距离系数为0.02。8 号与17 号及18 号与32 号也具有极高的相似性,遗传距离系数为0.03。其中1 号和3 号与4 号和22号遗传距离相等,都为0.05。5号和6号与7号和35号遗传距离相等,为0.07。10号和20号与34号和38 号遗传距离相等,为0.12。通过DAMD 引物的扩增结果,参试品种之间均可以区分。

图4 基于扩增条带计算的40个甜菜品种UPGMA聚类图Fig.4 UPGMA cluster diagram of 40 sugar beet varieties based on amplification bands calculation
3 讨论与结论
分子标记技术可以克服传统形态学标记鉴定的一系列弊端[23]。DAMD 分子标记具有分辨率高、多态性高、操作相对简单等优点,与RFLP 技术的复杂操作相比,基于简单PCR 的DAMD 技术更受研究者的青睐[24]。此外,DMAD 引物的反应可在高严谨的条件下进行,其反应的稳定性明显高于RAPD[25]。与单引物的SCoT相比,单个DAMD引物中检测到的多态位点远高于单个SCoT引物检测到的多态位点,具有极高的多态性,与同样具有高多态性的AFLP 技术相比,DAMD 引物没有专利的限制,且扩增的条带更清晰和易于识别[26]。因此在群体遗传结构和遗传多样性分析、物种进化、遗传图谱构建、基因定位及分子标记辅助育种等领域,DAMD技术具有极高的应用价值。
本试验从29 条DAMD 引物中筛选出8 条扩增条带清晰、易于识别、多态性高的引物,可做为甜菜品种鉴定的核心引物,8 条引物扩增的多态性条带数7~23,总计扩增多态性条带数为99 条,扩增总条带数为101条,多态性为97.22%。由于DAMD 引物的高多态性可以采用特征谱带法,单独使用引物URP6R 即可鉴别全部40个甜菜品种,引物URP1F和引物URP17R共同使用也可以鉴别40个甜菜品种。同时根据扩增产物建立0、1 数据库计算出品种间遗传距离范围为0.01~0.25,在遗传距离为0.25 时,可将40 个品种分为2 个类群。类群之下可分成多个亚群,通过遗传距离建立的聚类图也可将甜菜品种逐一鉴别。从试验结果看,每一个DAMD 引物单独使用都可以鉴别十到几十个品种,如果8 条引物同时使用,理论上可以鉴别几百个品种,DAMD扩增产物的带型丰富,因此在构建完成每个品种的特征谱带后,只需要利用谱带进行对照就可以实现对甜菜品种的鉴别,极其方便快捷。DAMD 的高多态性为高效快速鉴定甜菜品种提供了可能,同时利用Mega 进行聚类分析可以进一步分析甜菜品种的遗传多样性。本试验研究结果表明DAMD 技术适用于甜菜品种鉴定,并且表现出了优秀的多态性和鉴别力,在建立快速鉴别甜菜品种,分析品种遗传信息等方面具有良好的应用前景,可避免甜菜种植以及育种过程中出现甜菜品种混杂、种子纯度不足及产量下降等一系列的问题,避免相似品种育种低效化,在很大程度上可以保护育种家与种植者的利益。

