硝酸对溶胶-凝胶法制备AlOOH胶粒粒度的影响
段 宁,张湘泰,陆成龙,张银凤,,李崇瑞
(1.武汉科技大学资源与环境工程学院,武汉 430081; 2.湖北理工学院,矿区环境污染控制与修复湖北省重点实验室,黄石 435003)
0 引 言
溶胶-凝胶法由于具有工艺设备简单、成本低廉、化学成分可控、可在相对低温下制备高纯、小孔径的陶瓷膜等优点[1-2],被普遍认为是制备陶瓷滤膜最有效的方法之一[3]。氧化铝膜具有耐高温、耐腐蚀等优点,是目前应用最为广泛的一类无机膜[4-5]。溶胶-凝胶法制备氧化铝滤膜的关键是溶胶的制备方法,其对滤膜的孔径及孔径分布等参数有很重要的影响。孔径是氧化铝膜的重要参数,对氧化铝膜的选择透过性有巨大影响[6]。孔径的大小和孔径分布是滤膜质量控制的主要指标。只有实现孔径的高度均匀,才能提高滤膜的过滤精度。
胶粒的粒径分布是影响氧化铝滤膜孔径和孔径分布的直接原因之一,滤膜的孔隙是由涂覆在支撑体上的胶粒交联、堆积形成的,其孔径分布及孔的形状则分别取决于胶粒的粒度分布及胶粒的形状[7]。故胶粒的粒度直接影响陶瓷膜的孔径大小,胶粒的粒度分布宽度也直接影响着陶瓷膜孔径分布的宽度。所以,通过控制溶胶粒径分布来控制陶瓷膜孔径的大小及分布,对调节陶瓷膜的孔径分布十分重要。
溶胶-凝胶法可以分为金属醇盐水解法和无机盐水解法。前者通常加入酸作为胶溶剂,使粒子均匀分散形成胶体体系[8]。其中胶溶剂的类型对溶胶的稳定性及其粒度分布有着很大影响。刘智信等[9]研究认为在以异丙醇铝为前驱体制备AlOOH溶胶中硝酸是最适合的胶溶剂。研究表明[10],硝酸的加入量对AlOOH溶胶的稳定性有很大影响,硝酸与异丙醇铝的比例R(R=n(HNO3) ∶n(Al(C3H7O3)3),摩尔比,下同)控制在合适范围内,可以制得澄清透明的溶胶。当R过小时,沉淀不能完全被胶溶,在容器底部留下沉淀;当R过大时,制备出的溶胶不稳定易凝胶[11]。此外,加入的硝酸也可以作为催化剂促进水解反应[12],提高反应速率,促进水解产物晶粒生长。因此,硝酸加入量对AlOOH溶胶的粒径有着很大影响。
目前,在制备AlOOH溶胶时,硝酸对胶粒的生长和粒度分布的影响的相关报道较少。本文以异丙醇铝为前驱体、水为反应介质、硝酸为胶溶剂制备AlOOH溶胶,并深入研究溶胶-凝胶法中硝酸对水解反应的影响,为在制备中控制氧化铝滤膜的孔径分布提供重要参考。
1 实 验
1.1 试剂与仪器
溶胶-凝胶法制备AlOOH溶胶所采用的化学试剂包括:异丙醇铝(上海麦克林公司;分析纯)、无水乙醇(上海国药;分析纯)、浓硝酸(上海国药;分析纯)。
试验制备与表征所用仪器设备包括:集热式恒温加热磁力搅拌器(上海力辰邦西仪器科技有限公司,DF-101S)、电子天平(上海越平科学仪器有限公司,FA2204C)、Zetasizer Nano粒度/电位分析仪(马尔文仪器有限公司(中国),ZEN3690)、场发射扫描电子显微镜(日本电子株式会社,JSM-6710Fp)、X射线衍射仪(布鲁克科技有限公司,D8A)。
1.2 制备方法
以异丙醇铝为原料的AlOOH溶胶制备流程如图1所示。准确量取75 mL纯水于三口烧瓶中,于85 ℃恒温水浴搅拌。精确称取11.33 g异丙醇铝料,使异丙醇铝与水的摩尔比为1 ∶75,缓慢加入三口烧瓶中,水解1.5 h。滴加一定量硝酸胶溶剂(见表1),使沉淀分散,继续搅拌1 h,得到澄清透明的AlOOH溶胶。
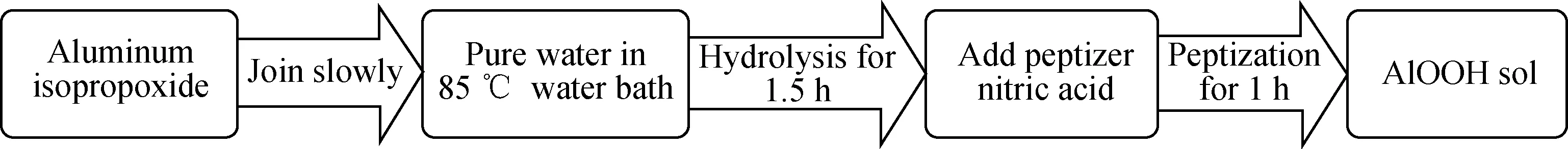
图1 AlOOH溶胶制备流程图Fig.1 Preparation process of AlOOH sol

表1 硝酸胶溶剂加入量Table 1 Scheme of addition amount of nitric acid peptizer
1.3 测试表征
将凝胶化的AlOOH溶胶干燥后制成粉末,采用X射线衍射仪(XRD)在扫描范围为5°~90°下对其进行物相分析。
采用场发射扫描电子显微镜,对两种方式制备的AlOOH胶粒样品进行分析(①将AlOOH溶胶静置至凝胶化后干燥,制得样品;②将AlOOH溶胶稀释于乙醇中,滴于铝片上,待乙醇挥发化之后制得样品)。
采用Zetasizer Nano粒度/电位分析仪的粒度测量功能对AlOOH溶胶的粒度分布进行分析。为避免由颗粒团聚而造成测量误差,将各组溶胶稀释15倍,测定稀释后溶胶的吸光度与折射率,输入激光粒度分析仪,测定粒度分布。同时测定未稀释的AlOOH溶胶粒度分布。
采用Zetasizer Nano粒度/电位分析仪的Zeta电位测量功能对各组溶胶样品进行zeta电位测定。
2 结果与讨论
2.1 物相分析
使用异丙醇铝为前驱体,硝酸与异丙醇铝不同比例R制得AlOOH溶胶样品如图2所示。未加入硝酸反应体系白色的异丙醇铝粉末无法在试验时间内完全水解,如图2(a)所示;当R<0.2时,容器底部有大量的白色沉淀,上层为浑浊不透明液体,这说明在硝酸比例过低时,只能呈现出悬浮液的外观,而无法将沉淀分散形成澄清透明的溶胶,如图2(b)所示;当R≥0.2时,如图2(c)所示,白色沉淀完全溶解,液体在光线照射下出现丁达尔效应,形成了透明的溶胶。

图2 硝酸与异丙醇铝不同比例R制得AlOOH溶胶样品图Fig.2 Graph of AlOOH sol under different R (n(HNO3) ∶n(Al(C3H7O3)3))
凝胶化的溶胶干燥粉末的XRD谱图如图3所示。由图3可看出,制得的溶胶粉末具有良好的结晶度,产物在衍射角(2θ)为:14.49°、28.18°、38.34°、48.93°、49.21°、55.22°、60.59°、 64.03°、64.98°、71.90°位置的衍射峰与标准PDF卡片21-1307勃姆石(AlOOH)的晶面(020)、(120)、(031)、(051)、(200)、(151)、(080)、(231)、(002)、(251)的衍射数据相对应,可知制得溶胶颗粒的成分为勃姆石(AlOOH)。
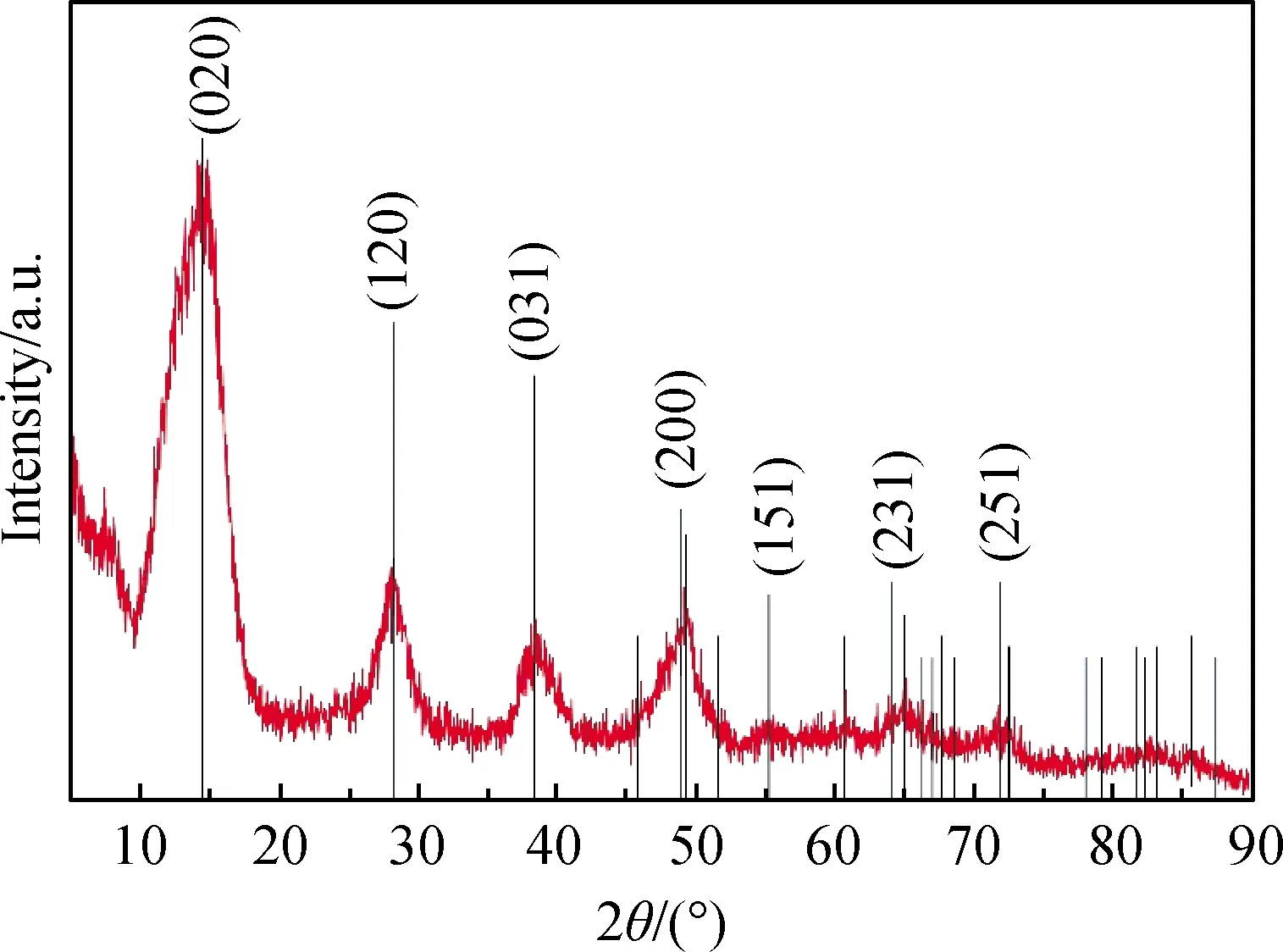
图3 干燥后溶胶粉末的XRD谱Fig.3 XRD pattern of dried sol powder
2.2 硝酸用量对AlOOH溶胶凝胶时间的影响
为确定硝酸用量对AlOOH溶胶的凝胶时间影响规律,以获得最佳的硝酸用量,按照表1制备各组样品,并记录凝胶时间(记倾斜45°液面不发生流动的时间点为凝胶时间)。硝酸与异丙醇铝比例(R)对凝胶时间的影响如图4所示。
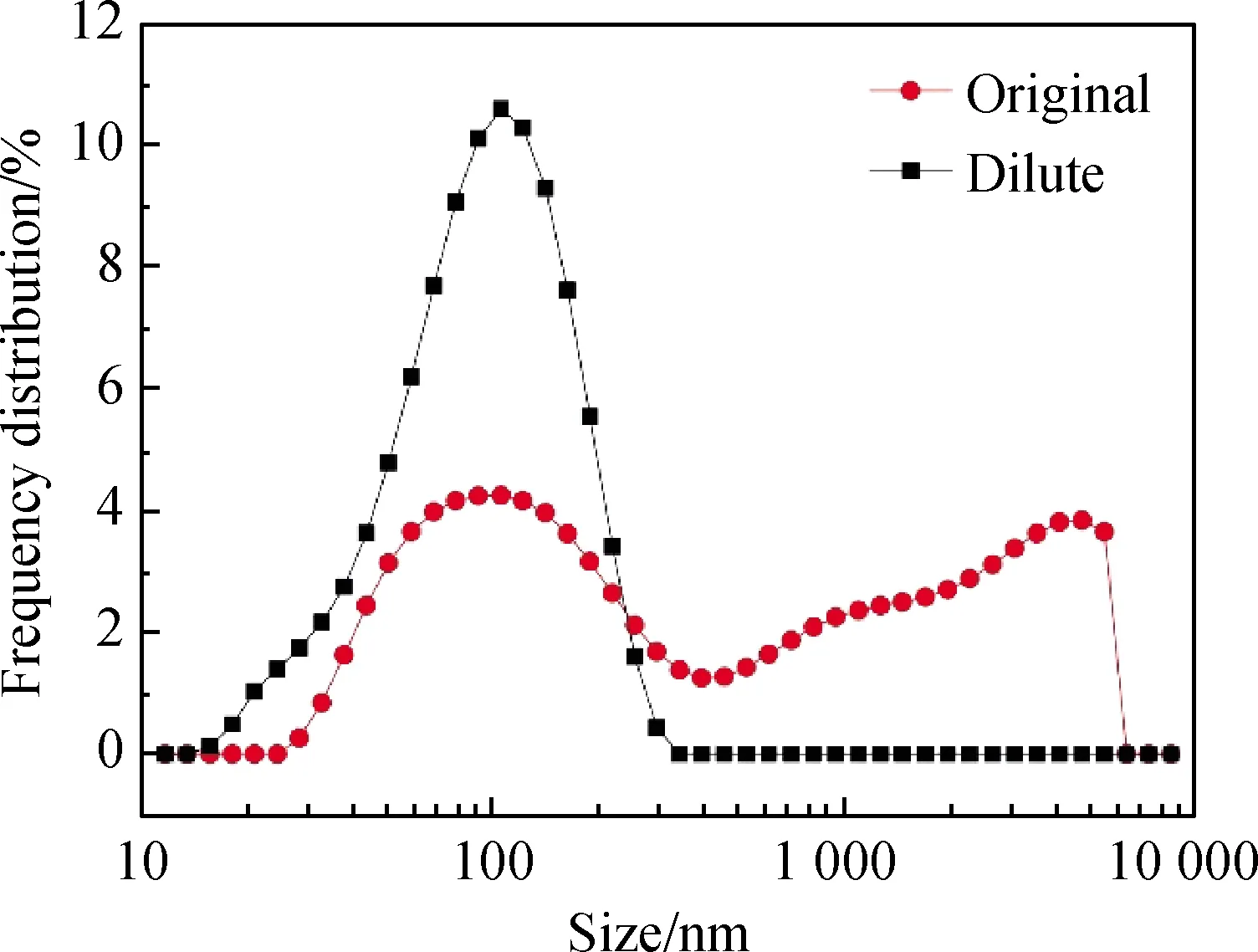
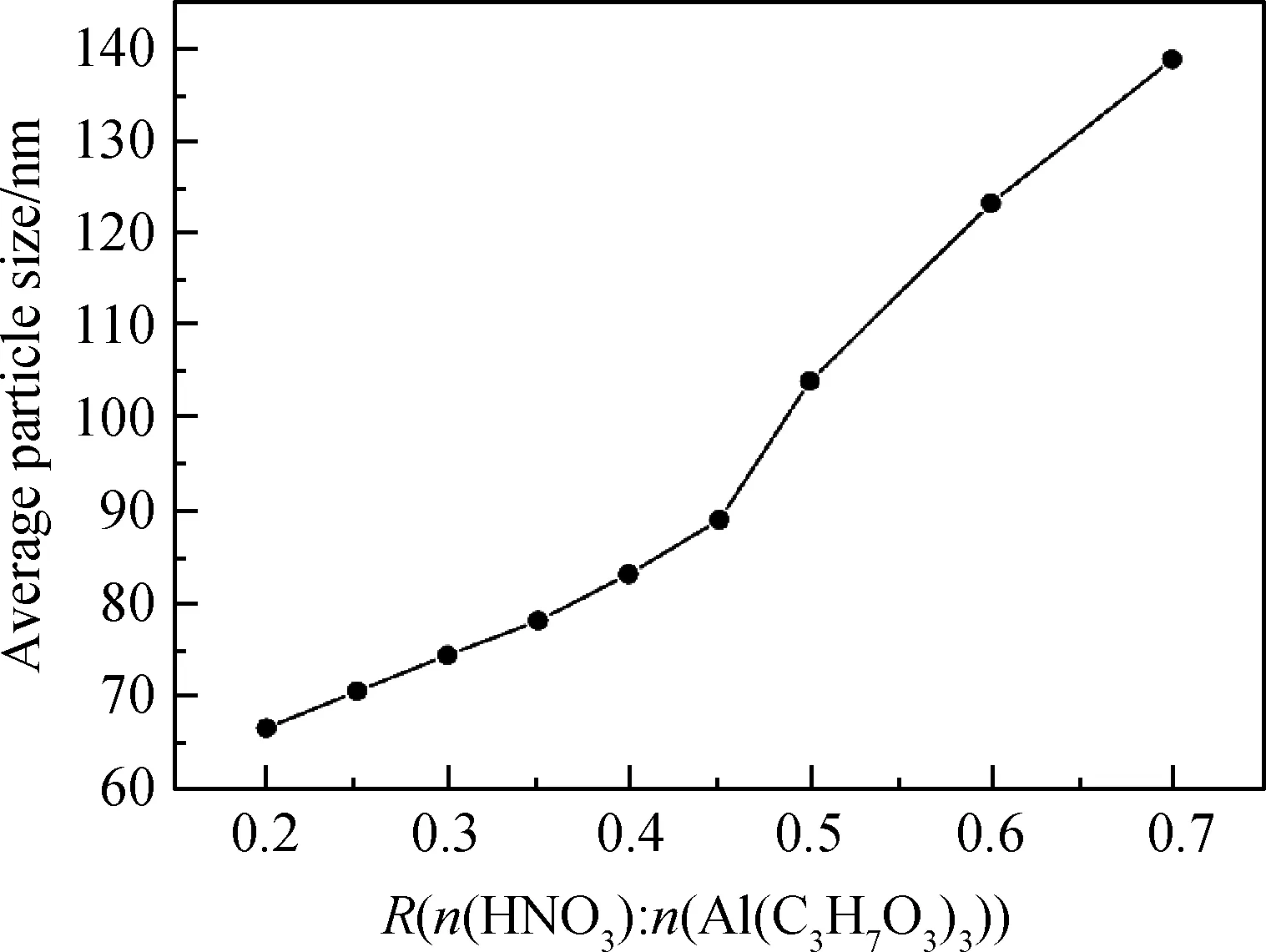
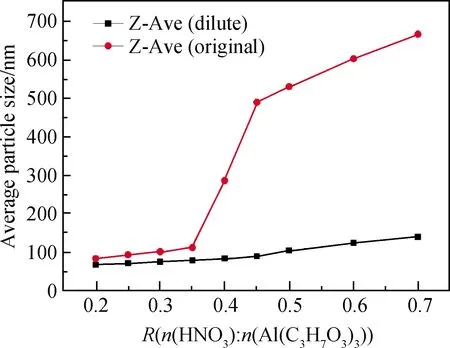
从图4中可知,随着硝酸用量增加,溶胶的凝胶时间下降,AlOOH溶胶的凝胶时间从288 h(R=0.2)下降到了0.2 h(R=0.7)。凝胶时间是溶胶稳定性的体现,当R=0.7时,制得溶胶的凝胶时间过短,溶胶难以保存,且凝胶化的过程会伴随着黏度上升,使溶胶涂膜的时机难以控制。因此,硝酸与异丙醇铝的最佳比例为0.2 图4 硝酸与异丙醇铝比例R对凝胶时间的影响: (a)凝胶时间曲线;(b)溶胶样品图;(c)凝胶样品图Fig.4 Influence of R(n(HNO3) ∶n(Al(C3H7O3)3)) on gelation time: (a) curve of Gelation time; (b) graph of sol sample; (c) graph of gel sample AlOOH溶胶颗粒不同倍数的SEM照片如图5所示。由图5(a-1)中可看出,样品a为不规则的微米级颗粒,在高倍下为致密的光滑平面,但无法观测到胶粒,并未体现出纳米颗粒的特征。这是因为AlOOH凝胶的比表面积过大,干燥时因毛细管力严重收缩,导致无法观测到胶粒。由图5(b-1)与图5(b-2)可看出,样品b为粗糙的球形颗粒,粒径均匀,粒径多小于100 nm,溶胶颗粒堆积形成众多的孔隙。由于溶胶失水收缩速率不一致,在收缩较快处出现一些如下所示的微米级大孔,从更高倍数的图5(b-2)可以看到,大孔并未完全贯通,依然存在大量的溶胶颗粒堆积。 未稀释的AlOOH溶胶与稀释15倍的溶胶粒度分布如图6所示。由图6可看出,稀释后的溶胶频率分布为类似正态分布的单峰曲线,这表明AlOOH胶粒分散较好,未出现严重团聚的现象。而未稀释的AlOOH溶胶因团聚表现出多峰曲线。为避免团聚影响,将溶胶稀释15倍后使用Zetasizer Nano粒度分析仪进行分析测量。硝酸与异丙醇铝不同比例AlOOH溶胶胶粒的频率/累积分布曲线如图7所示。 图6 AlOOH溶胶样品与溶胶稀释样品的频率分布图Fig.6 Frequency distribution of AlOOH sol sample and diluted sol sample 图7 硝酸与异丙醇铝不同比例AlOOH溶胶胶粒的频率/累积分布曲线Fig.7 Frequency and cumulative distribution curves of AlOOH colloidal particles under different R(n(HNO3) ∶n(Al(C3H7O3)3)) 硝酸与异丙醇铝比例R对AlOOH溶胶平均粒径的影响如图8所示。由图8可看出,在AlOOH溶胶的制备中,硝酸加入量与胶粒平均粒径呈正相关关系。当硝酸与异丙醇铝比例R为0.2时,溶胶的平均粒径为66.69 nm;随着硝酸与异丙醇铝比例R增大,溶胶的平均粒径逐渐增大至138.80 nm(R=0.7)。由此可知,增加硝酸加入量,可以显著地提高AlOOH胶粒的粒径。 图8 硝酸与异丙醇铝比例R对AlOOH溶胶平均粒径的影响Fig.8 Influence of R(n(HNO3) ∶n(Al(C3H7O3)3)) on average particle size of AlOOH sol 由图7可看出,除了平均粒径外,各组溶胶样品的粒径分布宽度也存在差异。粒度分布越窄,表明溶胶颗粒尺寸的均匀性越好,以此制得的氧化铝分离膜的孔径分布也越均匀。以粒径分布的半高宽(FWHM)表示粒度分布的宽窄,硝酸与异丙醇铝比例R对胶粒粒度分布半高宽的影响如图9所示。由图9可知,随着硝酸与异丙醇铝比例R增大,AlOOH胶粒粒径分布半高宽表现出波动变化,其半高宽由144.62 nm(R=0.2)下降到了111.56 nm(R=0.3)。经过多次波动后增加到267.74 nm(R=0.7),说明硝酸加入量增加使粒度分布总体变宽。 图9 硝酸与异丙醇铝比例R对胶粒粒度分布半高宽的影响Fig.9 Influence of R(n(HNO3) ∶n(Al(C3H7O3)3)) on FWHM of frequency distribution of AlOOH sol 将各组直接制得的未稀释溶胶样品进行粒度分析,绘制其平均粒径-硝酸与异丙醇铝比例R曲线如图10所示。从图10各组未稀释溶胶的平均粒径变化曲线可看,当R增大时,确实会使胶粒团聚,而导致测得的平均粒径增大。从图6的稀释前后粒度分布图可以看出,团聚的原样测得的粒度数据表现为无规律的双峰或多峰图像,而图7所示的稀释溶胶的粒度分布均为近似正态分布的单峰图像,因此测得稀释样品的胶粒团聚程度非常轻。 图10 溶胶样品与溶胶稀释样品的硝酸与 异丙醇铝比例R-平均粒径曲线Fig.10 R(n(HNO3) ∶n(Al(C3H7O3)3))-average particle size curve of sol sample and diluted sol sample 硝酸与异丙醇铝比例R对AlOOH溶胶Zeta电位的影响如图11所示。从Zeta电位测试结果可知,随着硝酸与异丙醇铝比例R的增大,Zeta电位表现出先上升后下降的趋势。其中当R=0.2时,Zeta电位为26.6 mV,随着R的增大Zeta电位达到最高(41.2 mV;R=0.35),随着R的进一步增大,Zeta电位开始下降,最终下降到最低(16.3 mV;R=0.7)。 图11 硝酸与异丙醇铝比例R对AlOOH溶胶 Zeta电位的影响Fig.11 Influence of R(n(HNO3) ∶n(Al(C3H7O3)3)) on Zeta potential of AlOOH sol 从上述Zeta电位与平均粒径的测试结果可看出,当R≤0.35时,AlOOH溶胶的Zeta电位随着R的增大而增大,溶胶稳定性增强,颗粒团聚程度变轻,但其平均粒径也随着R增大而增大。因此,Zeta电位与团聚理论无法解释胶粒增大的原因。 为明确AlOOH胶粒增大的内在原因,需研究AlOOH胶粒产生的反应过程。使用异丙醇铝制备AlOOH溶胶可分为水解反应与缩聚反应[16]。具体反应式如下: 水解反应如式(1)所示: Al[OCH(CH3)2]3+nH2O→Al[OCH(CH3)2]3-n(OH)n+n(CH3)2CHOH (1) 缩聚反应可分为脱水缩聚和脱醇缩聚: 脱水缩聚如式(2)所示: Al[OCH(CH3)2]3-n(OH)n+Al[OCH(CH3)2]3-m(OH)m→ (OH)n-1[CH(CH3)2O]3-n—Al—O—Al—[CH(CH3)2O]3-m(OH)m-1+H2O (2) 脱醇缩聚如式(3)所示: [CH(CH3)2O]3-nAl(OH)n+[CH(CH3)2O]3-mAl(OH)m→ (OH)n[CH(CH3)2O]2-nAl—O—Al[CH(CH3)2O]m(OH)m-1+CH(CH3)2OH (3) 从上述反应式中可以看出,异丙醇铝生成AlOOH胶粒,第一步的水解反应由异丙醇铝水解生成异丙醇与含有羟基的中间产物,与此同时缩聚反应就立即开始,缩聚反应的进行使中间产物成核并生长。反应速率方程可由下列公式表示: (4) (5) (6) 其中式(4)表示异丙醇铝的反应速率,式(5)代表中间产物的反应速率,式(6)表示AlOOH胶粒的反应速率,Khy表示水解反应速率常数,Kdh代表脱水缩聚反应速率常数,Kda表示脱醇缩聚反应速率常数。 酸在溶胶-凝胶法中,除了作为使胶体体系稳定的胶溶剂外,还可以作为促进水解反应的催化剂[17]。在一个反应体系中,速率最慢的步骤为速率控制步骤,其反应速率常数低于其他步骤。王焆等[18]的研究认为,在以酸为催化剂的体系中,水解速率远小于缩聚速率。在本试验中,未加入硝酸的反应体系中白色异丙醇铝粉末无法在试验时间内完全水解;随着硝酸与异丙醇铝摩尔比R的增大,白色沉淀溶解的速度加快。在本试验中,反应速率是由水解反应控制的,硝酸加入量的增大可使水解反应速率增大。因此,硝酸影响粒径的机理是通过提高水解反应速率来增大中间产物浓度,使胶粒核周围能参与缩聚反应的物质增加而使胶粒生长加快。 根据颗粒团聚理论与反应过程分析,绘制图12所示的示意图以描述硝酸影响胶粒生长的机理。AlOOH胶粒的成核与生长是通过缩聚反应进行控制的,其反应物是水解反应产生的中间产物。硝酸作为水解反应的催化剂,当硝酸加入量低时,水解反应速率常数Khy小,使得异丙醇铝水解的中间产物在单位体积内浓度小,少量中间产物缩聚后即形成胶粒核,胶粒核生成后仅能与周围少量的中间产物发生缩聚反应,使胶粒核多而生长慢,限制了AlOOH胶粒的增大;当硝酸加入量增大时,水解反应速率常数Khy增大,单位体积内的中间产物浓度随之增加,大量的中间产物缩聚形成胶粒核,且能与更多中间产物发生缩聚反应,使AlOOH胶粒随之增大。胶粒生长的同时,溶剂中的H+吸附在胶粒表面形成双电层结构,阻止胶粒互相接近团聚,并形成溶胶。 图12 硝酸加入量对粒径影响示意图Fig.12 Mechanisms of the influence of the amount of nitric acid on the particle size 异丙醇铝的水解反应速率小,胶粒核在整个反应过程中都将持续产生,而率先产生的AlOOH胶粒核随着反应的进行不断生长,后产生的胶粒核没有足够的中间产物参与缩聚反应,使粒度分布变宽。 溶胶-凝胶法能够通过控制溶胶的粒径分布来控制滤膜孔径及孔隙率的大小,在氧化铝滤膜的制备中被广泛应用。本文以异丙醇铝为原料,硝酸为胶溶剂,利用溶胶-凝胶法制备AlOOH溶胶,通过纳米粒度分析、Zeta电位等表征手段,研究硝酸用量对AlOOH胶粒粒度及粒度分布的影响。 (1)硝酸与异丙醇铝的摩尔比R(n(HNO3) ∶n(Al(C3H7O3)3))为0.2~0.7时,胶粒的平均粒径随着R增大而增大,从66.69 nm(R=0.2)增加到138.80 nm(R=0.7);胶粒的粒度分布半高宽不断波动,但硝酸用量增加使粒度分布总体变宽,其半高宽由144.62 nm(R=0.2)下降到了111.56 nm(R=0.3),后经过多次波动增加到267.74 nm(R=0.7)。 (2)硝酸使AlOOH胶粒平均粒径增大的原因并非是Zeta电位变化而导致的团聚,而是硝酸作为催化剂增大了速率控制步骤——水解反应的反应速率常数,从而使单位体积内可以发生缩聚的中间产物增加,AlOOH胶粒增大。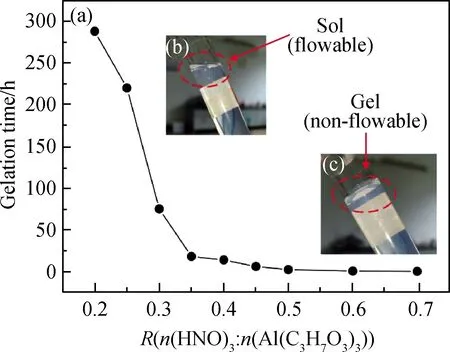
2.3 硝酸用量对AlOOH胶粒粒径及分布的影响


2.4 以颗粒团聚角度分析胶粒粒径变化的原因

2.5 硝酸影响AlOOH胶粒粒径的作用机理

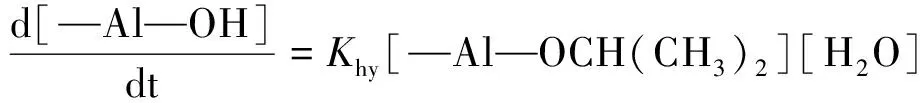
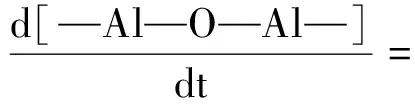

3 结 论

