谷胱甘肽过氧化物酶4介导的铁死亡在非小细胞肺癌顺铂耐药中的作用
张清峰,刘 奎,杨晓燕,唐 波,黄 云
自贡市第四人民医院 胸心外科 (自贡 643000)
全世界每年死于肺癌的人数超过100万。在肺癌患者中约80%的病例是非小细胞肺癌(non-smallcelllungcancer,NSCLC)[1-2]。手术是治疗早期NSCLC的主要方法,但大多数NSCLC患者在确诊时已属于晚期并伴有远处转移[2-3],因此,化疗是其主要治疗手段。顺铂(cis-diaminodichloro platinum,DDP)是目前NSCLC在临床治疗中的首选药物,治疗效果较好[4]。但在化疗过程中,DDP易产生耐药性,导致治疗失败[5],因此需要深入研究DDP的耐药机制。
铁死亡是新近发现的一种新的细胞死亡模式,不饱和脂肪酸过氧化,使脂质过氧化ROS(Lipid ROS)积聚,最终引起细胞死亡[6-8]。已有研究[9-11]报道,肿瘤细胞的耐药性与谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)的表达和活性相关。GPX4可保护肿瘤细胞膜免受Lipid ROS的影响,从而对化疗药物产生耐药性,抑制GPX4的活性,可提高肿瘤细胞对化疗药物的敏感性[9]。而GPX4是铁死亡过程中重要的Lipid ROS调控分子,其对Lipid ROS的清除可抑制铁死亡发生[12-13]。研究[14-15]显示,GPX4在NSCLC中可促进肿瘤细胞的增殖与转移;在NSCLC细胞中抑制GPX4的表达,能明显增强其对化疗药物的敏感性。以上研究表明,GPX4调控的铁死亡发生可能与肿瘤细胞的化疗药物耐药性密切相关。因此,本文以GPX4介导的铁死亡为切入点,研究GPX4介导的铁死亡发生在A549/DDP耐药中的作用,为NSCLC的临床用药提供理论基础。
1 材料与方法
1.1 细胞与试剂
人NSCLC细胞株(A549)、人NSCLC DDP耐药株(A549/DDP)购自中国科学院上海细胞库;RPMI-1640培养基、链霉素、青霉素、0.25%胰酶购自美国Hyclone公司;活性氧自由基(ROS)检测试剂盒、Lipo8000转染试剂、RIPA裂解液购买自上海Beyotime公司;胎牛血清购自德国PAN公司;CCK-8试剂盒、Lipid ROS检测试剂盒(Liperfluo)购自日本同仁化学公司;RSL3、Fer-1、DDP购自美国Selleck公司;鼠抗β-actin、GAPDH单克隆抗体购自武汉Abclonal公司;兔抗GPX4购自美国Bimake公司;兔二抗、鼠二抗购自北京中杉金桥公司。
1.2 细胞培养
A549与A549/DDP细胞放置在含10%胎牛血清与1%双抗的RPMI1640培养基中,置于37 ℃、5%CO2恒温孵箱中培养,待细胞密度在80%~90%时,用浓度为0.25%的胰酶消化传代。
1.3 细胞转染及分组
取对数生长期的A549细胞,胰酶消化后,按照每孔70%左右的比例铺于6孔板中,培养过夜后,按照Lipo8000说明书要求转染pcDNA3.1-GPX4及pcDNA3.1质粒至A549细胞,根据转染质粒不同分为阴性对照组(pcDNA3.1组)以及质粒过表达组(pcDNA3.1-GPX4组)进行后续的CCK8及蛋白质印迹技术检测。
1.4 CCK-8法检测细胞增殖
取对数生长期的细胞加入96孔板中 (5×103个/孔、150 μL/孔),于恒温孵箱中培养。待细胞贴壁后,换新鲜培养基,加入不同浓度的DDP(0、1、2、4、8、10 g/L),置于恒温孵箱中继续培养48 h,然后按照CCK8试剂盒说明书检测细胞增殖,计算细胞对药物抑制率为50%时的药物浓度(50% inhibitory concentration,IC50)值。
1.5 蛋白质印迹技术
取对数生长期的A549、A549/DDP细胞,A549转染阴性对照质粒及GPX4过表达质粒后的细胞,用DDP(5 μg/mL)、RSL3(2 μg/mL)、DDP+RSL3处理48 h后的细胞,胰酶消化后,用PBS洗两次。加入适量RIPA裂解液,置于冰上裂解30 min后,4 ℃,12 000 r/min,离心半径13.5 cm;离心15 min,收集上清,加入5×蛋白loading buffer制样。用浓度为12%的SDS-PAGE电泳后转0.22 μm的PVDF膜。将转好的PVDF膜用5%的脱脂奶粉于室温下封闭1 h,然后一抗4 ℃孵育过夜。第2天,用TBST洗涤一抗孵育过夜的PVDF膜3次,10 min/次。二抗室温孵育1 h,TBST洗涤3次,10 min/次。用显影液与曝光机曝光。
1.6 细胞总ROS含量测定
将pcDNA3.1及pcDNA3.1-GPX4质粒转染A549/DDP细胞48 h后,分别用DDP(5 μg/mL)、RSL3(2 μg/mL)、Fer-1(1 μmol/mL)、DDP(5 μg/mL)+Fer-1(1 μmol/L)、DDP(5 μg/mL)+RSL3(2 μg/mL)继续处理48 h。将处理后的细胞用0.25%的胰酶消化后,用1×PBS缓冲液洗涤细胞2次,按照试剂盒要求加入适量DCFH-DA染色液,37 ℃孵育30 min,每隔3~5 min颠倒混匀1次。孵育完成后用无血清1640培养基洗涤细胞3次,充分去除未进入细胞的染色液,用流式细胞仪(488 nm/525 nm)检测,并进行数据分析。
1.7 Lipid ROS含量测定
将上述处理后的细胞用0.25%的胰酶消化后,用1×PBS缓冲液洗涤细胞2次,按照试剂盒要求加入适量Liperfluo染色液,37 ℃孵育20 min,每隔3~5 min颠倒混匀1次。孵育完成后用无血清1640培养基洗涤细胞3次,充分去除未进入细胞的染色液,用流式细胞仪(488 nm/525 nm)检测,并进行数据分析。
1.8 统计学方法
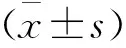
2 结果
2.1 GPX4在A549与A549/DDP细胞中的表达
蛋白质印迹技术结果显示,在A549/DDP中GPX4的表达高于A549细胞,差异有统计学意义(t=7.880,P= 0.001)(图1)。
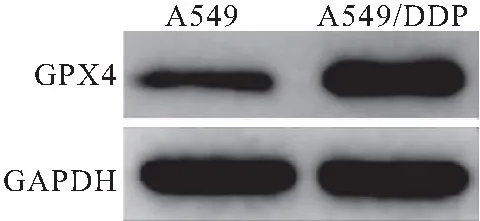
图1 GPX4在A549与A549/DDP细胞中表达比较
2.2 GPX4在A549细胞中过表达对DDP耐受性的影响
在A549细胞中转染GPX4的过表达质粒pcDNA3.1-GPX4后,与对照组(转染pcDNA3.1空载)相比,GPX4的表达量明显增加(t=10.810,P=0.001)(图2)。CCK8结果显示,GPX4在A549细胞中过表达后,可明显增强A549细胞对DDP的耐受性(P<0.05)(表1)。

图2 GPX4在A549细胞中过表达对DDP耐受性的影响
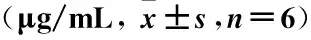
表1 DDP在两组中的IC50值比较
2.3 RSL3对A549/DDP细胞DDP敏感性的影响
用铁死亡激动剂RSL3可以抑制A549/DDP细胞内GPX4的表达(t=4.930,P=0.008);将RSL-3与DDP联用,与单独的DDP处理组以及RSL-3处理组相比,GPX4表达量下调更加明显(P<0.05)(图3),并且增强A549/DDP细胞对DDP的敏感性(图4)。

图3 DDP、RSL3对A549/DDP细胞中GPX4表达的影响
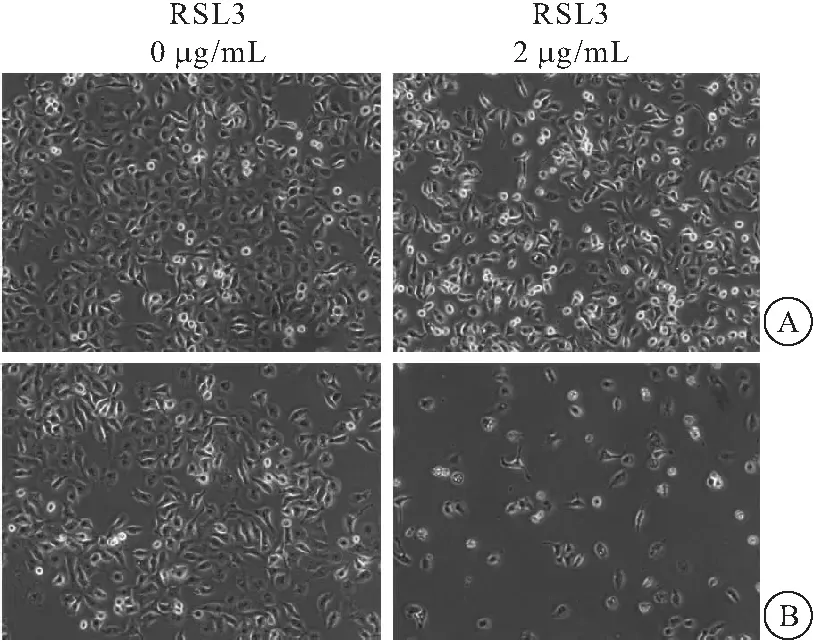
图4 RSL3对A549/DDP细胞DDP敏感性的影响(×10)
2.4 铁死亡对A549/DDP细胞DDP敏感性的影响
为进一步明确GPX4介导的铁死亡与A549/DDP耐药的关系,用铁死亡抑制剂Fer-1处理A549/DDP细胞的同时,再用DDP处理,48 h后试剂盒检测铁死亡Marker(细胞活力、ROS以及Lipid ROS),结果显示,DDP、RSL3处理A549/DDP细胞后,细胞铁死亡发生;而将两者连用后,细胞铁死亡发生更加明显,细胞对DDP敏感性增强。但用Fer-1抑制铁死亡发生时,Fer-1对A549/DDP细胞铁死亡发生没有明显影响;将DDP与Fer-1联合处理A549/DDP细胞,与单独的DDP处理组相比,联合处理组可抑制铁死亡发生,同时A549/DDP细胞对DDP的敏感性降低(表2)。
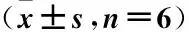
表2 铁死亡对A549/DDP药物敏感性的影响
3 讨论
在全球范围内每年有超过100万人死于NSCLS[1-2]。以DDP为基础的化疗策略是NSCLS临床治疗中的首选方案,但是DDP在临床治疗中极易引起耐药,导致化疗失败,无法提高患者的生存率[4-5]。因此,寻找新的耐药靶点或者与耐药相关的信号通路来降低DDP在NSCLS化疗中的耐药性至关重要。
铁死亡作为近年发现的一种新的细胞程序性死亡方式,被认为与多种疾病的发生密切相关[16-17],其中GPX4介导的Lipid ROS的紊乱是铁死亡发生的关键过程[6]。已有研究[18-19]表明,胱氨酸转运蛋白Xc-复合物中xCT亚基在多种耐药肿瘤细胞中高表达,而xCT亚基的高表达会导致胞内还原性谷胱甘肽(GSH)含量升高,铁死亡被抑制。GSH又是GPX4对Lipid ROS清除中的关键底物,其表达量的升高会影响GPX4的表达[20]。
GPX4在肿瘤细胞耐药中发挥重要作用。研究[14]发现,抑制GPX4活性可增强肿瘤细胞对化疗药物的敏感性;Eaton等[15]研究发现,共价结合GPX4可作为增强化疗药物敏感性的关键靶点。本研究发现,GPX4在A549与A549/DDP细胞中表达差异有统计学意义(P<0.05),该结果说明GPX4可能与A549/DDP细胞耐药性有关。本研究在A549细胞中过表达GPX4,结果发现,GPX4过表达后的细胞对DDP耐受性增强。鉴于GPX4在细胞铁死亡发生的关键作用,本研究在抑制铁死亡发生的情况下,检测A549/DDP细胞对DDP的敏感性。该结果显示,抑制铁死亡发生可降低A549/DDP细胞对DDP的敏感性,而通过RSL3抑制GPX4的表达与活性,激活A549/DDP细胞铁死亡,可增强A549/DDP细胞对DDP的敏感性。以上结果显示,GPX4可通过抑制铁死亡发生,增强A549/DDP细胞对DDP的耐受性。
综上所述,GPX4的表达量与NSCLS细胞对DDP的耐药性呈正相关,而GPX4作为铁死亡调控的关键分子,其活性或表达量的抑制,可激活铁死亡发生,逆转肿瘤细胞耐药性,这为NSCLS耐药的临床研究提供了新视野。本研究仅在体外层面证实GPX4的高表达与A549/DDP细胞对DDP的耐药性密切相关,其具体的分子机制仍需进一步阐明,同时其在体内发挥的作用仍需进一步研究。

