4 型流感病毒疫苗株在MDCK 细胞中增殖条件的优化
江征 ,张国梅 ,张哲罡 ,邓涛 ,刘京 ,吕传硕 ,乐洋 ,马宁 ,周蓉 ,张家友 ,李长贵 ,杨晓明
1.武汉生物制品研究所病毒性疫苗研究二室,湖北武汉430207;2.中国食品药品检定研究院,北京102629;3.国家联合疫苗工程技术研究中心,湖北武汉430207;4.中国生物技术股份有限公司,北京100029
流感病毒持续威胁着人类健康。据WHO 数据显示,每年约有10 亿人感染流感病毒,并造成300万 ~500 万重症病例和30 万 ~50 万死亡病例[1]。流感病毒属正黏科病毒,其基因组由7 或8 个不连续片段的单股负链RNA 构成。流感病毒目前分为甲、乙、丙、丁4 型,甲型流感病毒又分为不同亚型,如H1N1、H3N2 等;乙型流感病毒分为 Victoria 和Yamagata 两个不同的谱系[2]。目前,每年一度的疫苗接种仍是预防流感的主要有力措施[3],全球的流感疫苗主要是传统的基于鸡胚基质的裂解疫苗和亚单位疫苗。由于鸡胚基质疫苗存在诸多不足,如病毒的鸡胚适应性突变会降低免疫原性,疫苗的生产依赖于鸡胚的供应,不能快速灵活地应对流感大流行等,近年来出现了基于细胞基质的流感疫苗,并有研究通过改造细胞特性使其更适于流感疫苗培养[4]。基于MDCK 细胞流感疫苗的研究表明,该细胞适用于流感病毒的培养,具有较强的病毒复制能力,适用于大规模培养[5-6]。
流感病毒在感染细胞过程中其表面血凝素(hemagglutinin,HA)需从未活化状态HA0 经胰蛋白酶裂解为具有感染能力的HA1 和HA2[7-9],而细胞内不存在该类的蛋白酶,因此为提高流感病毒在细胞中培养的病毒滴度,中国食品药品检定研究院呼吸道病毒疫苗室构建了能够稳定表达牛胰蛋白酶原的MDCK 细胞系,即MTY6 细胞。牛胰蛋白酶原经微量胰酶的加入即可活化转变为牛胰蛋白酶,简化了细胞基质流感疫苗的生产工艺[10]。本研究对4型流感病毒疫苗株在MTY6 细胞中的增殖条件进行优化,比较4 型疫苗株在两株细胞中培养的病毒滴度及对于两株细胞易感性等的差异,以期为MTY6细胞基质的四价流感病毒裂解疫苗的大规模生产奠定基础。
1 材料与方法
1.1 细胞株及病毒株 MTY6 细胞由中国食品药品检定研究院呼吸道病毒疫苗室惠赠;MDCK 细胞(ATCC-CCL-34)购自ATCC,由武汉生物制品研究所有限责任公司病毒性疫苗研究二室保存;H1N1(IVR-215)、H3N2(NIB-121)、BV(BVR-11)、BY(BVR-1B)疫苗株均购自NIBSC,由武汉生物制品研究所病毒性疫苗研究二室保存。
1.2 实验动物 白羽鸡购自湖北峪口禽业有限公司。
1.3 主要试剂及仪器 DMEM 培养基购自美国赛默飞公司;新生牛血清购自兰州民海生物工程有限公司;重组胰酶购自上海雅心生物技术有限公司;青霉素/ 链霉素溶液购自生工生物工程(上海)股份有限公司;PBS 缓冲液和除菌滤器购自德国赛多利斯公司;实时细胞分析(RTCA)仪器购自安捷伦公司。细胞培养基为DMEM 培养基加入5%新生牛血清,病毒维持液为DMEM 培养基加入1 × 青霉素 / 链霉素溶液。
1.4 细胞培养 复苏MDCK 和MTY6 细胞,稳定培养3 代后,在RTCA 仪器专用96 孔细胞板中1~4列和 5 ~ 8 列按 5 × 104个 / 孔的浓度分别加入 100 μL MTY6 或 MDCK 细胞,培养 85 h,每隔 10 min 收集细胞增殖信号,由RTCA 仪器自动绘制两种细胞85 h内的生长曲线。
1.5 4 型流感病毒在两种细胞中增殖条件的优化采用棋盘法。取对数生长期的MTY6 和MDCK 细胞,按 4 × 104个 / cm2的浓度接种至 T75 细胞培养瓶内,24 h 后弃去细胞培养基,用PBS 洗涤,加入重组胰酶浓度分别为 0.5、1、1.5、2 μg / mL 的病毒维持液 17 mL,分别接种 MOI 为 0.1、0.01、0.001、0.000 1的 H1N1、H3N2、BV、BY 株病毒,于 34 ℃,5%培养箱中培养;接种病毒后 24、48、72、96 h 分别取 500 μL病毒液,检测血凝滴度和病毒滴度。
1.6 病毒血凝滴度检测 采用红细胞凝集试验。在96 孔板第 2 ~ 12 列加入 PBS 50 μL,第 1 列加入100 μL 待检病毒液后,吸取 50 μL 加至第 2 列的相应各孔,依次从第2 ~12 列进行2 倍系列稀释;各孔加入50 μL 1%鸡血红细胞,静置30 ~ 40 min。结果判定:以出现完全凝集的最高稀释度为终点,其稀释度的倒数即为病毒的红细胞凝集滴度。
1.7 病毒滴度检测 在96 孔细胞板中每孔加入3 ×104个细胞,于 37 ℃,5% CO2条件下培养 24 h;弃去培养基,用PBS 洗涤2 次,在24 孔细胞板中取待检病毒液,用病毒维持液进行对数稀释,稀释度依次为10-1~ 10-11;将各稀释度的病毒液分别取 100 μL 加至96 孔细胞板的第1 ~11 列,第12 列各孔加入100 μL PBS 作为阴性对照,于 34 ℃,5% CO2条件下放置1 h 进行病毒吸附;更换100 μL 新鲜病毒维持液,于 34 ℃,5%CO2培养箱中培养 72 h;加入 100 μL 结晶紫染色10 ~ 20 min。结果判定:以细胞病变效应(cytopathic effect,CPE)为依据进行结果判读,若孔底染色为紫色则为阳性孔,统计各稀释度下的阳性孔数,根据Reed-Muench 法[11]计算病毒半数组织感染剂量(median tissue culture infective dose,TCID50)。
1.8 4 型流感病毒在两种细胞中培养引起CPE 敏感性的比较 参照病毒滴度检测方法,取在MDCK 细胞中最适条件下培养的4 型流感病毒检测基于MTY6细胞CPE 的TCID50值,以TCID50值反映4 型病毒在两株细胞中培养时引起CPE 的敏感程度。
2 结 果
2.1 两种细胞生长曲线的比较 两种细胞的生长曲线重合度较高,在96 孔细胞板中每孔加入5 × 104个细胞的起始密度下,二者均于40 h 左右进入对数生长期,但MTY6 细胞的平台期比MDCK 细胞更长,MDCK 细胞则更快进入衰退期。见图1。

图1 MTY6 和MDCK 细胞的生长曲线Fig.1 Growth curve of MTY6 and MDCK cells
2.2 4 型流感病毒在两种细胞中增殖条件的优化
2.2.1 血凝滴度的比较 H1N1、H3N2、BV 和 BY株病毒在MTY6 细胞中培养,血凝滴度最高分别为1 ∶27、1 ∶25、1 ∶29和 1 ∶29U / 50 μL;在 MDCK 细胞中培养,血凝滴度最高分别为 1 ∶26、1 ∶22、1 ∶28和1 ∶29U / 50 μL。H1N1 血凝滴度达 1 ∶26U / 50 μL的培养条件在MTY6 细胞中有11 个,在MCDK 细胞中有 2 个;H3N2 血凝滴度达 1 ∶24U / 50 μL 的培养条件在MTY6 细胞中有25 个,在MCDK 细胞中无;BV 血凝滴度达 1 ∶28U / 50 μL 的培养条件在MTY6 细胞中有 20 个,在 MCDK 细胞中有 15个;BY血凝滴度达 1 ∶28U /50 μL 的培养条件在MTY6 细胞中有 24 个,在 MCDK 细胞中有 10 个。总体上,4 型流感病毒疫苗株在MTY6 细胞中培养更易获得较高的血凝滴度。见表1。
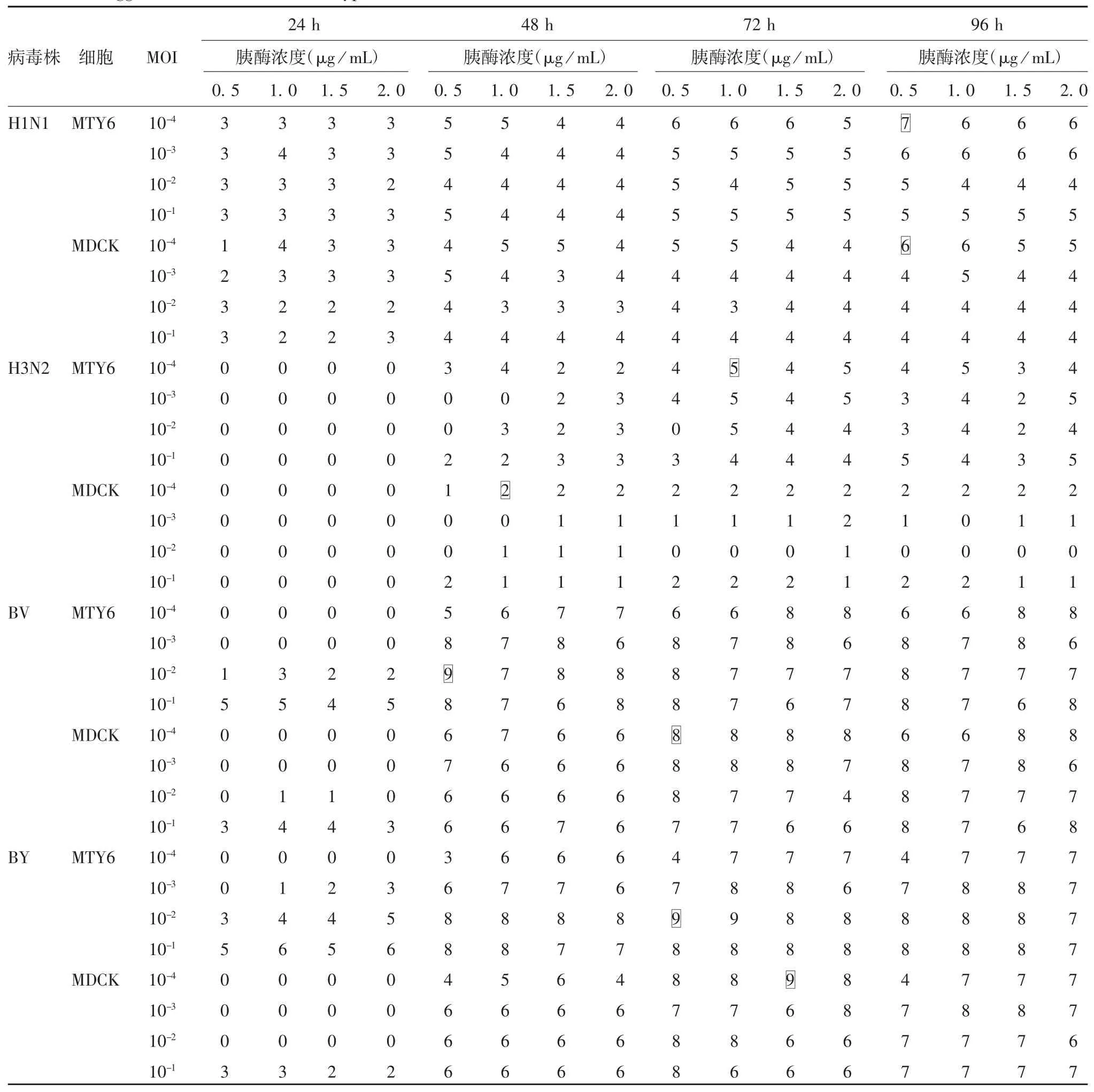
表1 4 型流感病毒株在两种细胞中培养的血凝滴度Tab.1 Hemagglutination titer of four subtypes of influenza virus cultured in MTY6 and MDCK cells
2.2.2 最适种毒条件 H1N1、H3N2、BV 和 BY 株病毒在MTY6 细胞中培养的最适MOI 分别为10-4、10-4、10-2、10-2,胰酶浓度分别为 0.5、1、0.5 和 0.5 μg /mL,收毒时间分别为 96、72、48 和 72 h;在 MDCK 细胞中培养的最适MOI 均为10-4,胰酶浓度分别为0.5、1、0.5 和 1.5 μg / mL,收毒时间分别为 96、48、72和72 h。H1N1 在两种细胞中培养的最适条件相同;H3N2 在MTY6 细胞中的培养时间比在MDCK 细胞中长;BV 在MTY6 细胞中培养的最适MOI 比在MDCK细胞中高,最适时间短;BY 在MTY6 细胞中培养的最适MOI 比在MDCK 细胞中高,最适胰酶浓度低。见表2。

表2 4 型流感病毒株种毒的最适条件Tab.2 Optimal condition for inoculation of four subtypes of influenza virus
2.2.3 血凝滴度的比较 H1N1、H3N2 和 BV 株病毒分别在MTY6 和MDCK 细胞相应的最适条件下培养收获病毒液后,在MTY6 细胞中的血凝滴度比MDCK 细胞中分别高出 2、8 和 2 倍;BY 株病毒在两株细胞相应的最适条件下培养后的血凝滴度均为1︰29U / 50 μL,见图 2,但与 MDCK 细胞相比,在MTY6 细胞中培养时更易达到较高的血凝滴度,该现象同样出现在其他3 型病毒株。

图2 4 型病毒株以最适条件在两种细胞中培养收获病毒液的血凝滴度Fig.2 Hemagglutination titer of four subtypes of virus strain cultured in MTY6 or MDCK cells under optimal condition
2.2.4 病毒滴度的比较 H1N1、H3N2、BV 和 BY株病毒分别以最适条件在MTY6 细胞中培养的病毒滴度比在MDCK 细胞中分别高 2、3.3、0.8 和2.5 TCID50/ mL,见图 3。

图3 4 型病毒株以最适条件在两种细胞中培养收获病毒液的病毒滴度Fig.3 Virus titer of four subtypes cultured in MTY6 or MDCK cells under optimal condition
2.3 4 型流感病毒在两种细胞中培养引起CPE 敏感性的比较 基于MTY6 细胞CPE 的H1N1、H3N2、BV、BY 株病毒的 LgTCID50/ mL 分别为 6.5、7.2、7.2、7.5,基于 MDCK 细胞 CPE 的 H1N1、H3N2、BV、BY 株病毒的 LgTCID50/ mL 分别为 5.5、5.0、7.4、5.5。能够引起MTY6 细胞CPE 更明显的为H1N1、H3N2 和BY 型流感病毒,BV 型流感病毒则能够引起MDCK 细胞更明显的CPE。见图4。

图4 4 型病毒株引起两种细胞CPE 的比较Fig.4 CPEs caused by four subtypes of virus in MTY6 and MDCK cells
3 讨 论
目前常用于流感疫苗培养的细胞基质有MDCK、Vero 和PER.C6 细胞,由于MDCK 细胞对于各型流感病毒均易感,在流感疫苗生产中已被广泛使用[12]。流感病毒在感染细胞的过程中存在关键一步,即HA的前体形式需在胰蛋白酶的作用下活化单碱性氨基酸的酶切位点,成为具有感染能力的HA1 和HA2[13-15]。流感病毒在鸡胚中培养时,得益于鸡胚尿囊液中存在大量蛋白酶水解HA 的作用,具有很高的病毒滴度。但流感病毒在细胞中培养时,细胞自身不表达能够水解HA 的蛋白酶,因此需额外在细胞培养基中加入适宜浓度的胰蛋白酶来提高病毒感染能力[16]。中国食品药品检定研究院呼吸道病毒疫苗室成功构建了高效表达经密码子优化的牛胰蛋白酶原的MTY6 细胞系[10]。胰蛋白酶原分泌在细胞中通过添加少量胰酶即可被活化,使其转变为有活性的牛胰蛋白酶。培养病毒的细胞自身能够合成并分泌牛胰蛋白酶原大幅简化了细胞基质流感疫苗的生产工艺。
在MTY6 和MDCK 细胞中分别以最适条件接种4 型流感病毒后,在MTY6 细胞中培养时4 型流感病毒更易达到较高的血凝滴度,且具有更高的血凝滴度以及病毒滴度,在获得更大产量的同时,疫苗株的病毒活力更高,有利于解决H1N1 和H3N2 在MDCK 细胞或鸡胚中培养时病毒活力欠佳的问题。在MTY6 和MDCK 细胞对于不同型别流感病毒所引起的 CPE 中,H1N1、H3N2 和 BY 型流感病毒对MTY6细胞的病变更具敏感性,提示对于测定低病毒滴度或不易引起MDCK CPE 的流感病毒株,建立基于MTY6细胞CPE 的病毒滴度检测方法更具有敏感性。
本研究在稳定表达牛胰蛋白酶原的MTY6 细胞上探讨了4 型流感病毒疫苗株的最适增殖条件,为后续MTY6 细胞基质流感疫苗在生物反应器中扩大培养奠定了基础。但本研究局限于小规模试验,需配合更多细胞培养监测指标,如细胞上清中葡萄糖和乳酸含量、pH 和溶氧等。同时,该细胞可作为研究流感病毒感染机制、检测流感病毒增殖状况和快速诊断的工具进行更深入的探索。

