丹参多酚酸盐对H2O2所致心肌细胞氧化应激损伤及PPARγ/Nrf2/HO-1通路的影响
李 兵
随着人们生活水平的提高、膳食结构的改变及人口老龄化的加剧,我国心血管疾病致死率居致死疾病首位,也是我国居民猝死的主要诱因之一[1]。活性氧(reactive oxygen species,ROS)过剩所致氧化应激损伤及ROS诱导细胞凋亡与各种心血管疾病进展密切相关[2],其中冠状动脉粥样硬化性心脏病、心肌梗死及治疗实现再灌注后引起ROS大量产生过剩[3]。因此,寻找能降低氧化应激损伤、抑制心肌细胞凋亡的新型药物成为目前治疗研究的热点。
丹参多酚酸盐(salvianolate,SAL)是中药丹参的水溶提取物,具有良好的抗氧化活性[4],临床主要用于轻度、中度稳定型心绞痛的治疗。过氧化物酶体增殖子活化受体(PPARγ)/核转录因子E2相关因子2(Nrf2)/抗血红素加氧酶-1(HO-1)通路在氧化应激反应中发挥着重要的调控作用[5-6]。本研究以H9c2心肌细胞为研究对象,探讨SAL对H2O2所致心肌细胞氧化应激损伤的影响及PPARγ/Nrf2/HO-1通路在其中发挥的调控作用。
1 材料与方法
1.1 实验细胞 H9c2心肌细胞购自上海中国科学院细胞库。将H9c2细胞接种于含10%胎牛血清、1%双抗的DMEM培养基,置于37 ℃、5% CO2细胞培养箱中培养,每3 d传代1次,取第3代对数生长期H9c2细胞进行实验研究。
1.2 实验药物与试剂 SAL购自上海绿谷制药有限公司[规格:每瓶50 mg(含丹参乙酸镁40 mg),批号1903027];DMEM培养基购自美国Hyclone公司;胰酶、胎牛血清购自美国Invitrogen公司;青链霉素、DMSO、四唑盐(MTT)试剂盒购自上海源叶生物科技有限公司;2,7-双乙酸二氯荧光(DCFH-DA)探针购自美国Sigma公司;兔抗鼠PPARγ、Nrf2、HO-1、核转录因子-κB(NF-κB)、激活型半胱氨酸蛋白酶-3(Cleaved Caspase-3)抗体购自购自Abcam公司;山羊抗兔IgG二抗、ROS试剂盒、电化学发光(ECL)试剂盒、Annexin V-FITC/PI凋亡试剂盒、放射免疫沉淀(RIPA)蛋白裂解液、2,2-联喹啉-4,4-二甲酸二钠(BCA)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)试剂盒购自上海碧云天生物科技有限公司。
1.3 实验仪器 HERACell 150i型细胞培养箱(德国Thermo公司);Synergy Mx型多功能荧光酶标仪(美国Bio-Tek公司);ST16R型超速冷冻离心机(美国Beckman公司);FACS Calibur流式细胞仪、PowerPac HV型电泳仪、Trans-Blot SD型转膜仪(美国Bio-Rad公司);C600型凝胶成像系统(美国Azure公司)。
1.4 实验方法
1.4.1 心肌细胞氧化应激损伤模型制备与分组 细胞模型制备[7]:取对数生长期H9c2心肌细胞,经胰酶消化和重悬后制备浓度为5×105个/mL的单细胞悬液,每孔200 μL接种于6孔细胞培养板中培养24 h后,更换含有100 μmol/L H2O2的培养基继续培养4 h以制备H2O2诱导H9c2心肌细胞氧化损伤模型,设置H2O2组、SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组;另取对数生长期H9c2心肌细胞作为正常组。
1.4.2 细胞增殖率检测 各组细胞经胰酶消化和重悬后制备浓度1×105个/mL的单细胞悬液,每孔100 μL接种于96孔细胞培养板,每组设10个复孔;SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组分别加入含50 mg/L、100 mg/L、200 mg/L的SAL培养液,H2O2组和正常组加入常规培养液,继续培养24 h后,每孔10 μL加入细胞计数试剂盒8(CCK-8)溶液,继续培养2 h后消化并收集细胞,之后通过酶标仪测定570 nm处吸光度(A),细胞增殖抑制率(%)=(A药物组/A正常组)×100%。
1.4.3 细胞凋亡检测 各组细胞经胰酶消化和重悬后制备浓度为5×105个/mL的单细胞悬液,以每孔200 μL接种于6孔细胞培养板,每组设10个复孔;SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组分别加入含50 mg/L、100 mg/L、200 mg/L的SAL培养液,H2O2组和正常组加入常规培养液,继续培养24h后消化,2 000 r/min离心5 min收集细胞,按照试剂盒说明,滴加稀释后的结合缓冲液重悬细胞,滴加Annexin V-FITC和PI染液,37 ℃避光孵育15 min后,采用流式细胞仪检测细胞凋亡。
1.4.4 细胞ROS含量检测 取浓度1×105个/mL的单细胞悬液,每孔100 μL接种于黑底不透明的96孔细胞培养板,每组设10个复孔;SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组分别加入含终浓度50 mg/L、100 mg/L、200 mg/L的SAL培养液和终浓度10 μmol/L的DCFH-DA培养液,H2O2组和正常组加入含终浓度10 μmol/L的DCFH-DA常规培养液,继续培养30 min后,磷酸缓冲盐溶液(PBS)洗涤2次去除未进入细胞内的DCFH-DA,之后通过荧光显微镜观察细胞内ROS(激发波长488 nm,发射波长525 nm);通过荧光酶标仪检测荧光强度,荧光强度反映ROS含量。
1.4.5 CK-MB、LDH漏出量和MDA含量及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性检测 参照1.4.3中方法分组和给药干预后,取各组细胞上清液,按照试剂盒操作说明,通过生化分析仪检测各组细胞CK-MB、LDH漏出量。弃培养液,胰酶消化并以2 000 r/min离心5 min收集细胞,滴加RIPA蛋白裂解液于冰上裂解30 min后,4 ℃、3 500 r/min离心10 min取上清液,采用硫代巴比妥酸法检测MDA含量,黄嘌呤氧化法、钼酸铵法分别检测SOD、CAT活性。
1.4.6 细胞蛋白表达检测 参照1.4.3中方法分组和给药干预后,消化并收集细胞,滴加RIPA蛋白裂解液于冰上裂解30 min后,4 ℃、12 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度后沸水浴5 min,使蛋白完全变性,以30 μg蛋白量上样进行5%浓缩胶(60 V电压)和10%分离胶(100 V电压)电泳分离,半干法转聚偏二氟乙烯(PVDF)膜,置PVDF膜于5%脱脂奶粉室温封闭1h,分别滴加稀释后的目标蛋白、β-actin一抗4 ℃孵育过夜,PBS洗膜3次后滴加山羊抗兔二抗37 ℃孵育1 h,PBS洗膜3次后滴加ECL溶液,暗盒中显影后采用凝胶成像系统分析条带灰度值,以β-actin为内参半定量分析目的蛋白相对表达量。

2 结 果
2.1 SAL对H2O2损伤H9c2心肌细胞增殖率和凋亡率的影响 与正常组比较,H2O2组H9c2心肌细胞增殖率降低,凋亡率升高(P<0.01);与H2O2组比较,SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组H9c2心肌细胞增殖率升高,凋亡率降低(P<0.05或P<0.01)。详见图1、图2。

图1 SAL对H2O2损伤H9c2心肌细胞凋亡的流式细胞图(A为正常组;B为H2O2组;C为SAL 50 mg/L组;D为SAL 100 mg/L组;E为SAL 200 mg/L组)

与正常组比较,*P<0.01;与H2O2组比较,△P<0.05,△△P<0.01。图2 各组H9c2心肌细胞增殖率和凋亡率比较(A为细胞增殖率;B为细胞凋亡率)
2.2 各组H9c2心肌细胞ROS含量比较 与正常组比较,H2O2组H9c2心肌细胞ROS含量升高(P<0.01);与H2O2组比较,SAL 100 mg/L组、SAL 200 mg/L组H9c2心肌细胞ROS含量降低(P<0.05或P<0.01)。详见图3、图4。

图3 SAL对H2O2损伤H9c2心肌细胞ROC含量的荧光强度
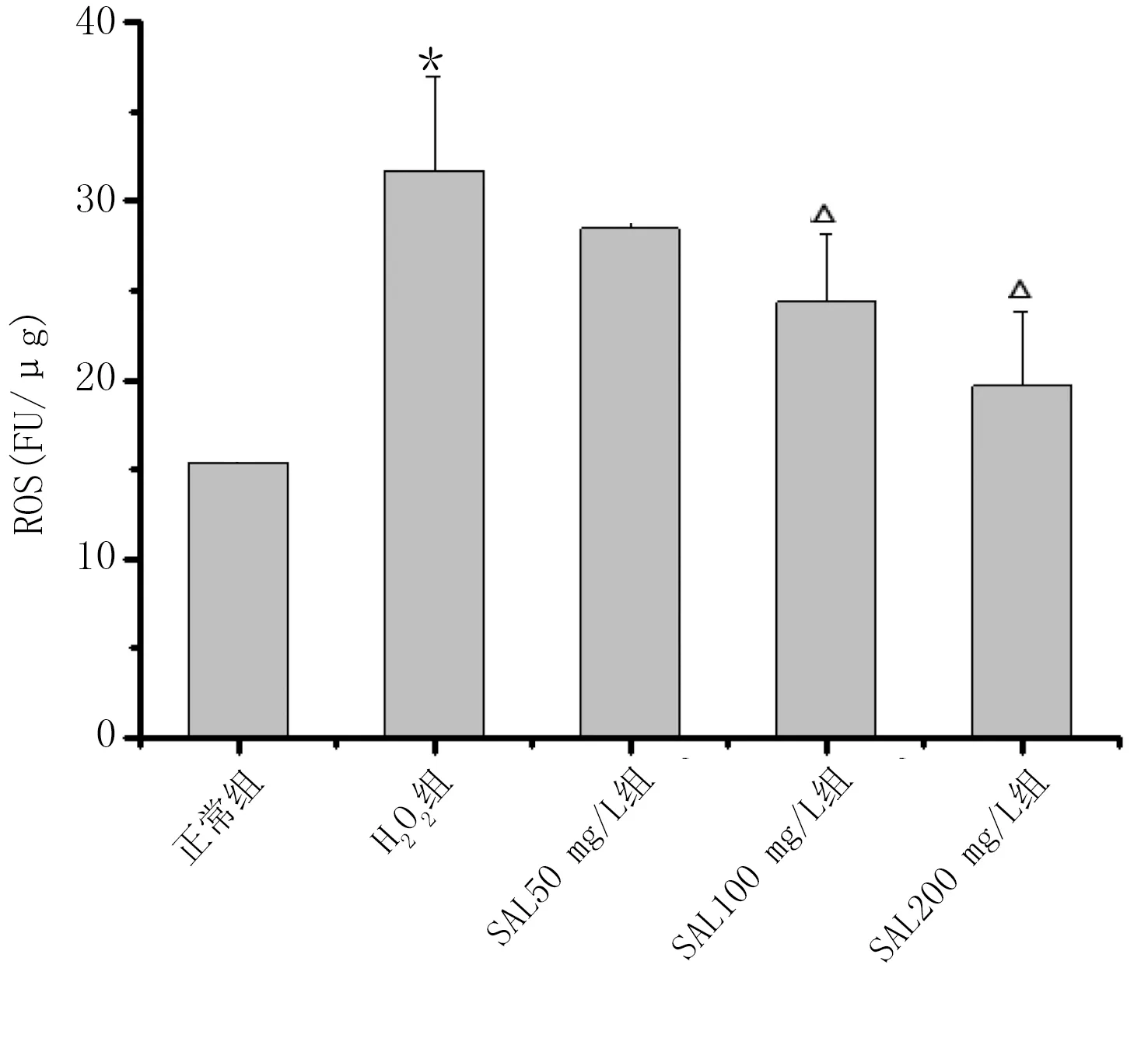
与正常组比较,*P<0.01;与H2O2组比较,△P<0.01。 图4 各组H9c2心肌细胞ROS含量比较
2.3 各组H9c2心肌细胞CK-MB、LDH漏出量比较 与正常组比较,H2O2组H9c2心肌细胞CK-MB、LDH漏出量升高(P<0.01);与H2O2组比较,SAL 100 mg/L组、SAL 200 mg/L组H9c2心肌细胞CK-MB、LDH漏出量降低(P<0.05或P<0.01)。详见图5。

与正常组比较,*P<0.01;与H2O2组比较,△P<0.05,△△P<0.01。图5 各组H9c2心肌细胞CK-MB、LDH漏出量比较(A为CK-MB;B为LDH)
2.4 各组H9c2心肌细胞MDA含量和SOD、CAT活性比较 与正常组比较,H2O2组H9c2心肌细胞MDA含量升高,SOD、CAT活性降低(P<0.01);与H2O2组比较,SAL 100 mg/L组、SAL 200 mg/L组H9c2心肌细胞MDA含量降低,SOD、CAT活性升高(P<0.05或P<0.01)。详见图6。

与正常组比较,*P<0.01;与H2O2组比较,△P<0.05,△△P<0.01。图6 各组H9c2心肌细胞MDA含量和SOD、CAT活性比较(A为MDA含量;B为SOD活性;C为CAT活性)
2.5 各组H9c2心肌细胞PPARγ、Nrf2、HO-1、NF-κB、Cleaved Caspase-3蛋白表达比较 与正常组比较,H2O2组H9c2心肌细胞PPARγ、Nrf2、HO-1蛋白表达下调,NF-κB、Cleaved Caspase-3表达上调(P均<0.01);与H2O2组比较,SAL 50 mg/L组、SAL 100 mg/L组、SAL 200 mg/L组H9c2心肌细胞PPARγ、Nrf2、HO-1蛋白表达上调,NF-κB、Cleaved Caspase-3表达下调,差异均有统计学意义(P<0.05或P<0.01)。详见图7、图8。

图7 各组H9c2心肌细胞PPARγ、Nrf2、HO-1、NF-κB、Cleaved Caspase-3蛋白表达电泳图(A为正常组;B为H2O2组;C为SAL 50 mg/L组;D为SAL 100 mg/L组;E为SAL 200 mg/L组)
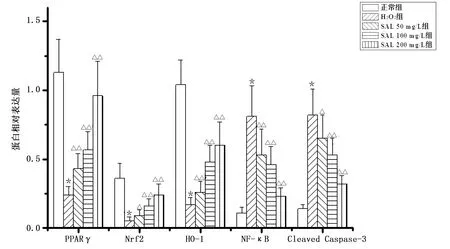
与正常组比较,*P<0.01;与H2O2组比较,△P<0.05,△△P<0.01。图8 各组H9c2心肌细胞PPARγ、Nrf2、HO-1、NF-κB、Cleaved Caspase-3蛋白相对表达量比较
3 讨 论
H2O2是细胞生理代谢过程中重要的中间产物,参与基因转录与表达、细胞增殖等过程,但过量的H2O2将诱发细胞内ROS大量生成,过度消耗以ROS为底物的抗氧化酶(SOD、CAT),引起ROS过剩蓄积导致氧化应激反应,破坏蛋白、核酸、DNA等大分子诱导细胞凋亡[8];ROS可攻击生物膜中不饱和脂肪酸导致的过氧化损伤,具有生物毒性的MDA是过氧化终产物之一,且细胞膜损伤后细胞内CK-MB、LDH将漏出,因此,ROS、CK-MB、LDH、MDA含量及SOD、CAT活性可反映细胞氧化应激损伤程度[9]。
SAL是丹参的水溶提取物,具有良好的抗氧化活性[4]。本研究通过H2O2干预制备H9c2心肌细胞氧化应激损伤模型,给予不同浓度的SAL进行干预,结果显示,经SAL干预能显著提高H9c2心肌细胞增殖率,降低细胞凋亡率、细胞ROS、MDA含量和CK-MB、LDH漏出量,提高SOD、CAT活性,提示SAL对H2O2所致H9c2心肌细胞氧化应激损伤具有保护作用。Nrf2是体内细胞普遍存在的一种核转录因子,对细胞氧化应激反应具有重要的调控作用[10]。Deshmukh等[11]研究显示,ROS能诱导Nrf2与抑制剂Keap1解离而活化,移核转位并激活抗氧化反应元件,促进抗氧化酶(SOD、CAT等)转录与表达。HO-1是Nrf2下游基因,氧化应激状态下Nrf2被激活进入核后将启动HO-1转录表达而催化降解血红素、一氧化碳等,抑制氧化应激损伤[12]。NF-κB能促进巨噬细胞活化和浸润,诱导促凋亡蛋白Caspase-3表达与活化,促进细胞凋亡[13];Huang等[14]研究显示,HO-1能抑制NF-κB启动子核转录因子κB激酶抑制剂(IKK)β磷酸化从而抑制NF-κB活化。PPARγ对葡萄糖、脂质代谢等具有重要的调节作用,Hang等[15]研究显示,PPARγ与Nrf2启动子结合促进Nrf2表达。本研究结果显示,经SAL干预能上调PPARγ、Nrf2、HO-1表达并下调NF-κB、Cleaved Caspase-3表达。
综上所述,SAL对H2O2所致H9c2心肌细胞氧化应激损伤具有保护作用,其作用机制可能与激活PPARγ/Nrf2/HO-1通路有关。

