下调长链非编码RNA FGD5-AS1抑制肾癌细胞增殖和侵袭的机制研究
叶志华 付金伦 桂定文 罗帅 王静 王小英
1鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)泌尿外科肾脏疾病发生与干预湖北省重点实验室,湖北 435000;2 鄂东医疗集团黄石市第二医院外科,湖北435000
肾癌源于肾小管上皮细胞,其发病率在全球范围内逐年升高[1]。肾癌治疗方式主要是手术切除,转移性肾癌患者对放疗和化疗均不敏感[2]。探讨肾癌增殖和转移机制对寻找诊断标志物和靶向治疗意义重大。lncRNA 是一种非编码小RNA,缺乏开放阅读框架[3]。lncRNA 在基因转录修饰、转录后修饰等方面发挥重要作用,参与心血管疾病、糖尿病、肿瘤等疾病发生和发展[4]。FGD5-AS1是一种新明确的lncRNA。研究表明,FGD5-AS1 在多种肿瘤中发挥明显的癌基因作用[5]。FGD5-AS1 在肾癌细胞中的表达及对肾癌细胞生物学行为的影响尚不明确。本研究于2020年7月至2021 年2 月通过检测FGD5-AS1 在肾癌细胞株中的表达,筛选FGD5-AS1 表达最高的肾癌细胞,探讨下调FGD5-AS1 对细胞因子信号转导抑制因子6(suppressor of cytokine signaling 6,SOCS6)表达的调控及对肾癌细胞增殖和侵袭的影响。
1 材料与方法
1.1 细胞与主要试剂 所有细胞均购于中国科学院生物化学与细胞生物学研究所;胎牛血清(FBS)和培养基购于美国Gibco 公司;Lipofectamine 3000 和Matrigel 胶购于美国Invitrogen公司;阴性对照质粒和小干扰siRNA-FGD5-AS1质粒由广州市锐博生物科技有限公司合成;二苯基溴化四氮唑蓝(MTT)试剂盒购自上海碧云天生物技术有限公司;一抗购于美国Cell Signaling Technology 公司;实时荧光定量聚合酶链式反应(qRT-PCR)试剂盒购于日本TaKaRa 公司;Transwell小室购自美国Corning公司。
1.2 细胞培养和转染 肾癌细胞786-O、ACHN、A498、OS-RC-2采用含10%FBS的RPMI 1640培养基培养,近端肾小管细胞采用含10% FBS 的DMEM/F12 培养基培养,在37 ℃、5%CO2培养箱培养。ACHN 细胞以6×105个/孔接种于6 孔板,根据Lipofectamine 3000 说明书转染细胞,分别转染小干扰siRNA-FGD5-AS1 质粒和阴性对照质粒,命名为实验组和对照组。
1.3 qRT-PCR 检 测FGD5-AS1 和SOCS6 mRNA 表 达应用Trizol 法提取总RNA,反转录RNA 为cDNA,根据qRT-PCR 试剂盒说明书进行qRT-PCR 扩增。Ct 值利用2-ΔΔCt方法计算,以GAPDH为内参,引物序列见表1。

表1 实时荧光定量聚合酶链式反应的引物序列
1.4 Western blotting 检测 蛋白提取试剂盒提取两组肾癌ACHN 细胞总蛋白。分别取50 μg 蛋白样品进行SDS-PAGE 胶电泳,利用聚偏二氯乙烯膜转膜,利用5%脱脂牛奶封闭,在一抗中孵育12 h,在二抗羊抗兔中孵育3 h,在凝胶成像系统下显影、拍照。
1.5 MTT 法检测ACHN 细胞的增殖 两组肾癌ACHN细胞以5 000 个/孔接种到96 孔板。每孔加入20 μl MTT 试剂孵育4 h,去上清,每孔加入180 μl 二甲基亚砜,酶标仪检测490 nm波长处的吸光度(A)值,连续5 d进行MTT检测。
1.6 Transwell侵袭实验检测ACHN细胞的侵袭 预铺Matrigel胶(浓度15 μg/ml)至小室上室。两组肾癌ACHN 细胞使用无血清培养基重悬后接种于上室,加入600 μl 含血清培养基至下室。培养32 h,棉签擦去未穿微孔膜的ACHN细胞。室温下甲醇固定,室温下结晶紫染色,在光学显微镜(×100)下计数并取均值。
1.7 统计学方法 采用SPSS 19.0统计软件进行分析,计量资料符合正态分布,以(±s)表示,组间比较采用独立样本t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 qRT-PCR 检测肾癌细胞中FGD5-AS1 的表达qRT-PCR 检 测 结 果 显 示,FGD5-AS1 在786-O、ACHN、A498、OS-RC-2、HK-2 细胞中的表达量分别为(3.92±0.29)、(5.81±0.53)、(1.66±0.18)、(3.03±0.16)和(1.01±0.06)。与HK-2 细胞相比,肾癌细胞中FGD5-AS1 表达均明显增加(P<0.05),其中ACHN 细胞增加最为明显(P<0.05)。故以ACHN细胞为对象进行后续实验。
2.2 qRT-PCR 检测转染后ACHN 细胞中FGD5-AS1、SOCS6 mRNA 的表达 在ACHN 细胞株中,对照组与实验组中FGD5-AS1 表达量分别为(1.01±0.09)和(0.20±0.03),差异有统计学意义(t=8.46,P<0.01);对照组与实验组中SOCS6 mRNA 表达量分别为(0.33±0.05)和(1.02±0.13),差异有统计学意义(t=5.05,P<0.01)。
2.3 Westen blotting 检测SOCS6 蛋白和NF-κB 信号通路蛋白的相对表达 Western blotting 显示,与对照组相比,实验组ACHN 细胞中SOCS6 蛋白表达明显增加,NF-κB 信号通路蛋白NF-κB、c-Myc、ICAM-1 蛋白表达明显降低,见图1。

图1 Western blotting 检测两组SOCS6 蛋白及NF-κB 信号通路蛋白相对表达
2.4 MTT法检测ACHN细胞的增殖能力 与对照组相比,实验组转染FGD5-AS1 后第3 天开始,细胞增殖能力明显下降(t=3.86,P<0.05),见图2。
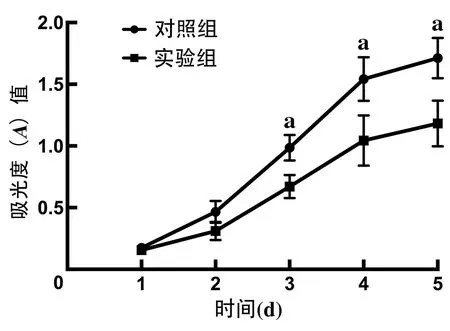
图2 FGD5-AS1对肾癌细胞ACHN细胞增殖能力的影响
2.5 Transwell 侵袭实验检测ACHN 细胞的侵袭能力对照组和实验组ACHN 细胞的侵袭细胞数分别为(80.49±10.50)个和(32.29±8.03)个,实验组侵袭细胞数明显减少(t=3.65,P<0.05),这表明FGD5-AS1 可导致ACHN 细胞侵袭能力明显降低。
3 讨 论
lncRNA 主要通过RNA聚合酶Ⅱ的作用合成,一直以来被研究者们认定为转录中产生的“噪音”,不发挥任何生物学效应[5]。近来研究不断证实,lncRNA 在调控细胞生物学功能方面发挥着巨大的潜力,越来越多lncRNA 被鉴定在肾癌组织或细胞中异常高表达或者低表达,严重影响肾癌细胞的生长和转移[6]。FGD5-AS1 是一种新明确的lncRNA,被发现在多个肿瘤中发挥明显的癌基因作用[7]。FGD5-AS1在肾癌中的表达模式和分子机制尚不清楚。
本研究显示,FGD5-AS1 在肾癌细胞株中相对表达明显高于近端肾小管细胞,FGD5-AS1 高表达可能参与肾癌发生和发展。SOCS6 基因位于人的18q22.2 染色体,其由535 个氨基酸排列组成[8]。SOCS6 蛋白是一种E3 泛素连接酶,通过泛素化降解特定基因表达,从而负调控细胞信号转导[9]。SOCS6 蛋白在膀胱癌、胃癌、肝癌等多种肿瘤呈现出明显的低表达趋势,展现出明显抑癌基因作用[10]。有研究表明,FGD5-AS1 在牙周膜细胞中具有调控SOCS6 基因表达的作用[7]。本研究结果表明,下调FGD5-AS1可明显促进SOCS6基因的表达。NF-κB 信号通路的异常激活与肾癌发生、发展密切相关,其可明显促进肾癌细胞的生长、转移等生物学行为[11]。本研究显示,SOCS6 蛋白表达增加后,NF-κB 信号通路蛋白表达明显降低,表明NF-κB 信号通路的转导被抑制。本研究进一步通过MTT 法和Transwell 侵袭实验表明,下调FGD5-AS1 后,肾癌细胞的增殖和侵袭能力均呈现显著降低趋势。本研究的不足之处在于,FGD5-AS1 调控SOCS6 基因表达的具体机制尚不清楚,是本课题组下一步研究的重点。
总之,FGD5-AS1 在肾癌细胞株中高表达,下调FGD5-AS1 可通过正向调控SOCS6 基因表达、负向调控NF-κB 信号通路转导,抑制肾癌细胞增殖和侵袭。FGD5-AS1 的研究可能为肾癌的分子诊断、靶向治疗等提供新的思路。

