低分子肝素改善子痫前期中的内皮损伤的机制研究
邓乾葆,张忠霞,王茹,韦秋圆,邓思思
子痫前期(preeclampsia,PE)是妊娠期特有的疾病,在妊娠妇女中的发病率约为5%~7%,是导致孕产妇及新生儿死亡的主要原因之一[1]。迄今为止,其具体病因及发病机制尚未阐明,主流观点认为胎盘发育不全、滋养细胞浸润异常、血管内皮细胞损伤、氧化应激、遗传和免疫等均参与调控PE的发生发展[2-3]。其中全身血管内皮细胞的活化及功能障碍被认为是PE发病机制中重要因素之一。大量数据显示联合使用低分子肝素能够显著改善PE的临床预后[4-8],但关于低分子肝素对PE患者的血管内皮细胞保护机制尚无相关报道。Delta样配体4(Delta-like ligand 4,DLL4)属于Notch信号通路Delta样配体家族成员之一[9]。既往研究发现,唯一特异性存在于血管内皮细胞的DLL4配体能够通过DLL4/Notch信号通路影响血管生成,并调控血管萌发及分支的形态[10-13]。本实验通过观察PE患者在经低分子肝素联合硫酸镁治疗后胎盘组织中DLL4的变化以评价其对内皮细胞的影响及作用机制,以期对PE孕妇的临床治疗提供理论依据及实验室基础。
1 材料与方法
1.1 研究对象及分组
选取2018年3月至2019年4月在海南医学院第二附属医院妇产科住院分娩的早发型重度PE患者60例,按随机数字表法将其分为PE组与低分子肝素组,各30例。两组明确PE诊断后(诊断标准按照第9版《妇产科学》[14])予以充分卧床休息及硫酸镁注射液(辽宁备齐,国药准字H20051795,注射剂,规格10 mL∶2.5 g)常规解痉,减压治疗,即首剂20 mL硫酸镁加入10%葡萄糖注射液100 mL,30 min静脉快速滴注,随后给予相同规格的硫酸镁20 mL加入5%葡萄糖注射液500 mL中,2.0 g/h静脉持续滴注。每个孕妇24 h硫酸镁总量不超过30 g。低分子肝素组在此基础上每日经皮下注射5 000 U的低分子肝素钠(齐鲁制药,国药准字H20030429,注射剂,规格0.4 mL∶5 000 IU)。PE组与低分子肝素组孕产妇至少连续上述治疗5天。选取同期因相对头盆不称行剖宫产的正常妊娠孕产妇30例为对照组。3组孕产妇均为经腹剖宫产分娩,并实时应用地塞米松促进胎肺成熟,其一般临床资料比较详见71页表1。
所有孕产妇均排除对肝素过敏及过敏体质者,无合并原发性高血压、肝肾疾病、心脏疾病、糖尿病、甲状腺疾病、胎盘早剥、前置胎盘、自身免疫性疾病及经阴道分娩者,且孕期未使用避孕药、免疫调节剂及其他激素类药物,妊娠前或孕期未使用阿司匹林或低分子肝素者。本研究所有研究对象均签署知情同意书。
1.2 细胞系及主要试剂
人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购自中国科学院上海细胞库。RPMI1640、0.25%胰蛋白酶(美国Hyclone公司);Trizol试剂(美国Invitrogen公司);胎牛血清(FBS)、青链霉素混合液(均为100 U/mL)(杭州四季青生物公司);DAPI试剂、Notch信号通路抑制剂MK-O752(美国sigma公司);TUNEL凋亡检测试剂盒(美国Roche公司);检测ET-1、sVCAM-1的ELISA试剂盒(美国BD公司);兔抗Bax、Bcl-2、Cleaved caspase-3、GAPDH单克隆抗体(美国Abcam公司);辣根过氧化酶标记(HRP)的山羊抗兔IgG(广州晶彩);二胺基联苯胺(DAB)显色试剂盒(中杉金桥);其他试剂均为国产分析纯。电泳槽、电泳仪及化学发光荧光成像系统(美国Bio-Bad公司)。
1.3 方法
1.3.1 样本采集 于剖宫产手术当日采集3组产妇的晨起空腹肘静脉血5 mL,1 200 rpm/min离心5 min后收集血清,置于-80℃冰箱中储存,以备后续实验使用;术中胎盘娩出后立即在无菌条件下于胎盘母体面取大小约1 cm×1 cm×1 cm蜕膜组织5~10块,置于预冷的无菌生理盐水中并迅速带回实验室,再次使用无菌生理盐水进行充分漂洗,以去除残存血迹,置于4%的多聚甲醛中进行固定。
1.3.2 免疫组织化学(immunohistochemical,IHC)染色 取固定于4%的多聚甲醛溶液中的胎盘组织,梯度酒精脱水,二甲苯透化,石蜡包埋后,切片至4 mm厚度,脱蜡水化后,应用柠檬酸缓冲液微波进行抗原修复,冷却至室温后,PBS漂洗组织,加入5% BSA于室温下孵育20 min进行封闭,滴加适当稀释后的兔抗DLL4单克隆抗体(1∶100)4℃过夜,次日于室温下复温20 min,PBS溶液冲洗3次,每次5 min。再加入HRP标记的二抗,37℃恒温反应半小时,PBS溶液冲洗3次,每次5 min。加DAB显色液显色(棕色),显微镜下观察,以及时终止显色。苏木精轻微复染,返蓝后,再次脱水,透化,中性树脂封片,显微镜下观察并参考相关文献[15]进行结果判定及分析。
1.3.3 酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测血清中内皮素-1、可溶性血管细胞黏附分子-1表达水平 按照内皮素-1(endothelian-1,ET-1)、可溶性血管细胞黏附分子-1(soluble vascular cell adhesion molecule-1,sVCAM-1)的ELISA试剂盒使用说明方法检测3组孕妇产妇血清中上述细胞因子表达水平。上述实验单独重复3次。
1.3.4 内皮细胞的培养及分组 常规复苏HUVEC后使用含10% FBS、1%青链霉素的RPMI1640培养基于37℃、5% CO2恒温培养箱进行培养。待细胞生长融合至80%~90%时用0.25%的胰酶进行消化传代。按实验目的并参考相关文献[16-18]将内皮胞分为4组:阴性对照(negative control,NC)组,正常培养,无任何特殊处理的HUVEC;PE血清组,使用含20%PE组孕产妇血清的 RPMI1640培养基进行处理的HUVEC;PE血清组+低分子肝素组,使用含20%PE患者血清与10 IU/mL的RPMI1640培养基进行处理的HUVEC;PE血清组+低分子肝素组+MK-O752组,使用含20%PE患者血清与10 IU/mL及25 uM的RPMI1640培养基进行处理的HUVEC。
1.3.5 TUNEL染色检测凋亡 选取处于对数生长期的HUVEC,常规消化后,细胞计数,取约1×105个细胞接种至15 mm的细胞爬片上,按上述条件于培养箱中培养24 h后,按方法1.3.4进行处理,并将细胞分为NC组,PE血清组,PE血清组+低分子肝素组,再次置于培养箱中培养24 h后,使用4%的多聚甲醛于室温下固定30 min,PBS轻轻洗涤细胞,根据TUNEL试剂盒使用说明方法进行染色,每张爬片滴加50 uL的TUNEL染色液,室温下避光孵育1 h,PBS充分洗涤后加入DAPI进行染核,PBS再次洗涤细胞,最后加入封片液于荧光显微镜观察。
1.3.6 单层内皮细胞膜通透系数的检测 取生长状态良好的HUVEC,计数后按1×105个/孔接种于24孔板的Transwell小室中,分别于上室及下室中加入100 uL、600 uL的RPMI1640培养液,于37℃、5% CO2恒温培养箱培养24 h待细胞生长融合至单层内皮细胞后,更换上、下室的培养液为不含FBS与酚红的RPMI1640培养液,培养4 h后进行透光性检测。按方法1.3.4中对HUVEC进行不同的分组处理,同时在上室加入100 uL FITC标记的葡聚糖FD40(1 ug/mL),培养5 min后取下室培养液200 uL于荧光分光光度计中检测葡聚糖FD40的荧光强度作为基础值,下室中补充等体积的RPMI1640。于培养箱中培养24 h时,再次取200 uL的下室培养液按上述方法检测葡聚糖FD40的荧光强度。每组设置5个复孔。应用各组最终检测值减去基础值作为葡聚糖FD40的荧光强度,计算分析各组细胞的葡聚糖FD40荧光强度值变化。
1.3.7 Western blot实验 取方法1.3.4中不同处理的各组细胞,RIPA细胞裂解液及蛋白酶抑制剂进行提取内皮细胞中的总蛋白。BCA法进行蛋白定量,按照1∶4向上清液中加入5×上样缓冲液,并于沸水中加热变性10 min。取35 ug的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,采用湿转法将分离的蛋白转至PVDF膜上,5%的脱脂牛奶于室温下封闭2 h后,分别加入Bax(1∶500)、Bcl-2(1∶500)、Cleaved caspase-3(1∶500)、GAPDH(1∶1 000)一抗,4℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗(1∶5 000)室温孵育1 h,以 TBST溶液清洗3次,5 min/次。最后均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。以上实验单独重复3次。
1.4 统计学分析
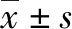
2 结果
2.1 3组产妇的一般情况比较
3组产妇的年龄、孕周及体质量指数比较,差异均无统计学意义(P>0.05),PE组和低分子肝素组产妇的舒张压、收缩压、24 h尿蛋白均高于对照组,差异有统计学意义(P<0.05),详见表1。
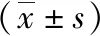
表1 3组产妇的一般情况
2.2 低分子肝素对子痫前期患者血清中ET-1、sVCAM-1表达的影响
与对照组相比,PE组及低分子肝素组产妇血清中ET-1、sVCAM-1表达水平明显更高;与PE组相比,低分子肝素组产妇血清中上述细胞因子的表达水平明显更低,差异均有统计学意义(P<0.05),详见表2。
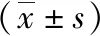
表2 低分子肝素对PE患者血清中ET-1、sVCAM-1表达的影响
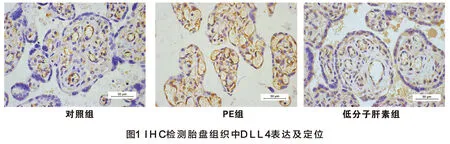
2.3 低分子肝素对子痫前期患者胎盘组织中DLL4表达的影响
IHC检测结果显示DLL4主要表达于胎盘组织的血管内皮细胞中,且与对照组(63.5%)相比,PE组及低分子肝素组的胎盘组织中DLL4的表达阳性率(分别为14.7%、36.9%)均明显更低(χ2=8.263,P=0.031),而低分子肝素组较PE组中DLL4的表达明显更高,差异均有统计学意义(χ2=12.541,P=0.027),见图1(彩插1)。
2.4 低分子肝素对子痫前期血清诱导的内皮细胞凋亡的影响
TUNEL染色结果显示,与NC组相比,PE血清组处理后内皮细胞的凋亡率明显更高(P<0.05),而与PE血清组相比,PE血清+低分子肝素组的细胞凋亡率明显更低(P<0.05),见图2(彩插1)。

2.5 低分子肝素对子痫前期血清诱导的内皮细胞完整性的影响
通过内皮细胞通透性试验来检测低分子肝素对PE血清诱导的内皮细胞的完整性影响,实验结果显示,与NC组相比,HUVEC在PE血清处理24h后,细胞的通透性明显更高(P<0.05),而与PE血清组相比,PE血清+低分子肝素组的细胞通透性明显更低(P<0.05),见图3。
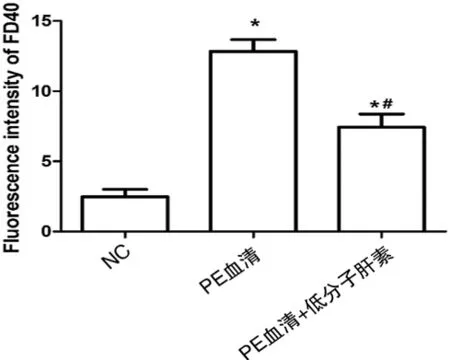
注:与NC相比,*P<0.05;与PE血清组相比,#P<0.05。
2.6 低分子肝素对子痫前期血清诱导的内皮细胞中凋亡蛋白表达的影响
应用Notch通路阻滞剂MK-0752检测低分子肝素是否主要通过Notch/DLL4信号通路发挥抗PE血清诱导的内皮细胞凋亡的作用,Western blot实验检测不同处理情况下的HUVEC中凋亡相关蛋白Bcl-2、Bax及Cleaved-caspase-3的表达,结果显示,与NC组相比,HUVEC在PE血清处理后,细胞中抗凋亡蛋白Bcl-2的表达明显更低(P<0.05),而蛋白Bax及Cleaved-caspase-3的表达均明显更高(P<0.05);而与PE血清+低分子肝素组相比,PE血清组与PE血清+低分子肝素+MK-0752组中抗凋亡蛋白Bcl-2表达明显更低(P<0.05),Bax及Cleaved caspase-3蛋白明显更高(P<0.05),见下页图4。

图4 低分子肝素通过Notch/DLL4信号通路抑制PE血清诱导的内皮细胞中凋亡蛋白
3 讨论
近年来,随着生活习惯的改变与妊娠平均年龄的不断增加,PE的发生率也随之升高[2]。低分子肝素因其具有抗炎、抗血栓、安全性较高等特点,理论上能够改善处于高凝、炎症因子大量释放及血管内皮受损的PE患者临床症状。同时,国内外大量研究证实对PE患者加用低分子肝素能够明显减少抽搐的发生,延长妊娠时间并改善预后[8,19]。Notch基因最早在研究果蝇的神经系统发育中被发现,在果蝇中该基因的局部功能缺失会导致其翅膀边沿形成一些缺刻(Notch)而得名。在哺乳动物体内,Notch信号通路拥有4种受体及5种配体,分别为Notch1-4受体与配体Jagged1、Jagged2及Delta样配体DLL1、DLL3、DLL4[20]。在小鼠心外膜血管生成的研究中发现富含低分子肝素的舒洛地平能够通过抑制Notch1/DLL4信号通路的活化,进而下调血管内皮生长因子的表达,最终抑制心外膜组织中血管的生成[21]。而DLL4是唯一特异性存在于血管内皮细胞的Notch信号配体,其能通过Notch信号通路影响血管生成,尤其是在调控胚胎血管发育与肿瘤血管形成中具有重要的地位。正常生理情况Notch/DLL4信号通路主要通过抑制内皮细胞的活性,下调其迁移、分化能力,进而抑制血管的萌发及分支的生成,维持血管形态及稳定[22]。在既往的研究发现DLL4在PE患者胎盘组织中的表达显著降低[13-14],提示炎症因子及氧化应激等不良刺激通过Notch/DLL4信号通路可能参与PE血管内皮损伤的发生发展。
硫酸镁作为预防及治疗PE的临床一线用药,能够通过减少患者体内乙酰胆碱的释放,松弛骨骼肌以预防子痫发作,然而临床工作中发现单用硫酸镁治疗PE的疗效并不理想,因此常常采用硫酸镁与拉贝洛尔等其他减压药物进行联合治疗。在本研究中我们通过观察对比单用硫酸镁与联合应用硫酸镁与低分子肝素进行治疗的PE患者中胎盘组织DLL4的表达发现,较正常妊娠的胎盘组织相比,PE患者中的DLL4表达显著降低,而联合使用硫酸镁与低分子肝素治疗的PE患者胎盘组织中DLL4的表达显著增加,且DLL4主要定位于胎盘组织的内皮细胞中。这提示低分子肝素对PE的治疗可能与内皮细胞中DLL4表达增加有关。ELISA检测受试者血清中内皮损伤相关细胞因子ET-1与sVCAM-1的表达显示,PE患者中ET-1、sVCAM-1表达较正常妊娠孕产妇明显增加,而联合使用低分子肝素后PE患者中的上述细胞因子水平较单用硫酸镁的患者明显降低。ET-1、sVCAM-1是血管内皮激活或损伤的标志性细胞因子,当内皮细胞损伤时其表达将显著增加[23]。为进一步明确低分子肝素是否通过DLL4对内皮细胞发挥保护作用,本研究应用PE患者血清刺激不同处理情况下的HUVEC,结果证实预先使用低分子肝素处理可显著抑制PE血清对内皮细胞的促凋亡作用,并改善PE血清对其通透性的影响,进而保护内皮细胞的完整性。最后Western blot结果表明,低分子肝素能够通过促进抗凋亡相关蛋白Bcl-2的表达,抑制促凋亡蛋白Bax、Cleaved caspase-3表达来改善PE血清对内皮细胞损伤,而使用Notch信号通路抑制剂MK-0752能显著逆转低分子肝素对凋亡相关蛋白的上述影响,即降低抗凋亡相关蛋白Bcl-2的表达,而促进Bax、Cleaved caspase-3表达。Bax是分布于细胞质中的重要促凋亡蛋白,其在接受上游传导的凋亡信号后被激活并发生分子构象的改变,随即进入线粒体并破坏线粒体膜的完整性,其还可以与凋亡抑制蛋白Bcl-2相结合,对抗其抗凋亡作用。凋亡蛋白酶Caspase-3是各种凋亡途径的枢纽分子,也是细胞凋亡的指示剂,它的激活表示细胞已进入凋亡早期,并最终发生细胞死亡[24]。
综上,本研究发现联合使用低分子肝素能够通过促进胎盘组织内皮细胞中DLL4的表达,其可能通过Notch/DLL4信号通路抑制内皮细胞的凋亡,从而保护内皮细胞的完整性。本研究从内皮细胞损伤层面论证了低分子肝素在PE患者治疗中的有效性,为临床低分子肝素在临床治疗中的推广提供新的依据。

