益髓方改善胃癌小鼠化疗后骨髓抑制机制研究*
黄春风,杨先玉,郑慧华,刘大毛,陈盼敏,喻敏,王征
1.江西中医药大学附属医院,江西 宜春 330000; 2.江西中医药大学第二附属医院,江西 南昌 336000; 3.上饶市人民医院,江西 上饶 334000
目前,胃癌是发病率排名第四位的癌症,而化疗是其主要治疗手段[1-3]。虽然化疗在恶性肿瘤的前期治疗中发挥较为显著的作用,但90%以上的化疗药物会对患者造成不同程度的骨髓抑制,严重影响患者的生存质量,因此,骨髓抑制成为癌症治疗的最大障碍[4]。针对化疗后的骨髓抑制现象,临床上主要通过使用重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)、促红细胞生成素(erythropoietin,EPO)及造血干细胞移植等方法进行治疗,虽然效果显著,但治疗费用昂贵,且反复注射rhG-CSF可能会加重骨髓衰竭[5]。因此,寻找改善化疗后骨髓抑制的药物和疗法至关重要。随着中医药现代化的推进,中医药防治化疗后骨髓抑制的研究逐渐深入。研究显示,中药可通过益气养血、滋补肾精的功效提高骨髓造血功能、增强免疫的作用[6-7]。益髓方是健脾补血、补肾益髓的代表中药方剂。研究证明,益髓方对胃癌晚期患者化疗后的骨髓抑制具有良好的改善作用,能明显改善贫血等临床症状,提高患者生存质量[8],但其具体作用机制尚不清晰。Notch信号通路是一类癌症相关信号通路,抑制Notch信号通路的激活可抑制胃癌细胞的增殖和转移[9-10]。研究发现,Notch信号通路某些关键基因的表达改变可能与骨髓抑制密切相关,其过度活化或抑制均可对骨髓造血活动产生影响[11-12]。本研究构建胃癌小鼠化疗后骨髓抑制模型,以Notch信号通路为切入点,观察益髓方对该模型小鼠的改善作用,并初步探究其作用机制,为益髓方治疗化疗后骨髓抑制提供临床理论依据。
1 材料
1.1 动物和细胞50只SPF级BALB/c小鼠,雌雄各半,6~8周龄,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0008。实验动物饲养在室温(22±2) ℃、湿度(50±10)%的环境中,保持12 h光照/12 黑暗,自由饮食、饮水。研究方案获江西中医药大学附属医院伦理委员会批准,伦理批号:JXZYYDXFSYY20190726。
小鼠胃癌细胞(mouse forestomach carcinoma,MFC)购自中国医学科学院基础医学研究所细胞资源中心,目录号:1101MOU-PUMC000143。
1.2 药物与试剂益髓方(龟甲50 g、黄芪20 g、党参20 g、白术20 g、黄精30 g、菟丝子30 g、鸡血藤 30 g、枸杞15 g、紫珠草30 g、仙鹤草30 g、花生衣 30 g、大枣6 g,康美药业股份有限公司,批号:200310181、19111002、190410120、190910819、200118013、190708121、200510122、191210092、191210103、190612108、200209101、191108032);重组人粒细胞刺激因子注射液[吉粒芬,杭州九源基因工程有限公司,规格:0.3 mL(75 μg),国药准字:S10980030];注射用环磷酰胺(cyclophosphamide,CTX,江苏恒瑞医药股份有限公司,国药准字:H32020857)。瑞氏-吉姆萨复合染液、碘化丙啶(propidium iodide,PI)、ECL超敏发光液、脱脂奶粉、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,货号:G1020、P8080、PE0010、D8340、PC0020);白细胞介素-6(interleukin-6,IL-6)、IL-3、血小板生成素(thrombopoietin,TPO)、EPO、粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)ELISA试剂盒(武汉伊莱瑞特生物科技有限公司,货号:E-EL-R0896c、E-EL-M0733c、E-EL-R0963c、E-EL-R0007c、E-EL-R0008c);Jag1一抗、Notch2一抗、GAPDH一抗及羊抗兔二抗(美国CST公司,货号:70109、5732、5174、6990);Numb1一抗、Numb2一抗[艾博抗(上海)贸易有限公司,货号:ab4147、ab155415];FITC 仓鼠抗小鼠CD3抗体、PE 大鼠抗小鼠CD4抗体、PerCP 大鼠抗小鼠CD8抗体(美国BD Pharmingen公司,货号:2136674、5090951、5100992)。
1.3 仪器1703935型转印电泳仪、1645050型电泳仪电源、1658001型垂直电泳仪、ChemiDoc MP型凝胶成像仪(美国Bio-Rad公司);BC-30Vet型全自动血液细胞分析仪(迈瑞医疗国际股份有限公司);FlexA-200型全波长酶标分析仪(杭州奥盛仪器有限公司);TGL-20M型台式高速离心机(湖南沪康离心机有限公司,离心半径:12.5 cm);AE2000型倒置显微镜(麦克奥迪实业集团有限公司)。
2 方法
2.1 药物制备取益髓方组方中药,蒸馏水浸泡 2 h 后,煎煮3次,每次30 min,纱布过滤,合并滤液,浓缩至2 kg·L-1(即每升含生药量为2 kg),分装后储存于4 ℃冰箱备用。
2.2 动物分组、造模与给药将50只BALB/c小鼠随机分为5组,即正常组、模型组、吉粒芬组、益髓方组及吉粒芬+益髓方组,每组10只。除空白组外,其余组小鼠皮下接种密度为1×107mL-1的 MFC细胞建立胃癌荷瘤模型,每只小鼠注射 0.2 mL。当腋下肿瘤体积≥200 mm3且无破溃时,胃癌荷瘤小鼠模型构建成功。胃癌荷瘤模型建立成功的小鼠腹腔注射100 mg·kg-1CTX,每天1次,连续3 d,建立小鼠化疗后骨髓抑制模型[13]。造模完成第2天开始给药,吉粒芬组小鼠皮下注射12 μg·kg-1吉粒芬,益髓方组小鼠灌胃40.4 g·kg-1益髓方水煎液,吉粒芬+益髓方组小鼠灌胃40.4 g·kg-1益髓方水煎液同时皮下注射12 μg·kg-1吉粒芬,正常组和模型组小鼠灌胃等体积生理盐水,每天1次,连续7 d。
2.3 全自动血细胞分析仪检测小鼠血常规相关指标末次给药2 h后,小鼠摘眼球取血,与枸橼酸钠溶液混合均匀(血液与枸橼酸钠溶液的比例为91),采用全自动血细胞分析仪检测白细胞(white blood cell,WBC)计数、红细胞(red blood cell,RBC)计数、血红蛋白(hemoglobin,Hb)总量和血小板(platelet,PLT)计数等血常规相关指标。
2.4 流式细胞仪检测小鼠外周血免疫细胞亚群比例收集各组小鼠血液1 mL,按照2.3所述方法抗凝后,1 000 r·min-1离心10 min,取血浆100 μL,加入1 mL 10%溶血素,混合均匀后反应10 min,PBS洗涤2次,加入荧光标记的CD3、CD4和CD8流式抗体,4 ℃避光孵育20 min,流式细胞仪检测CD3+、CD4+和CD8+淋巴细胞亚群比例。
2.5 ELISA法检测小鼠血清造血细胞因子的表达将各组小鼠血液在4 ℃冰箱中静置2 h,3 000 r·min-1离心10 min,取血清,严格按照ELISA试剂盒说明书进行操作,绘制标准曲线,计算各组小鼠血清中IL-3、IL-6、TPO、EPO和GM-CSF的水平。
2.6 瑞氏-吉姆萨染色检测小鼠骨髓有核细胞(bone marrow nucleated cells,BMNCs)小鼠处死后,无菌条件下分离两侧股骨,剪去股骨两端,6号针头吸取生理盐水冲洗骨髓腔,将冲出的骨髓细胞制成单个骨髓细胞悬液,吸取5 μL制备细胞涂片,自然干燥后滴加瑞氏-吉姆萨复合染液2~3滴,染色1~2 min,滴加PBS缓冲液,轻轻晃动涂片,使之与瑞氏-吉姆萨染液混合均匀后再染色 3~5 min,水洗,置于显微镜高倍镜下对细胞进行分类计数。
2.7 流式细胞仪检测小鼠骨髓细胞周期变化将2.6项下所述方法制备的骨髓细胞悬液转移到离心管,1 000 r·min-1离心5 min,弃上清,PBS洗涤2次,加1 mL PBS重悬,加入2 mL无水乙醇混匀,4 ℃ 固定30 min,1 000 r·min-1离心5 min,PBS洗涤2次,加入100 μL PBS重悬,再加入500 μL含有50 mg·L-1PI的PBS,混匀,4 ℃避光孵育30 min,流式细胞仪检测骨髓细胞周期变化。
2.8 Western Blot检测小鼠骨髓细胞中Notch信号通路相关蛋白表达水平按2.6项下所述方法收集小鼠骨髓细胞,提取蛋白并进行定量,十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,湿转至PVDF膜,脱脂奶粉封闭2 h,加Jag1、Notch2、Numb1、Numb2一抗(11 000),4 ℃孵育过夜,加二抗(11 000),37 ℃孵2 h后,加发光试剂,于凝胶成像仪中成像,Image J软件对各个目的蛋白和内参蛋白GAPDH的灰度值进行量化,计算目的蛋白的相对表达量。

3 结果
3.1 益髓方对小鼠血常规相关指标的影响与正常组比较,模型组小鼠WBC、RBC、PLT计数及Hb总量显著降低(P<0.05);与模型组比较,益髓方组小鼠WBC、PLT计数显著升高(P<0.05),吉粒芬组和吉粒芬+益髓方组小鼠WBC、RBC、PLT计数及Hb总量显著升高(P<0.05);与吉粒芬组比较,益髓方组小鼠WBC、RBC计数及Hb总量显著降低(P<0.05),而吉粒芬+益髓方组小鼠WBC、RBC、PLT计数显著升高(P<0.05);与益髓方组比较,吉粒芬+益髓方组小鼠WBC、RBC、PLT计数及Hb总量显著升高(P<0.05)。提示,益髓方可显著改善化疗后骨髓抑制模型小鼠的血常规异常,且吉粒芬与益髓方联合用药效果更佳。见图1。
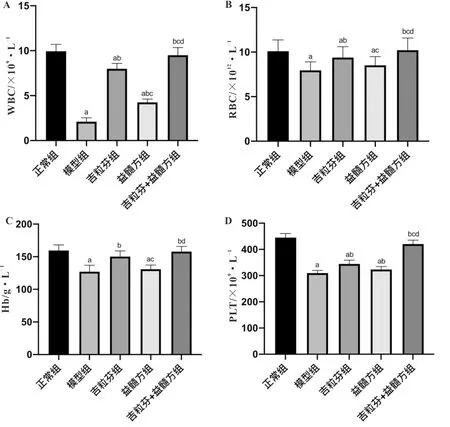
注:A:WBC计数;B:RBC计数;C:Hb含量;D:PLT计数;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与吉粒芬组比较,cP<0.05;与益髓方组比较,dP<0.05图1 益髓方对小鼠血常规相关指标的影响
3.2 益髓方对小鼠外周血免疫细胞亚群比例的影响与正常组比较,模型组小鼠外周血CD3+、CD4+、CD8+细胞比例和CD4+/CD8+比值均显著降低(P<0.05);与模型组比较,各给药组小鼠外周血CD3+、CD4+、CD8+细胞比例和CD4+/CD8+比值均显著升高(P<0.05);与吉粒芬组比较,益髓方组小鼠外周血CD3+、CD4+、CD8+细胞比例显著降低(P<0.05),而吉粒芬+益髓方组小鼠外周血CD3+、CD4+细胞比例和CD4+/CD8+比值均显著升高(P<0.05);与益髓方组比较,吉粒芬+益髓方组小鼠外周血CD3+、CD4+、CD8+细胞比例和CD4+/CD8+比值均显著升高(P<0.05)。提示,益髓方可显著改善化疗后骨髓抑制模型小鼠的免疫抑制,且吉粒芬与益髓方联合用药效果更佳。见图2。
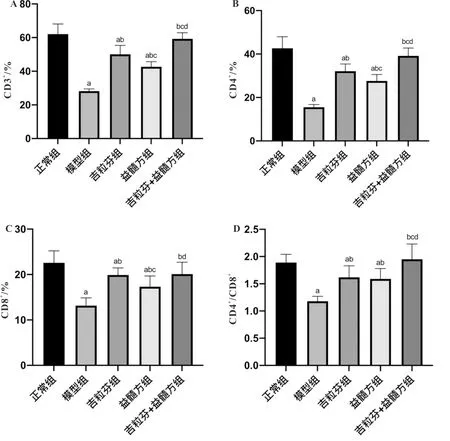
注:A:CD3+细胞比例;B:CD4+细胞比例;C:CD8+细胞比例;D:CD4+/CD8+比值;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与吉粒芬组比较,cP<0.05;与益髓方组比较,dP<0.05图2 益髓方对小鼠外周血免疫细胞亚群比例的影响
3.3 益髓方对小鼠血清造血因子水平的影响与正常组比较,模型组小鼠血清IL-3、IL-6、TPO、EPO、GM-CSF的水平显著降低(P<0.05);与模型组比较,吉粒芬组小鼠血清IL-3、IL-6的水平显著升高(P<0.05),益髓方组和吉粒芬+益髓方组小鼠血清IL-3、IL-6、TPO、EPO、GM-CSF的水平显著升高(P<0.05);与吉粒芬组比较,益髓方组和吉粒芬+益髓方组小鼠血清IL-3、IL-6、TPO、EPO、GM-CSF的水平显著升高(P<0.05);与益髓方组比较,吉粒芬+益髓方组小鼠血清IL-3、IL-6、TPO、EPO、GM-CSF的水平显著升高(P<0.05)。提示,益髓方可显著改善化疗后骨髓抑制模型小鼠的骨髓造血功能,且吉粒芬与益髓方联合用药效果更佳。见图3。
3.4 益髓方对小鼠BMNCs数量的影响与正常组比较,模型组小鼠BMNCs计数明显降低(P<0.05);与模型组比较,益髓方组和吉粒芬+益髓方组小鼠BMNCs计数均明显升高(P<0.05);与吉粒芬组比较,益髓方组和吉粒芬+益髓方组小鼠BMNCs计数均明显升高(P<0.05)。见图4,图5。
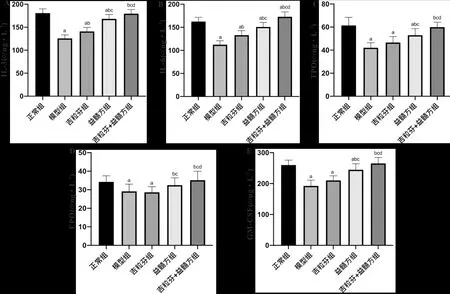
注:A:IL-3;B:IL-6;C:TPO;D:EPO;E:GM-CSF;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与吉粒芬组比较,cP<0.05;与益髓方组比较,dP<0.05图3 益髓方对小鼠血清造血因子水平的影响

图4 瑞氏-吉姆萨染色观察各组BMNCs计数(×1 000)
3.5 益髓方对小鼠骨髓细胞周期的影响与正常组比较,模型组小鼠骨髓细胞处于G0/G1期的细胞比例显著升高(P<0.05),S期细胞比例显著降低(P<0.05)。与模型组比较,吉粒芬组小鼠骨髓细胞处于G0/G1期细胞比例显著降低(P<0.05),G2/M期细胞比例显著升高(P<0.05);益髓方组和吉粒芬+益髓方组小鼠骨髓细胞处于G0/G1期细胞比例显著降低(P<0.05),S期和G2/M期细胞比例显著升高(P<0.05);与吉粒芬组比较,益髓方组和吉粒芬+益髓方组小鼠骨髓细胞处于G0/G1期细胞比例显著降低,S期和G2/M期细胞比例显著增加(P<0.05)。见图6,表1。

表1 各组小鼠骨髓细胞周期情况比较
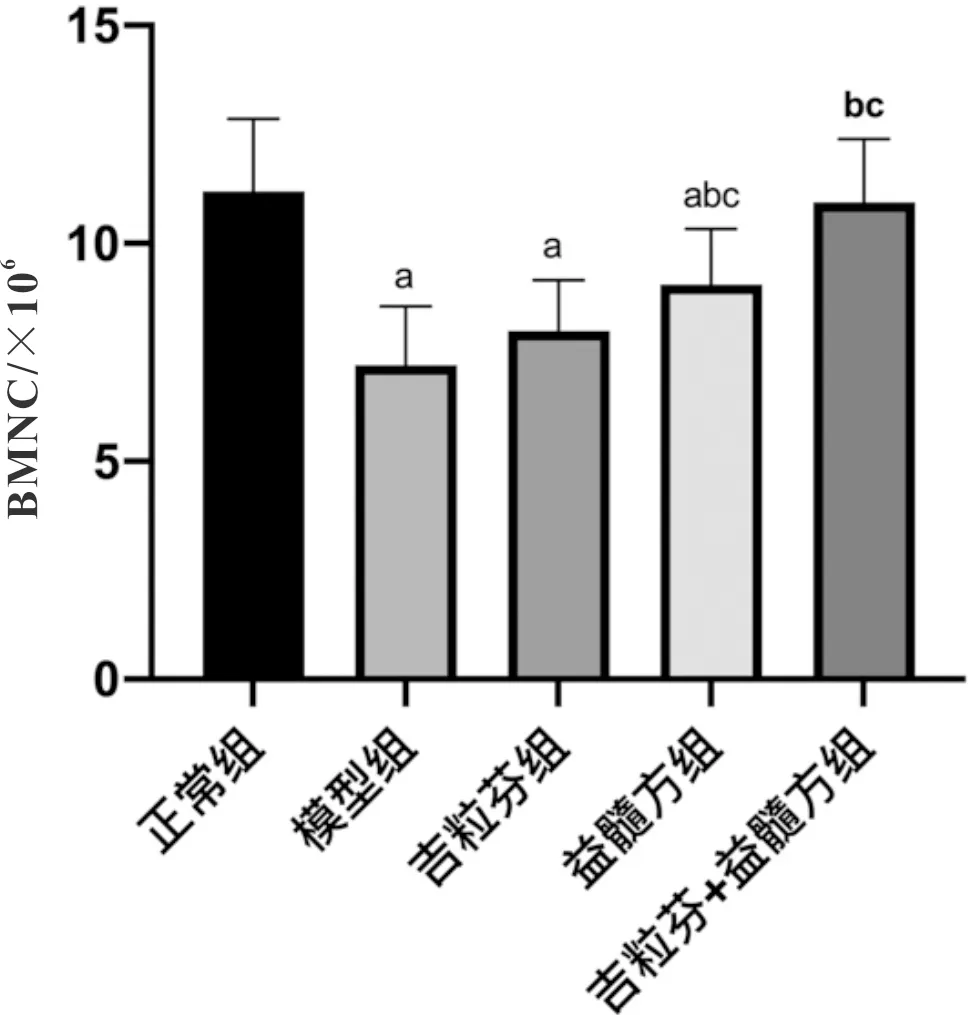
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与吉粒芬组比较,cP<0.05图5 各组小鼠BMNCs数量比较

图6 各组小鼠骨髓细胞周期分布图
3.6 益髓方对小鼠骨髓细胞Notch信号通路相关蛋白表达水平的影响与正常组比较,模型组小鼠骨髓细胞中Numb1、Numb2的蛋白表达水平显著降低(P<0.05),Jag1、Notch2蛋白表达水平显著升高(P<0.05);与模型组比较,各给药组小鼠骨髓细胞中Numb1、Numb2的蛋白表达水平显著升高(P<0.05),Jag1、Notch2的蛋白表达水平显著降低(P<0.05);与吉粒芬组比较,益髓方组和吉粒芬+益髓方组小鼠骨髓细胞中Numb1、Numb2的蛋白表达水平显著升高(P<0.05),Jag1、Notch2的蛋白表达水平显著降低(P<0.05);与益髓方组比较,吉粒芬+益髓方组小鼠骨髓细胞中Numb1、Numb2的蛋白表达水平显著升高(P<0.05),Jag1、Notch2的蛋白表达水平显著降低(P<0.05)。见图7,图8。

图7 Western Blot检测各组小鼠骨髓细胞中Notch信号通路相关蛋白的表达
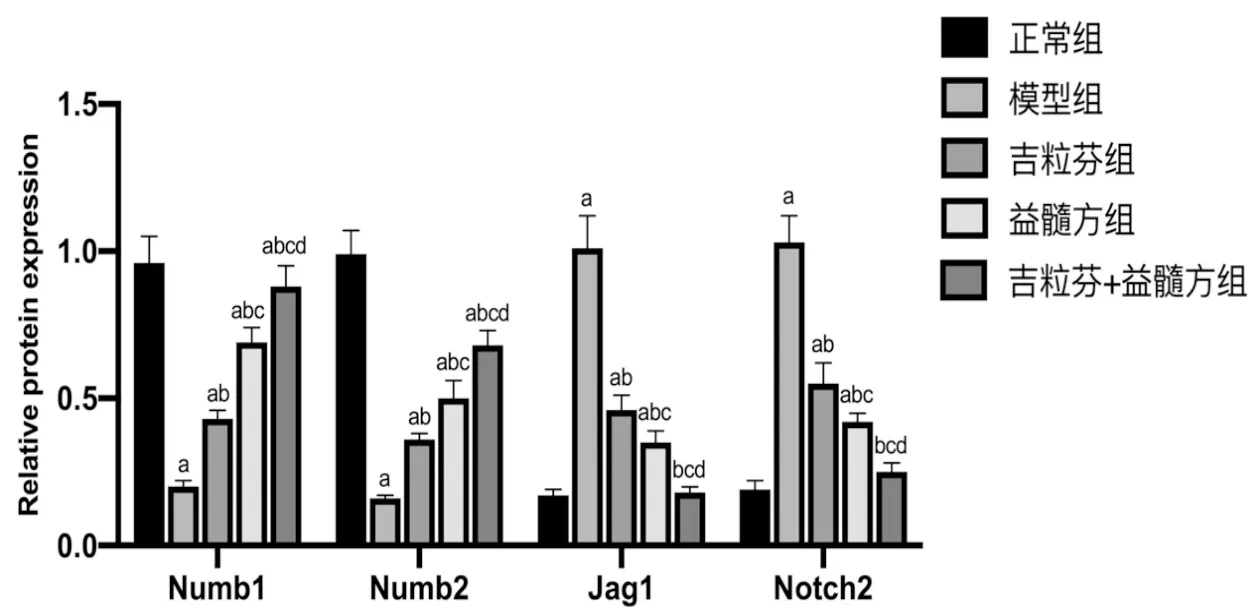
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与吉粒芬组比较,cP<0.05;与益髓方比较,dP<0.05图8 各组小鼠骨髓细胞Notch信号通路蛋白表达水平比较
4 讨论
骨髓抑制是癌症患者化疗过程中极易出现的不良反应,导致患者无法足量、按时完成化疗,因此,在临床治疗中,骨髓抑制的发生被认为是癌症化疗成功与否的关键[14]。骨髓抑制的临床表现主要为外周血WBC、RBC、PLT等明显减少,患者有出血、贫血和免疫力下降等临床症状。中医学认为,化疗后骨髓抑制与气血不足、脾肾两虚有关,可通过健脾补血、补肾益髓的方法提高骨髓造血功能、增强免疫力[15-16]。益髓方由龟甲、黄芪、党参、白术、黄精、菟丝子、鸡血藤、枸杞子、紫珠草、仙鹤草、花生衣、大枣共十二味中药材组成,方中龟甲潜阳填髓,党参、黄芪和白术健脾养胃、补中益气,黄精和菟丝子补脾益气、滋补肾精,鸡血藤和枸杞子补血通络、补肾养血,紫珠草、仙鹤草和花生衣凝血止血,大枣健脾益气,诸药联合使用共奏健脾补血、补肾益髓之功效,能够显著改善生血环境,提高患者造血功能,改善贫血症状。本研究构建胃癌小鼠化疗后骨髓抑制模型,全自动血细胞分析仪检测小鼠血常规指标发现,胃癌荷瘤小鼠使用CTX进行化疗后,外周血WBC、RBC、Hb、PLT水平均显著降低,给予益髓方治疗后WBC、PLT显著升高,而益髓方和吉粒芬联合使用可显著提高小鼠外周血WBC、RBC、PLT计数和Hb水平,表明益髓方能够显著改善化疗后骨髓抑制小鼠外周血象,联合吉粒芬使用效果优于益髓方单用。
恶性肿瘤的发生与免疫系统功能的改变密切相关,T淋巴细胞主要介导细胞免疫,大多数恶性肿瘤患者在化疗后出现外周血CD3+T淋巴细胞和CD4+T淋巴细胞减少,CD8+T淋巴细胞水平增加的现象[17-18]。CD3+T细胞代表总T细胞水平,主要反映机体的细胞免疫状态,根据细胞表面标志物不同,T淋巴细胞分为CD4+T淋巴细胞和CD8+T淋巴细胞两个主要亚群,CD4+T淋巴细胞具有提高免疫的作用,CD8+T淋巴细胞则相反,CD4+和CD8+T淋巴细胞在正常机体处于动态平衡,当这一平衡被打破,机体的免疫功能则出现紊乱[19-20]。本研究结果显示,模型组小鼠外周血CD3+细胞、CD4+细胞、CD8+细胞比例和CD4+/CD8+比值均降低,给予益髓方干预后,可使CD3+细胞、CD4+细胞、CD8+细胞比例和CD4+/CD8+比值整体升高,且益髓方联合吉粒芬作用效果更为显著,提示益髓方联合吉粒芬可协同改善胃癌小鼠化疗后的免疫抑制。
骨髓造血是一个复杂的过程,依赖于造血微环境中多种造血调节因子共同调控。研究表明,IL-3、IL-6、GM-CSF与造血干细胞增殖和分化活动密切相关,能与靶细胞表面受体结合,协同调控造血干细胞的分化和成熟[21-22]。TPO和EPO则是参与血小板和红细胞生成的关键调控因子,可刺激骨髓造血,改善化疗后骨髓抑制[23-24]。本研究结果显示,胃癌荷瘤小鼠化疗后血清IL-3、IL-6、TPO、EPO、GM-CSF的水平显著降低;给予益髓方干预后,小鼠血清IL-3、IL-6、TPO、EPO、GM-CSF水平明显升高,且益髓方和吉粒芬两药联用的效果显著优于益髓方单用,表明益髓方与吉粒芬联合可协同升高血清造血因子水平。另外,与正常组比较,模型组小鼠BMNCs计数明显降低,G0/G1期细胞比例增加,S期细胞比例减少;给予益髓方后BMNCs数量升高,G0/G1期细胞比例降低,S期和G2/M期细胞比例显著升高,表明益髓方可改善骨髓造血微环境,促进骨髓造血细胞的增殖。
Notch信号通路是一条进化高度保守的信号转导途径,与多种癌症的发生发展密切相关。研究表明,Notch1和Jag1是胃癌中独立的预后不良指标[25-26]。Numb是Notch信号通路的负调节基因,可抑制Notch信号通路的激活,在机体发育和微环境稳态中起重要作用[27]。研究显示,下调荷瘤小鼠骨髓细胞中Jag1、Notch2的表达可改善造血微环境,减轻小鼠化疗后骨髓抑制,提高骨髓细胞造血功能[28]。白鸽等[29]研究发现,骨髓抑制小鼠骨髓细胞中Numb2mRNA表达量显著降低,Jag1mRNA的表达增加。本研究结果显示,与正常组比较,模型组小鼠骨髓细胞Numb1、Numb2的蛋白表达水平显著降低,Jag1、Notch2蛋白表达水平显著升高;给予益髓方干预后,Numb1、Numb2蛋白表达显著升高,Jag1、Notch2蛋白表达显著降低,且吉粒芬与益髓方联合用药组的作用效果优于益髓方单用,表明益髓方可单独或协同吉粒芬上调Numb1和Numb2的表达水平,抑制Notch信号通路的过度活化。
综上所述,益髓方可单独或协同吉粒芬改善胃癌化疗后骨髓抑制小鼠外周血象,提高外周血免疫细胞亚群水平及血清造血因子IL-3、IL-6、TPO、EPO、GM-CSF水平和骨髓BMNCs数量,改善骨髓造血微环境,促进骨髓造血细胞的增殖,其作用可能与抑制Notch信号通路的过度活化有关。

