阿托伐他汀对大鼠脑缺血再灌注神经功能的保护作用及机制
樊明新,田 刚,祖丽菲亚
(新疆心脑血管病医院神经外科,乌鲁木齐 830000)
当前,缺血性脑血管疾病具有较高的发病率和致死率,严重威胁着人类的健康。缺血性脑卒中是缺血性脑血管疾病中最常见的一种类型,主要因为脑血管损伤、血栓脱落及血管局部动脉粥样硬化等导致脑供血的动脉栓塞,从而引发脑组织缺血、坏死,临床上常运用溶栓、抗凝药物等改善脑血液循环,但血管再通所导致的脑缺血再灌注(cerebral ischemia-reperfusion,CIR)会进一步加重脑组织损伤,一直以来是困扰临床医生的难题。CIR损伤的病理机制与线粒体损伤、氧化应激和炎性反应密切相关[1-2]。因此,降低CIR后氧化应激水平、减轻炎性反应是防治CIR的关键之一。阿托伐他汀是一种新型人工合成降脂药,可有效降低血清低密度脂蛋白胆固醇及总胆固醇水平,阻止血栓形成及改善血管内皮功能,在预防急性心血管事件及延缓动脉粥样硬化进展方面具有重要作用[3]。此外,阿托伐他汀具有抗炎和抗氧化作用,对缺血性损伤、急性炎症性损伤等具有较好疗效[4-6],但其作用机制有待进一步研究。本研究探讨阿托伐他汀对大鼠CIR神经功能的保护作用及其可能机制,为临床用药提供理论依据。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠45只,体重200~220 g,由北京华阜康生物科技股份有限公司提供。所有大鼠在实验开始前均自由采食、饮水。将大鼠分为假手术组(sham组)、缺血2 h或6 h再灌注组(cir_2h组,cir_6h组)及阿托伐他汀处理组(cir_2h+ATV组, cir_6h+ATV组),每组9只。采用尼龙线栓法制备CIR模型[7]。cir_2h和cir_6h组大鼠分别缺血2、6 h后,再灌注48 h进行后续实验。cir_2h+ATV组和cir_6h+ATV组大鼠,分别在术前灌胃给予阿托伐他汀混悬液,剂量10 mg/kg,每天灌胃1次,连续7 d,灌胃结束次日,大鼠分别缺血2、6 h后,再灌注48 h进行后续实验。
1.2 主要试剂
阿托伐他汀(纯度大于或等于98%)购自北京索莱宝试剂有限公司;依文思蓝(EB)和甲酰胺均购自阿拉丁试剂(上海)有限公司;NO检测试剂盒购自南京建成生物工程研究所;肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6检测试剂盒均购自美国R&D公司;鼠源p-IκBα、兔源p-p65和鼠源IRF5均购自美国Novus公司;兔源p65和鼠源IκBα均购自美国Santa Cruz公司;山羊抗鼠和山羊抗兔的二抗均购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1神经功能缺损评分
CIR后,对各组大鼠进行神经功能缺损评分以评价大鼠神经功能变化。评分参照Zea-Longa制订的标准[8]:无明显神经病学症状,0分;不能完全伸展左侧前爪,1分;向左侧旋转,2分;行走时向左侧倾倒,3分;不能自行行走,4分。积分越高,说明动物行为障碍越严重。
1.3.2血脑屏障通透性测定
EB渗透法定量分析大鼠血脑屏障通透性变化[9]。大鼠缺血后,股静脉注射2%EB(剂量2 mL/kg)。各组麻醉下用肝素化的生理盐水对大鼠进行心脏灌流,当右心房流出的液体变清澈即可断头。将取出的脑组织称重,剪碎浸入甲酰胺(1 mL/100 mg),60 ℃水浴箱内孵育24 h。离心取上清液,用分光光度计检测上清液在波长620 nm的吸光度,根据标准曲线定量分析EB水平。
1.3.3脑含水率测定
大鼠在麻醉后迅速断头取脑,称量脑湿重,110 ℃烘箱中烘干至恒重,称量脑干重,计算脑含水率。脑含水率=(湿重-干重)/湿重×100%。
1.3.4脑组织常规HE染色
取脑组织,4%多聚甲醛固定、脱水、石蜡包埋后,制作石蜡切片;梯度二甲苯脱蜡后苏木精染色3 min,自来水冲洗1 min;盐酸酒精分化后用依红染色15 s,自来水冲洗1 min;梯度酒精脱水,二甲苯透明后,中性树脂封片,置于显微镜下观察染色情况并拍照。
1.3.5ELISA检测
脑组织按照每100 mg加入100 μL双蒸水匀浆,2 500 r/min离心10 min,取上清液,测定蛋白浓度。并按照ELISA试剂盒说明书测定NO、TNF-α和IL-6水平。
1.3.6荧光定量PCR检测
液氮研磨脑组织至粉末状,Trizol法提取组织RNA并进行逆转录反应。反应条件:95 ℃变性4 min;95 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸5 min。采用2-ΔΔCT法计算出各组中目的基因相对表达量。iNOS:上游引物5′-CGCTATGGCCGCTTCGATG-3′,下游引物5′-GGCAGGCAGCGCATACCAC-3′;eNOS:上游引物5′-CGGCCTGAGCAGCACAAGAG-3′,下游引物5′-CCCAGCCCAAACACACAGAAC-3′;β-actin:上游引物5′-ACCCCGTGCTGCTGACCGAG-3′,下游引物5′-TCCCGGCCAGCCAGGTCCA-3′。
1.3.7Western blot检测
收集各组大鼠脑组织,液氮研磨脑组织至粉末状,加入胰蛋白酶和磷酸酶抑制剂及细胞裂解液,裂解20 min。4 ℃ 12 000 r/min离心15 min,BCA法定量后,调整蛋白浓度,煮沸变性后添加loading buffer。取等量蛋白,10% SDS-PAGE电泳。采用湿转法100 V 20 min将蛋白转移至PVDF膜上。转膜后1×TBST洗膜1次,倒掉废液,加适量5%脱脂奶粉液,室温封闭2 h。1×TBST清洗3次,每次10 min,分别加入IRF5(1∶1 000)、p-IκBα(1∶1 000)、IκBα(1∶1 000)、p-p65(1∶1 000)、p65(1∶1 000)一抗,4 ℃摇床孵育过夜。1×TBST清洗3次,每次10 min,加入相应的二抗(1∶1 000)室温孵育2 h,1× TBST清洗3次,添加显影液,进行化学发光。曝光后使用image J进行灰度分析,β-actin作为内参,计算p-IκBα/IκBα和p-p65/p65。
1.4 统计学处理
2 结 果
2.1 阿托伐他汀对大鼠CIR后神经功能缺损评分的影响
cir_2h组和cir_6h组大鼠神经功能缺损评分较sham组明显增加(P<0.01),cir_6h组增加更明显(P<0.01),在阿托伐他汀处理后,神经功能缺损评分明显减少(P<0.05),见图1。

#:P<0.01,与sham组比较;**:P<0.01,*:P<0.05。
2.2 阿托伐他汀对大鼠CIR后血脑屏障通透性的影响
cir_2h组和cir_6h组大鼠脑组织中EB水平较sham组升高(P<0.01),cir_6h组升高更明显(P<0.01),在阿托伐他汀处理后,EB水平明显降低(P<0.05),见图2。

#:P<0.01,与sham组比较;*:P<0.05,**:P<0.01。
2.3 阿托伐他汀对大鼠CIR后脑含水率的影响
cir_2h组和cir_6h组大鼠的脑含水率较sham组明显升高(P<0.01),cir_6h组变化更明显(P<0.01),在阿托伐他汀处理后,脑含水率明显降低(P<0.01),见图3。
2.4 阿托伐他汀对大鼠CIR后脑组织水肿及坏死的影响
sham组脑组织细胞形态结构正常,排列整齐;cir_2h组和cir_6h组神经胶质细胞出现水肿,阿托伐他汀的处理一定程度上减轻了胶质细胞的肿胀,这与脑含水率测定结果一致。随着缺血时间的延长,脑组织中神经元的损伤也逐渐加剧,并在cir_6h组中神经元出现坏死的现象,阿托伐他汀处理后坏死减少,见图4。

#:P<0.01,与sham组比较;**:P<0.01。
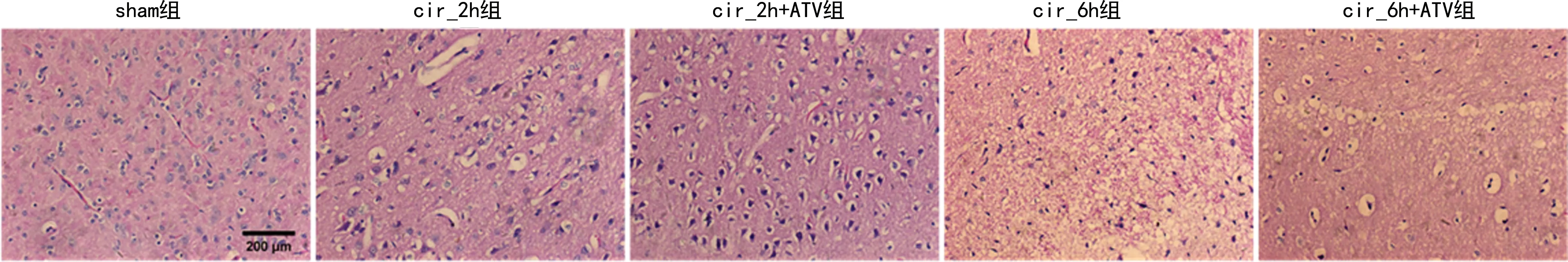
图4 各组大鼠脑组织HE染色(×200)
2.5 阿托伐他汀对大鼠CIR后脑组织TNF-α、IL-6及NO水平的影响
cir_2h组和cir_6h组大鼠的TNF-α和IL-6及NO水平较sham组明显升高(P<0.01),cir_6h组变化更明显(P<0.01),阿托伐他汀处理后NO、TNF-α和IL-6水平明显降低(P<0.01),见图5、6。
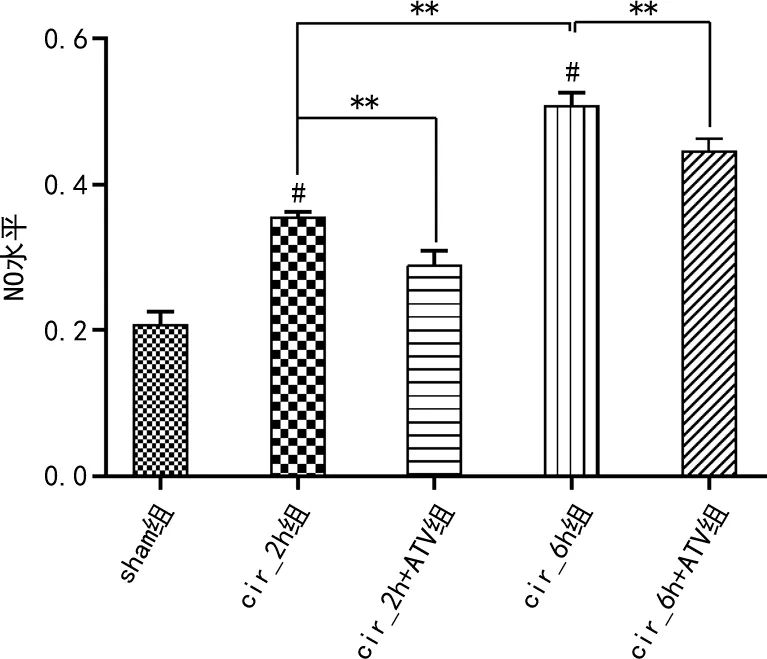
#:P<0.01,与sham组比较;**:P<0.01。

#:P<0.01,与sham组比较;**:P<0.01。
2.6 阿托伐他汀对大鼠CIR后脑组织小胶质细胞M1极化标志iNOS及eNOS的影响
cir_2h组iNOS mRNA表达明显增加(P<0.05),cir_6h组iNOS mRNA表达增加更为明显(P<0.01)。与sham组比较,cir_2h组和cir_6h组eNOS mRNA表达明显增加(P<0.01)。在阿托伐他汀处理后均能明显改变iNOS、eNOS mRNA表达(P<0.01),见图7。
2.7 阿托伐他汀对大鼠CIR后脑组织NF-κB信号通路和IRF5的影响
cir_2h组和cir_6h组p-IκBα/IκBα、p-p65/p65、IRF5蛋白表达较sham组明显升高(P<0.01),在阿托伐他汀处理后p-IκBα/IκBα、p-p65/p65、IRF5蛋白表达明显降低(P<0.01),见图8。

#:P<0.01,与sham组比较;*:P<0.05,**:P<0.01。

#:P<0.01,与sham组比较;**:P<0.01。
3 讨 论
CIR可导致严重脑功能受损,造成神经功能损伤,其机制与线粒体损伤、氧化应激和炎性反应密切相关。近年来,有研究表明他汀类药物能有效缓解CIR对脑造成的损伤作用,改善神经功能,但其机制有待进一步明确[10]。李玉竹等[11]发现,阿托伐他汀能有效地减轻大鼠在CIR后的神经功能损伤,降低神经功能损伤评分。本研究显示,缺血再灌注的处理对大鼠神经功能造成了损伤,增加了神经功能缺损评分。随着缺血时间的延长,对大鼠神经功能的损伤程度也逐渐加重。而阿托伐他汀的处理组可有效地降低大鼠在CIR后的神经功能缺损评分。且阿托伐他汀对cir_2h组相较cir_6h组神经功能缺损评分差异更为明显。这也表明,在缺血早期使用阿托伐他汀可以更好地保护CIR造成的脑损伤。通过对血脑屏障通透性的测定发现,阿托伐他汀处理能明显降低CIR后脑组织中EB水平,表明阿托伐他汀的处理能维持血脑屏障的稳定性,改善大鼠CIR后对血脑屏障的损伤。细胞间紧密连接是血脑屏障最主要的物质结构基础,可阻止病原体和大分子物质进入脑脊液。贺涓涓等[10]研究结果发现,阿托伐他汀处理能明显降低大鼠在CIR之后脑组织中EB水平。类似地使用辛伐他汀的处理同样也使得脑组织中EB水平明显降低,且呈剂量效应[8]。大鼠在CIR后脑含水率明显升高,提示脑部存在水肿的情况,并且随着缺血再灌注时间的延长,水肿更为严重,这与其他研究结果相一致[10]。这可能是因为血脑屏障的破坏使得大分子物质经细胞间隙进入脑组织内部,提高了脑组织渗透压,导致脑水肿的发生。阿托伐他汀处理后,脑含水率明显降低。这可能是由于阿托伐他汀能通过重建脑部血管内皮之间的紧密连接,维持脑部渗透压,减轻大鼠在CIR后的脑水肿。大鼠CIR后脑组织中的神经胶质细胞出现水肿的现象,这与脑含水率的测定结果一致,并且阿托伐他汀处理能在一定程度上减少肿胀的神经胶质细胞数量。随着缺血时间的延长,神经元还出现坏死的情况,李玉竹等[11]研究也发现阿托伐他汀可以减少大鼠在CIR后的神经元损伤。
研究表明,CIR对脑尤其是神经功能的损伤作用可能与NF-κB信号通路的活化导致的炎性反应有关。NF-κB信号通路是调节炎性反应的经典通路,目前发现它能通过促进IL-6和TNF-α等促炎症因子表达,同时IL-6和TNF-α亦能激活NF-κB信号通路,加剧炎症的恶化。研究还发现,他汀类药物能够抑制NF-κB信号通路的活化,抑制促炎因子的释放[12]。本文通过检测NF-κB通路的关键蛋白,发现p-IκBα/ IκBα、p-p65/p65在CIR后有明显升高(P<0.01),NF-κB通路被激活。而阿托伐他汀能够明显抑制NF-κB信号通路的活化。IL-6和TNF-α的ELISA检测结果也与p-IκBα/IκBα、p-p65/p65的变化趋势一致。这也预示着大鼠CIR之后,NF-κB通路被激活,促进了IL-6和TNF-α等促炎因子的表达,大量的促炎因子释放和囤积对脑及神经功能造成严重的损伤,而阿托伐他汀能抑制这一过程。鞠宁[13]研究表明,普伐他汀能抑制心肌缺血再灌注引起的家兔血清TNF-a及IL-6水平的升高,抑制心肌炎性反应。上述研究结果表明阿托伐他汀能通过抑制NF-κB信号通路降低IL-6和TNF-α的合成,缓解炎性反应所释放的促炎因子对脑及神经功能造成的损伤。
炎性反应与巨噬细胞的极化状态有着密切的关系,M1极化表型的巨噬细胞能够释放促炎因子,而M2巨噬细胞则与抗炎反应和组织重塑反应相关[14]。研究发现,小胶质细胞同样存在着极化表型变换。当大脑损伤后,小胶质细胞能够向M1极化表型转换,分泌促炎因子,对大脑造成损伤[15]。本研究发现,M1极化标志物iNOS mRNA表达在阿托伐他汀处理后明显降低(P<0.01),而eNOS mRNA表达明显增加(P<0.01)。研究证实,CIR会导致过量氧自由基NO的释放,它可以与O2-或其他氧自由基发生氧化还原反应,产生更多的活性基团,而iNOS和eNOS能够耦联调控NO的释放[16]。本研究中,iNOS表达量的降低除了表明大鼠脑组织中M1极化小胶质细胞的减少,同样也提示氧化应激和炎性反应的减轻。说明阿托伐他汀的处理能缓解大鼠CIR后的氧化应激和炎性反应水平。在阿托伐他汀处理后,大鼠脑组织中eNOS的增加也表明抗炎增强,抑制过量NO释放,阿托伐他汀能在降低促炎因子释放的同时,提高抗炎反应,抑制氧化应激水平,促使小胶质细胞向M2极化的改变。邢宏义[17]在小鼠脑缺血模型上的研究表明,罗苏伐他汀通过增加eNOS的表达、抑制iNOS的表达而起到神经保护作用。IRF5作为一种干扰素调节因子,在调节小胶质细胞M1极化的过程中发挥着重要作用[18]。IRF5蛋白表达趋势与NO和iNOS表达一致。故大鼠在CIR损伤后也刺激了IRF5蛋白表达,进而促进小胶质细胞M1极化,并促进了iNOS和NO的表达,但阿托伐他汀抑制了这一过程。谷祥任等[19]在研究小鼠巨噬细胞极性时也得出普伐他汀能降低IRF5基因的表达。
综上所述,大鼠CIR后,表现出神经功能缺损评分增加、血脑屏障通透性增加、脑水肿和脑神经元坏死,而阿托伐他汀处理缓解了这些现象的发生。其机制一方面是通过抑制NF-κB信号通路活化,减少TNF-α、IL-6等促炎症因子的分泌,抑制炎性反应;另一方面,通过降低小胶质细胞M1极化调节因子IRF5表达,抑制M1极化,降低iNOS和NO的表达,并提高eNOS的表达,发挥抗炎和抗氧化作用,从而起到对神经功能的保护作用。此外,相对于脑缺血的晚期而言,在CIR的早期使用阿托伐他汀对神经功能的保护作用更明显。

