MRI-DWI对进展期食管癌新辅助化疗早期疗效评价的临床研究*
刘良忠,李小红,常世川,张 军,张 力△
(1.重庆大学附属三峡医院肿瘤内科消化病区/重庆三峡消化系肿瘤防治研究所 404000;2.重庆大学附属三峡医院护理部 404000;3.重庆大学附属三峡医院肿瘤放疗综合病区 404000)
新辅助化疗对局部进展期食管癌具有降期降级、提高R0切除率的作用[1-3],但其总体有效率仅40%左右[4-7],剩余患者可能从新辅助化疗中无获益,甚至出现肿瘤进展。目前常用于新辅助化疗疗效评估的方法包括病理退缩分级(tumor regression grade,TRG)[8-9]与基于影像的RECIST标准[10-12],前者只能用于术后,而后者不适用于空腔脏器原发病灶的疗效判断,二者在临床运用中都有一定的缺憾。核磁共振弥散加权成像(MRI-DWI)不仅能反映肿瘤体积的大小变化,还可以反映肿瘤组织内部水分子的弥散运动变化,间接体现出化疗对肿瘤细胞的损伤。因此,笔者推测通过表观弥散系数(ADC)变化可以在术前较早地预判新辅助化疗的疗效[13]。除此之外,如果ADC的变化能够体现化疗的疗效并用于临床判断,那么它也将突破RECIST标准不能用于空腔脏器疗效评价的限制。本研究探讨MRI-DWI对进展期食管癌新辅助化疗早期疗效评估。
1 资料与方法
1.1 一般资料
选取本院2018年8月至2020年3月收治的食管癌患者60例为研究对象,经胃镜获取病理活检明确诊断为食管鳞癌或腺癌,其中男38例,女22例,年龄39~68岁,平均(52.32±17.01)岁,TNM分期:Ⅱ期15例、Ⅲ期45例。 纳入标准:(1)外科评估可行手术且患者自愿进行手术;(2)无食管穿孔、活动性出血及恶病质等,可进流食或半流食;(3)至少有1个区域淋巴结转移,且短径大于1.5 cm作为靶病灶;(4)患者ECOG评分0~1分,无严重心、肺、脑、肝、肾及血液、代谢性疾病,经麻醉科评估能承担手术风险,预期生存期大于3个月;(5)患者及家属知情同意。排除标准:(1)体内有金属异物、幽闭症不能进行MRI扫描;(2)对造影剂过敏;(3)临床分期为Ⅰ期或Ⅳ期;(4)年龄大于75岁且手术风险较高;(5)病理类型不满足腺癌或鳞癌;(6)病变位于颈段或胸上段食管癌。本研究经医院医学伦理委员会审批同意。
1.2 方法
1.2.1新辅助化疗
紫杉醇135~175 mg/m2(第1天静脉滴注)、顺铂60 mg/m2(第1天静脉滴注),21 d为1个疗程;紫杉醇化疗前12 h、6 h分别口服地塞米松片10 mg预处理,用药前30 min分别给予静脉滴注法莫替丁40 mg,肌肉注射苯海拉明40 mg预防过敏,并辅以托烷司琼止吐、奥美拉唑抑酸、水化、呋塞米利尿、20%甘露醇脱水,必要时联合阿瑞匹坦、奥氮平止吐等对症支持治疗。
1.2.2手术治疗
化疗结束后3~6周,患者接受根治性食管癌切除术+区域淋巴结清扫术,术式为胸腹两切口或颈胸腹三切口食管癌切除术,具体由外科高年资医师决定,手术要求完整切除原发病灶及区域淋巴结。
1.2.3MRI-DWI检查与ADC值测定
首次化疗前与末次化疗结束后所有研究对象均行MRI-DWI检查与ADC值测定。具体参数如下:T1WI横轴位扫描,TR/TE:140 ms/2.5 ms,矩阵:256×256,层厚:6 mm,层间隔:20%;T2WI横轴位扫描,TR/TE:1 580 ms/72 ms,矩阵:384×276,层厚及层间隔同T1W1;DWI横轴位扫描,采用单次激发SE-EPI序列,TR/TE:6 800 ms/70 ms,矩阵:128×128,层厚:4 mm,无层间隔。弥散敏感梯度取b=0、800 s/mm2,MRI-DWI图像上高信号区被界定为参考肿瘤病灶范围。b值为800 s/mm2时所得到的DWI图像及ADC图用于研究。在ADC图上测量化疗前后原发病灶及区域淋巴结靶病灶的ADC值。
1.2.4影像标准疗效评价
由1名影像科医师与1名临床医师共同参照《实体瘤疗效评价标准RECIST 1.1版本》测量MRI图像上区域淋巴结靶病灶直径变化,并进行客观疗效评价。(1)完全缓解(CR):可见病灶完全消失;(2)部分缓解(PR):病灶缩小 30% 以上;(3)稳定(SD):病灶缩小不及 30% 或增大不超过 20%;(4)进展(PD):病灶增大 20%以上或出现新的病灶。根据RECIST1.1判定结果分为影像反应组(CR+PR)与影像无反应组(SD+PD)。
1.2.5病理标准疗效评价
由1名有经验的病理科医生在光学显微镜下观察术后病理标本(包括食管癌原发病灶、区域淋巴结靶病灶)并进行TRG。(1)0级:未见肿瘤细胞残余,大量纤维化;(2)1级:残余肿瘤比例为1%~10%,伴丰富纤维化;(3)2级:残余肿瘤比例为11%~50%,但纤维化仍占主要成分;(4)3级:残余肿瘤比例为51%~100%,纤维结构不完整。根据术后TRG又分为病理反应组(TRG 0、1级)与病理无反应组(TRG 2、3级)。
1.3 统计学处理
2 结 果
2.1 基本情况
60例研究对象中,2例不能耐受化疗反应仅完成1周期化疗后手术,1例因化疗药物过敏而变更化疗方案后手术,39例完成2周期化疗,18例完成3周期化疗,平均完成化疗(2.61±0.36)周期。2例因化疗后肿瘤进展、2例因主观原因拒绝手术、1例因体能下降均改为放疗,1例因消化道出血直接行手术治疗。最终有51例患者纳入研究,见表1。

表1 患者临床特征
2.2 化疗前后不同病灶部位ADC的变化
原发病灶和区域淋巴结靶病灶化疗后的ADC值均高于化疗前,差异有统计学意义(P<0.05),见表2。
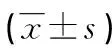
表2 不同病灶部位化疗前后ADC的变化
2.3 原发病灶与区域淋巴结靶病灶ADC差值一致性
在51例患者中观察同一患者原发病灶与区域淋巴结靶病灶化疗前后ADC差值的相关性,可以发现二者具有高度的一致性(b=0.847),见图1。
2.4 影像与病理疗效评价
影像疗效:影像反应组21例,影像无反应组30例,有效率为41.18%;病理疗效:病理反应组32例, 病理无反应组19例,有效率为62.74%。病理有效率要高于影像(P=0.047),但两种方法存在一定的一致性(Kappa=0.534,P=0.038)。

图1 典型病例原发病灶与区域淋巴结靶病灶ADC差值的一致性分析
2.5 影像或病理不同反应状态下ADC变化
原发病灶和区域淋巴结靶病灶病理反应组的ADC值均高于病理无反应组(P<0.05);影像反应组ADC值高于影像无反应组,但两组差异无统计学意义(P=0.630)。原发病灶病理反应组ADC最高,差异有统计学意义(P=0.030),见表3。
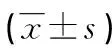
表3 影像或病理不同反应状态下的ADC变化
3 讨 论
食管癌是我国常见的恶性肿瘤之一,据全国肿瘤登记中心公布的《2015年中国肿瘤登记年报》显示[14-16]:我国食管癌新发病例约477 900例,死亡约375 000例,其发病率居我国所有恶性肿瘤第6位,致死率居第4位,严重威胁生命健康。由于早期症状不典型,多数患者就诊时已处于疾病的进展期或晚期。有研究显示[1-2,5-6],局部进展期食管癌行术前化疗或同步放化疗可缩小肿瘤,达到降期降级的目的,从而提高肿瘤的切除率与远期生存率,尤其是病理类型为鳞癌者,其生存获益更大[6,17]。
目前食管癌常用的化疗方案主要由氟尿嘧啶、铂类、紫杉醇类为主的药物组成,总体有效率18%~64%[4],因此,如何早期判断新辅助化疗的疗效,具有重要的临床价值及意义。
新辅助化疗的疗效评价主要有两级标准[9,11]:即病理标准与影像学标准,前者是基于手术后病理标本所观察的镜下肿瘤组织退缩改变,也是判断术前新辅助化疗疗效的金标准[9],但这一标准最大的缺陷是只能用于术后,不具有早期预测疗效与指导后期治疗的价值[8]。后者是基于影像学,包括CT、MRI等提出的根据肿瘤大小变化的实体瘤疗效评价标准RECIST[11],也是目前临床应用最为广泛的疗效判断方式,但该标准通常不能作为空腔脏器原发病灶的疗效判断,而胃肠等消化道肿瘤化疗只能选择可测量直径的区域淋巴结或远处转移病灶作为靶病灶进行疗效评价[8,12],因此限制了RECIST在新辅助化疗疗效评价的应用。除此之外,两种评价体系得出的结果也存在较大差异。本研究发现:新辅助化疗后术后病理可见肿瘤缓解,但影像学退缩不明显,提示肿瘤直径的变化不足以体现化疗的敏感性,新辅助化疗后的影像再评估可能存在过度分期。经过放化疗后,肿瘤组织的形态学变化往往发生时间较晚,常规的影像学检查不能及时反映肿瘤组织在化疗后发生的功能代谢方面的变化,以及肿瘤细胞杀灭情况。所以单纯的形态学影像检查很难准确地评价食管癌新辅助化疗的早期疗效。这似乎也能说明影像与病理评价不一致的原因。
MRI-DWI是一种较新的磁共振功能成像技术,可以测量人体内部水分子的弥散运动。能够提供肿瘤细胞膜完整性、肿瘤细胞密度的组织病理学信息,对肿瘤组织在治疗过程中或者治疗后微观环境的变化较敏感[13,18]。MRI-DWI技术可提供定量指标ADC值,该指标可在 ADC图上直接测得,可较为直观、量化地显示出肿瘤相关信息[19]。有研究显示,食管癌同步放化疗后ADC值明显升高,其差值可较早预测食管癌放疗敏感性及远期疗效[13,18,20]。而本研究也发现,原发病灶与区域淋巴结靶病灶化疗后ADC值要明显高于化疗前,并且同一患者原发病灶与区域淋巴结靶病灶ADC值变化的一致性较高。此外,本研究还观察到,无论以病理或影像标准为分组依据,有反应组的ADC值均大于无反应组,这提示采用原发病灶或区域淋巴结靶病灶的ADC值的变化可以较早地预判抗肿瘤治疗的疗效。
综上所述,化疗可影响食管癌ADC值,通过检测ADC值的变化能较早地对近期疗效进行预测。

