关于国外伦理委员会管理制度研究
李长青,张彦彦,姚佩颖,肖瑶,王雪云,高语晨,杨建红*
(1.精鼎医药研究开发有限公司,上海200120;2.沈阳药科大学亦弘商学院,北京100055;3.缔脉生物医药科技(上海)有限公司,上海201210)
2020年7月1日,我国新版《药物临床试验质量管理规范》(Good Clinical Practice,GCP)正式实施[1]。新版GCP总则规定,药物临床试验应当符合《世界医学大会赫尔辛基宣言》原则及相关伦理要求,受试者的权益和安全是考虑的首要因素,优先于对科学和社会的获益[1]。但不同于以个体性治疗为基本方法的临床治疗,临床药物试验需要按照严格的科学设计方案来进行,同时,为保证研究的科学性和有效性,减少人为偏倚,研究还应采用随机、对照(甚至安慰剂对照)、盲法等方法,严格限制剂量的变化和伴随药物的使用,其主要是为了确保试验药物的疗效与安全性。随机对照试验(Randomized Controlled Trial,RCT)胜过临床判断、病例报告和观察研究,并已成为医学界的黄金证据标准。此外, RCT成为监管过程的关键部分,新疗法借此进入药物市场。随机和盲法会与受试者的个人利益发生冲突。发生这种冲突的原因是,当进行随机化和盲法试验时,患者无法享受针对其病情的个性化治疗决策。
随着创新药物临床试验和循证医学研究的不断发展,伦理委员会作为受试者权益监管的主体部门,在保障受试者的权益和安全上发挥着至关重要的作用。从各国的监管经验来看,伦理委员会在临床试验管理中发挥着重要的作用。伦理不分国界,对受试者的关爱和保护也不分国界。
近年来,我国的伦理委员会发展迅速,但同时也存在较多问题。欧盟、英国和美国等国家和地区的伦理委员会制度相对中国来说,较为完善,在伦理委员会的科学发展、专业化建设方面有值得我们借鉴的经验。本文分析了欧盟、英国和美国的伦理委员会管理制度、伦理审查原则和审查效率,旨在为进一步完善我国的伦理委员会管理制度提供参考。
1 伦理委员会管理制度简介
1.1 美国伦理委员会管理制度
美国伦理审查的法律源于美国《联邦法规》第21章第56部分(21CFR56)——伦理机构审查 委 员 会 (Institutional Review Board,IRB)、21CFR50——保护人体受试者和21CFR312——新药研究申请[2],依据以上3部法律,美国的伦理委员会体系是非政府并由分散的临床研究IRB组成。根据美国FDA规定,IRB是已被正式指定用于审查和监测涉及人类受试者的生物医药研究的组织,该组织有批准、要求修改(已获得批准)和不批准研究的权力。IRB通过事先和定期审查知情同意文件和研究者手册等研究资料确保研究步骤的适当性,以保护作为研究对象的人类的权益。
IRB在大学,医院,私人、非营利或营利性组织中建立,主要由美国卫生与公共服务部(Department of Health and Human Services,DHHS)下属的2个机构负责监管,即美国FDA和人类研究保护办公室(Office of Human Research Protection,OHRP)。OHRP主要通过对伦理委员会的注册以及承诺书制度进行监管,FDA主要通过行政手段以及核查的方式对伦理委员会的具体运行进行监管[3]。此外,根据联邦政府的《通用规则》、《经修订的通用规则》以及国际人用药品注册技术协调会(ICH)制定的《临床试验质量管理规范》(也称ICH-E6),IRB必须建立并遵循相关的标准操作程序(Standard Operating Procedure,SOP)。美国临床试验的伦理审评是非集中的,申办者必须取得针对每项研究的所在研究机构或者中心伦理审查批准[4]。
1.2 欧盟伦理委员会管理制度
欧盟独立伦理委员会(Independent Ethics Committee,IEC)[5]是负责监督欧盟成员国的医学或人体研究的独立机构,负责确保医学实验和人体研究按照国家和国际法以合乎道德的方式进行研究。
IEC是由医学/科学专业人员和非医学/非科学成员组成的独立机构,其职责是确保参与生物医学研究的人类受试者的权利得到保护,并负责审查、批准、跟踪审查研究方案、获得和记录研究对象知情同意所用的方法和材料。
随着相关临床试验指令的出台,欧盟设想在欧洲范围内统一设立研究伦理委员会(Research Ethics Committee,REC),该伦理委员会职责包括评估试验提案所需的时间和委员会应该考虑的其他问题。
IEC包括:英国的 REC、荷兰的医学研究伦理委员会、瑞典道德审查委员会、法国的个人保护委员会。本文将以瑞典的道德审查委员会为例进行具体阐述。2004年1月1日瑞典修订了《涉及人的研究伦理审查法案》。在配合新法律的同时,瑞典设立了1个中央伦理审查委员会并根据地理区域建立6个区域审查伦理委员会。6个区域伦理审查委员会均设立在各个地区的大学内,如哥德堡大学、林雪平大学、瑞典隆德大学、斯德哥尔摩的卡罗林斯卡学院、瑞典于默奥大学和乌普萨拉大学。2019年1月1日,6个区域委员会合并为1个机构即瑞典伦理审查机构,总部位于乌普萨拉。中央伦理审查委员会已改名为伦理审查上诉委员会。
1.3 英国伦理委员会管理制度
英国伦理委员会管理制度由英国统一建立和监管,从法律法规到具体操作规程,从各级监管部门职能设置到各部门间的协调,都有明确细致的划分。
2004年的《人体医学临床试验法规》中提出“英国伦理委员会管理机构”的建立,并要求其负责建立、监管英国的伦理委员会,为落实法规以及保障和支持在英国国家健康服务体系(National Health Service,NHS)中开展的研究项目的伦理审查,包括地方政府的卫生和社会护理部门以及这些授权机构认可或建立的伦理委员会[6]。2007 年 4月,英国国家伦理委员服务体系(National Research Ethics Service,NRES)成立,将英国的研究伦理委员会中央办公室(Central Office for Research Ethics Committee,COREC)和英格兰NHS的REC合并在一起,对英国范围内 NHS研究伦理审查进行监管。
2011年英国设立了健康研究管理机构(Healthy Research Authority,HRA),研究伦理服务(Research Ethics Service,RES)的这一体系的职能通过HRA机构执行。
HRA的主要职能包括:与健康和社会保健研究相关的监管实践的协调和标准化的职能、与REC有关的职能、作为英国伦理委员会管理局成员的职能、与患者保密信息处理的批准有关的职能。HRA的核心职能之一就是提供研究伦理服务,通过REC对NHS内的研究项目进行伦理审查,英国有80多个NHS研究伦理委员会,他们的存在是为了保障研究参与者的权利、安全、尊严和福祉。
对于不在NHS体系内研究项目的伦理审查,可以通过英国国防部研究伦理委员会(The Ministry of Defence Research Ethics Committee,MoDREC) 或者英国高等教育机构研究伦理委员会途径进行审查。
2 国外伦理委员会的构成
伦理委员会的构成要求是保障伦理审查能力以及伦理审查独立性的重要手段。各国对伦理委员会构成成员的资质以及构成组合等,均有不同的要求。
美国在21CFR 第56部分第107条对伦理委员会的构成作了以下规定:1)伦理委员会必须至少由5名具有不同背景的成员构成,目的是能够对机构的研究活动进行完整且充分的审评。IRB的资质需要考虑成员的经验和专业技能以及背景的多样化,包括种族、性别、文化背景、对社区态度等问题的敏感性等。除了具备审查特定研究活动所需的专业能力外,IRB 还应当能够基于研究机构的承诺和制度、相关法律法规及专业行为规范标准确定拟开展研究的可接受程度。因此,IRB成员应当也包括在该领域擅长的成员。如果IRB的定期审查涉及特殊人群,如儿童、囚犯、孕妇、生理或心理残障人士,则需要考虑纳入1个或多个在该领域较为专长且有经验的人员。2)IRB的工作必须避免歧视状况的发生,成员不能全部由男性或女性构成,或由同一机构的2种性别的成员构成,也不能由同一职业的人员构成。3)每个伦理委员会至少应包括1名与该机构无关的成员,且该成员不构成与该机构有关人员的直系亲属关系。4)除提供伦理委员会要求的信息外,伦理委员会不得让成员参与和其有利益冲突的任何项目的初始或持续审查。5)IRB 可自行决定邀请在特殊领域有专长的个人协助审查复杂问题,这些问题所需的能力超出了 IRB 现有专业知识。 这些人员不得参与IRB 的投票活动[7]。美国要求伦理委员会必须由至少5名具有不同背景的成员来完成伦理审评。成员必须具备审评研究活动的专业能力并能够根据机构任务和规定、法律和标准判断研究的可接受性。最低限度,每个伦理委员会必须包括如下成员:1名主要关注科学事务的成员、1名主要关注非科学事务的成员以及1名与机构无关联的人士[7]。
由英国卫生部门认可的伦理委员会成员最多不超过18人,参会人数不少于7人。成员须具备审查临床试验科学、医学和伦理方面所需的资格和经验。成员的构成考虑年龄、残疾、性别、婚姻和民事伴侣关系、怀孕和生育、种族、宗教或信仰、性别和性取向,非专业人员至少占1/3[8]。在成员的委任上,应当遵循公开透明的程序。委员会成员的每期任职有效期最长为5年,任职结束可以续期,成员通常不应在同一伦理委员会连续服务超过2个连续5年,并且成员可以随时辞职。成员必须对所有与伦理审查相关的事项保密,并拒绝任何与自身有利益冲突的项目。
瑞典的伦理审查上诉委员会由1名主席和6名成员组成。其中,2名成员代表公共利益,其他成员是具有科学能力的成员。瑞典伦理审查机构分为6个业务区域,在每个业务区域,至少有1个医疗部门和1个审查其他研究的部门。该机构共有18个部门。每个部门由10名具有科学背景的代表和5名来自公众的代表组成。部门主席必须是现任或曾任法官。
3 国外伦理委员会的法律法规梳理
美国、欧盟和英国等国家和地区纷纷制定了一系列的法律法规以规范各国及地区的伦理委员会管理制度。本文对美国、欧盟和英国等国家和地区的伦理委员会法律法规进行梳理,以期为完善我国的伦理委员会管理制度提供参考。
3.1 美国伦理委员会的法律法规梳理
美国在历史上进行过几项不符合伦理的研究,最终导致了有关保护人类受试者的政策和法规的出台(见表1),以立法的形式确立了IRB的地位。美国先后于1974年和1981年颁布了联邦法律45CFR46和21CFR56,之后历经多次修改成为美国监管IRB 工作的主要依据。

表1 美国伦理委员会法律法规梳理[9-10]Table 1 Laws and regulations for Ethics Committees in the USA
3.2 欧盟伦理委员会的法律法规梳理
2001年,欧盟人用药品临床试验指令2001/20/EC的颁布,意味着欧盟开始对临床试验的开展进行统一,其中也对伦理委员会的监督审查职能进行了规定。2014年4月16日人用药品临床试验法规Reg.(EU)No 536/2014取代2001/20/EC指令,监管欧盟临床试验法律。Reg.(EU)No 536/2014 更强调通过对受试者持续关注与保护,将科学与伦理紧密相连,保障受试者权益(见表2)。

表2 欧盟伦理委员会法律法规梳理Table 2 Laws and regulations for Ethics Committees in the European Union
3.3 英国伦理委员会的法律法规梳理
为规范英国的伦理委员会管理制度,真正做到有法可依、有章可循,英国制定了一系列具有权威性且内容完备的法规文件(见表3)。
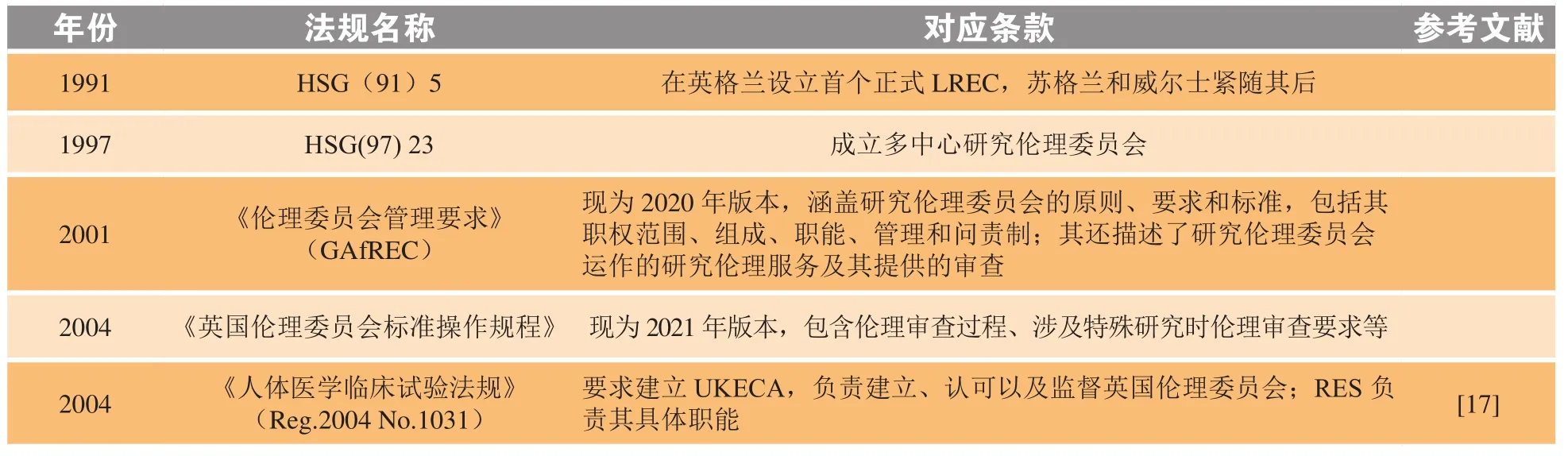
表3 英国伦理委员会法律法规梳理Table 3 Laws and regulations for Ethics Committees in the United Kingdom
4 国外伦理审查的原则
伦理审查的原则是在开展伦理审查具体工作过程中需要贯穿始终的基本原则,是实现伦理审查保护受试者目的的具体体现,也是保障伦理审查质量的重要方式。
世界卫生组织(World Health Organization,WHO)、ICH、国际医学科学组织理事会(The Council for International Organizations of Medical Sciences,CIOMS)均设立了开展人体研究的伦理原则。各国根据情况,为规范和提高伦理审查质量,也分别规定了伦理审查的原则。
美国《联邦法规》在第45主题的第46章第1部分确定了有关保护人体试验受试者的基本原则[18]。美国伦理审查的基本原则包括3项: 1)对人尊重,认识到每个人都享有自主权并有权获得尊重,因此当研究者邀请相关人员参与研究时,必须详实告知其研究的相关资讯,并尊重其自主选择获得自愿参与同意书,以示尊重; 2)善意福祉,为促使相关研究者致力于高品质的研究,以确保研究对象的权益并提升其福祉,要求研究者必须尽到保护每位受试者的责任,研究的执行应该是让受试者受益,扩大可预见的利益,并将可能的伤害降到最低; 3)公平正义,要求研究者必须公平对待所有的受试者,同时也确保所有同意参与研究的受试者,均能受到公平一致的善意对待。特别是对待孕妇、囚犯、儿童等弱势群体更应当关注公平正义原则。
欧盟临床试验法规[Reg.(EU)No 536/2014]确定的人体研究基本原则:保护试验参与者的权利和安全、确保数据的可靠性和稳健性以及在研究中遵守GCP。
英国在由经济与社会研究理事会(Economic and Social Research Council,ESRC)颁布的《研究伦理架构》(Framework for Research Ethics,FRE)中强调了6项伦理审查的原则,包括:1)受试者应自愿参加,不受任何胁迫或不当影响,其权利、尊严和独立应受到尊重并得到适当保护;2)研究应该是值得的,并提供超过任何风险或危害的价值。研究人员应致力于最大程度地提高研究收益和降低对受试者及研究人员造成伤害的潜在风险,应通过强有力的预防措施减轻所有潜在的风险和伤害;3)应向研究人员和受试者提供有关研究目的、方法和预期用途,参与的研究内容以及所涉及的风险和利益等信息;4)应尊重受试者个人和群组的匿名需求,并应遵守受试者关于试验数据和个人信息的保密要求;5)研究在设计/审查和执行等过程中应确保符合公认的诚信标准,并确保质量和透明度;6)研究的独立性应明确,任何利益冲突或偏见均应明确。
5 伦理审查效率
从各国伦理委员会的建立和发展来看,提高审查效率越来越成为伦理委员会需要实现的目标之一。
5.1 伦理审查模式
美国IRB有3种,分别是中心IRB、商业IRB和当地IRB。大多数研究方案提交给当地IRB进行审批。一些多中心的临床试验可以提交给中心IRB进行审查。中心IRB,如美国国家癌症研究机构中心IRB和美国家庭医生学会国家研究网络IRB,可以作为多中心临床试验机构的唯一IRB。使用中心IRB可以提高多中心临床试验伦理审查的质量和效率。美国FDA和OHRP鼓励多中心临床试验使用中心IRB。商业IRB属于中立性质,不隶属于任何研究机构。商业化IRB减轻了因研究方案数量和复杂性日益增加而产生的负担[19]。
英国在1991年就设立了首个正式的LREC,1997年发布指导原则规定在英国NHS中成立“多中心研究伦理委员会(multi-centre research ethics committees,MREC)”。具有4个试验机构以上的多中心临床试验需将审查资料递交MREC进行伦理审查。MREC通过审查后回复试验方案主要研究者(principal investigator,PI),PI继而向各LREC提出审查申请。在责任分担方面,MREC应确保国际多中心药物临床试验(multi-regional clinical trial,MRCT)方案的科学性及伦理性,LREC考虑当地研究人员的匹配性、当地研究环境和设施的批准以及具体的与当地社区有关的问题,二者无从属关系。MREC/LREC模式形成英国特有的审查机制[20],用以简化多中心研究的审批流程。
以欧盟成员国——瑞典为例介绍伦理审查模式。瑞典实行的是独立审查模式。申请人需要向伦理审查机构递交审查申请资料,如果是临床药物试验,还必须同时向医疗产品管理局提出申请。通常,伦理审查机构应在收到完整的申请和费用后60 d内做出决定。如果伦理审查机构做出了不利于研究负责人的决定,研究负责人可以向伦理审查上诉委员会提出申诉。申诉必须向伦理审查上诉委员会提出,但必须提交给伦理审查机构,由该机构检查申诉是否及时收到。然后,伦理审查机构将上诉和所有附属文件发送到伦理审查上诉委员会。伦理审查上诉委员会除审查有异议的申诉的临床试验项目外,还审查由于伦理审查机构对伦理审查的结果没有达成一致意见的项目。瑞典的这种审查模式类似美国的独立审查模式。
5.2 伦理机构审查委员会审查和临床试验申请审查
美国 IRB和临床试验申请(investigational new drug, IND)审查无明确先后关系。IRB审查和IND的 30 d审查是2项单独的审查项目。临床试验必须在2项审查均完成时才能开始。IRB首次审查完成,但美国FDA对IND 30 d审查没有结束时,试验也不能启动。IND审查结束,IRB审查没完成时,试验也不能启动。IRB审查资料要求申请人提供IND编号。在FDA 对IND 30 d审查期间,若FDA要求变更试验方案,则试验即使在IRB初次审查通过有效的情况下,也不能开展试验直到问题被解决,且试验变更内容也要提交IRB审查。在FDA和IRB同时批准变更的情况下才能开展试验。
欧盟临床试验法规[Reg.(EU)No 536/2014]取代了欧盟临床试验指令(Dir. 2001/20/EC)。新法规的一个重大变化是规定临床试验申请(clinical trial application,CTA)须同时提交科学和伦理申请资料包。CTA的申请资料统一要求为2部分:第1部分是临床试验的科学性、技术性资料,包括如医药产品的制造和标签,临床试验方法等,其总体目标是评估对研究对象的治疗获益和风险;第2部分是相关的伦理审查问题,如知情同意和招聘研究对象、奖励或补偿研究对象、数据保护、调查人员和审查地点的适用性以及损害赔偿。第1部分科学性审查将由欧洲药品管理局(European Medicines Agency,EMA)评估;第2部分的伦理审查根据有关会员国的法律进行。而目前欧盟各成员国伦理审查的情况各不相同,在一些国家,如希腊,伦理委员会只负责评估的第2部分(伦理申请资料),而第1部分(科学评估)根据欧盟临床试验法规第6条由其他主管机构进行评估。在其他国家,如德国,伦理委员会评估包括科学质量、合规性在内的全面评估和伦理审查。
随着英国退欧过渡期于2020年12月31日结束,《人体医学临床试验法规》的现行版本为《2019年人类使用药品(临床试验)(修正)(欧盟退出)条例》。在英国进行的试验用药品(CTIMP)临床试验受《人用药品(临床试验)法规》(2004修订版)的监管。在第17条“申请进行临床试验的授权”的规定中,要求如果有与该试验相关的伦理委员会意见副本,则需同时提交[18]。
药品和医疗保健产品监管局(Medicines and Healthcare Products Regulatory Agency,MHRA)是负责英国临床试验审批、监督和检查的监管机构。临床试验申请以电子方式提交给MHRA综合研究应用系统(integrated research approval system,IRAS)。MHRA规定伦理委员会审查意见可以在电子提交之前、期间或之后获得[21]。
2010年,英国推出了比例审查服务(The Proportionate Review Service ,PRS),对于不存在重大伦理问题的研究,比例审查服务可以提供快速的审查,研究可以通过电子邮件通信、电话会议或由小组委员会举行的面谈会议进行审查,而不需在REC的全体会议上进行。
6 结语
药物临床试验是药品研发的关键性制约环节。各国监管机构基于以下4个关键因素来确定是否可以接受临床研究数据:1)是否符合临床研究的伦理标准;2)是否符合数据完整性标准;3)是否适用于当地医疗实践;4)是否惠及当地患者。近年来,我国的伦理委员会建设工作虽然也在不断的完善和规范中,但还存在着伦理审查的原则不够明晰、伦理审查标准需要进一步细化、伦理审查模式单一、伦理审查能力参差不齐、伦理审查效率低下等问题。随着大数据时代的到来以及中国创新药的蓬勃发展,我国创新药临床试验数量不断增加,如何提高临床试验伦理审查的质量和效率备受各方关注。国外在伦理审查质量和审查效率方面的成功经验,一方面为完善我国的伦理委员会管理制度提供借鉴,另一方面使中国的临床数据更好与国际接轨,与国际同步。
致谢:本文来自亦弘商学院组织开展的“我国伦理委员会管理制度研究”课题。感谢研究期间课题支持单位及业界专家同仁给予的大力支持。

