脂肪来源基质血管组分治疗骨关节炎的临床研究进展
唐琪,赵贤省,金亮
(中国药科大学生命科学与技术学院,江苏 南京 211198)
骨关节炎(osteoarthritis,OA)是一种好发于中老年人的慢性关节疾病,其风险因素包括年龄增长、遗传易感、肥胖、高骨密度(BMD)、关节过度使用及损伤等[1]。OA的特征是关节软骨和软骨下骨退化,临床主要表现为关节肿痛、僵硬和活动受限等,是致残的重要原因之一。不仅给患者造成巨大痛苦,也带来了巨大的经济负担。
1 骨关节炎
1.1 流行病学研究
2018年11月,《柳叶刀》杂志公布了2017年全球疾病负担研究的数据,Safiri等[2]对OA部分进行了系统分析,结果表明2017年全球OA年龄标准化患病率、年发病率、健康寿命损失年(YLD)比率分别约为每10万人中3 754.2人[95%不确定性区间(uncertainty interval,UI):3 389.4 ~ 4 187.6]、181.2人(95%UI:162.6 ~ 202.4)、118.8人(95%UI:59.5 ~ 236.2);1990—2017年,年龄标准化患病率、年发病率、YLD比率分别增长9.3%(95%UI:8% ~10.7%)、8.2%(95%UI:7.1% ~ 9.4%)以及9.6%(95%UI:8.3% ~ 11.1%);对于不同性别而言,女性OA发病率较男性高;此外OA患病率和发病率均随着年龄的增加而增加,其中发病率在60 ~ 64岁达到峰值。
1990—2017年由于我国人口老龄化和寿命延长,肌肉骨骼疾病已经成为导致成年人伤残的主要原因之一[3],其中,膝骨关节炎是重要的致残原因之一。2016年调查结果显示,我国8.1%的人群患有症状性膝骨关节炎,其中女性症状性膝骨关节炎的患病率(10.3%)高于男性(5.7%)[4]。
除年龄外,肥胖也是OA重要的风险因素之一。肥胖会增加负重关节的负荷,同时脂肪细胞可通过分泌炎性脂肪因子,如肿瘤坏死因子-α(tumor necrosis factor,TNF-α),白细胞介素-1(interleukin-1,IL-1)以及IL-6等诱导基质金属蛋白酶(matrix metalloproteinase,MMPs)、前列腺素等产生,并抑制蛋白聚糖和Ⅱ型胶原的合成[5],从而影响软骨的功能。研究表明身体质量指数(body mass index,BMI)超过 30 kg · m-2的肥胖患者可能更需要全膝关节置换术,术后产生并发症的比率也较高[6]。
30% ~ 65%的OA风险与基因遗传相关,目前全基因组关联扫描(genome-wide association study,GWAS)研究已经确定了21个独立的OA易感基因座[7]。关节软骨损伤、前交叉韧带断裂、半月板撕裂等可大大增加患OA的风险。研究发现膝关节受伤人群发生OA的可能性比未损伤的人群高4倍[8]。此外,低维生素D饮食[9]、过度使用关节[10]也可能增加OA的风险。研究表明高骨密度(bone mineral density,BMD)会增加膝骨关节炎发生和关节间隙缩小的风险,但不会增加现有膝骨关节炎的影像学进展[11]。
1.2 发病机制研究
以往OA被认为是一种退行性关节疾病,但越来越多的研究表明,软骨、软骨下骨和滑膜等都有不同程度的炎症反应。因此,OA是关节软骨分解代谢和合成代谢过程失衡,软骨、骨和滑膜产生低度炎症,并发展为继发性修复代偿性改变,最终导致关节功能障碍的全关节疾病[12]。OA的发病进程主要包括软骨的破坏、软骨下骨的重塑、骨赘的形成以及关节囊的增厚,过程可历时数年。在OA中的炎症是低度的、慢性的,先天性与适应性免疫系统均被激活的,以先天免疫系统为主,这些使得OA有别于类风湿性关节炎[13]。
正常情况下,关节软骨由水、软骨细胞和细胞外基质组成。细胞外基质由软骨细胞合成分泌,包含胶原蛋白(主要为Ⅱ型胶原蛋白)、蛋白多糖、透明质酸以及小分子糖蛋白等。Ⅱ型胶原蛋白与其他细胞外基质可形成网状结构,从而为关节软骨提供抗压性[14]。发生OA时,软骨细胞会产生多种炎症细胞因子以及趋化因子,例如IL-1β、TNF-α、IL-6等;同时软骨细胞会产生MMPs和带有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin like motifs,ADAMTS),其中前者的作用靶点是Ⅱ型胶原蛋白,后者的作用靶点是蛋白聚糖,从而最终导致软骨分解代谢增加、合成代谢及修复减少,值得注意的是,成骨细胞、滑膜细胞以及浸润关节中的单核细胞均可产生 IL-1β、TNF-α、MMPs等[15]。考虑到关节软骨无血液供应和神经支配,在发生OA时,关节中的各个组织包括软骨、滑膜、软骨下骨等产生炎症的具体顺序是什么,其中的反馈机制如何,都值得仔细探究,因为对于早期OA的预防和阻断比修复和治疗晚期OA更有意义。
软骨下骨位于关节软骨钙化层以下,具有血管和神经的分布,并提供关节软骨的机械支撑。在OA早期,破骨细胞可介导软骨下骨发生重塑,随着OA的进展,通过磁共振成像(magnetic resonance imaging,MRI)可以观察到不同程度的软骨下骨硬化,出现骨赘和软骨下骨囊肿[16-17],这可能降低了软骨下骨对关节软骨的机械支撑,从而使得关节软骨易损伤。滑膜炎是OA常见的并发症之一,在OA进展过程中,滑膜可出现明显的增生,同时滑膜细胞也可分泌促炎因子和MMP等参与到OA的形成[18]。越来越多的证据表明,除了关节局部的炎症机制,肥胖也可使人体长期处于低度炎症环境中,肥胖人群患OA的风险明显高于正常人群[6]。
1.3 诊断和治疗研究
影像学检查是诊断OA必不可少的方式之一,主要包括X射线、计算机断层扫描(computed tomography,CT)、MRI、超声检查和关节镜检查等。X射线检查是临床诊断OA的首选方法之一,其能检测出关节间隙狭窄、骨赘、软骨下骨硬化囊肿等关键OA特征,但是其只能通过显示关节间隙和骨的改变间接判断软骨的受损情况,不能作为OA诊断的唯一标准,也不适用于早期OA的诊断[19]。X射线检查相关的评价标准是:Kellgren-Lawrence(K-L)分级[20]。CT检查可以显示关节软骨下骨的细微骨质变化,对关节周围骨赘脱落形成的游离体,也能清楚显示出其不同层面上的图像,因此对于骨赘和软骨下囊肿的检测更为敏感[21]。MRI的组织分辨率较高,可以提供关于软骨大小和结构完整性的信息,可直接显示关节软骨的损伤和厚度的改变,此外MRI也可以提供半月板和前交叉韧带损伤等OA的诱发因素,适用于OA的早期诊断,对于MRI检查的评价标准有Recht和Outbridge分级等[22]。超声检查可以评估关节渗出和炎症情况,但是对较深关节的诊断不如MRI[23]。关节镜检查是在患者麻醉后,在皮肤做一微小切口,以关节镜深入关节腔,外接显示设备,直接对关节软骨和半月板等组织进行观察,确定滑膜炎的位置,且可以通过连接的刨削系统进行关节清理术,去除游离体、切除撕裂的半月板、修整骨面等,该法可兼顾诊疗,同时也是对关节受损评估的“金标准”[24]。
临床上,一旦出现OA影像学特征,往往意味着已发生不可逆的软骨损伤,生物标志物可作为OA早期诊断及病情预测的指标,OA的生物标志物主要包含关节代谢相关细胞因子、细胞外基质成分以及炎症因子等,可在血液、尿液和关节液中检测得到,其中软骨寡聚基质蛋白、透明质酸、蛋白多糖、基质金属蛋白酶、Ⅱ型胶原羧基端肽(C-telopeptide of type II collagen,CTX-II)、IL-6以及乳酸脱氢酶(lactate dehydrogenase,LDH)等是目前常用指标[25]。虽然生物标志物可作为OA早期诊断依据,但是其灵敏性和特异性均较差[26]。以上几种方式各有利弊,因此需要不同方式结合起来,为OA的诊断提供全面可靠的信息,为制定OA的治疗方案提供科学的参考依据。
目前尚无完全治愈OA的方法,对于早期OA,治疗的重点是减轻症状:减少疼痛和僵硬;而对于晚期OA,治疗重点则在于维持身体机能。OA治疗方法可大致分为改变生活方式、物理治疗、药物治疗、关节内治疗和外科手术。国际软骨再生与关节保护协会(International Cartilage Regeneration&Joint Preservation Society,ICRS)提出,运动是治疗OA最有效的方法。运动可以减轻关节疼痛和僵硬,同时对心脏功能也有益。此外,减肥也是改善OA重要方法之一。物理疗法包括电疗、热疗和针灸等,药物治疗所用的药物包括镇痛、抗炎和软骨保护类药物,然而此疗法也只能缓解症状、减轻疼痛以及抑制炎症发展过程,无法阻止OA的发展。关节腔注射疗法是临床上常用的侵入性治疗方法,注射药物主要有糖皮质激素、透明质酸钠、富血小板血浆(platelet-rich plasma,PRP)、骨形态发生蛋白7(bone morphogenetic protein 7,BMP-7)和干细胞等。关节镜下清理术、微骨折、异体/自体软骨移植以及人工关节置换术是治疗OA主流手术,但手术是有创的且伴随一定的风险,因此手术只适用于关节已有严重退行性改变、关节间隙变窄或消失、严重影响日常生活质量的患者,并不适用于早期OA的治疗[27]。
2 脂肪来源基质血管组分
脂肪来源基质血管组分(SVF)是脂肪组织经胶原酶消化、离心、洗涤、过滤除去成熟脂肪细胞所得到的一种多细胞组分。临床上,脂肪组织可以由腹部、腹股沟、前臂和臀部等部位经抽脂术获得,目前SVF提取的方法主要有酶消化法、机械分离法,其中,酶消化法所获细胞产量高于机械法,因而更受到研究者们的青睐[28-30],但酶消化法的最终产物中可能残留未完全洗涤干净的外源胶原酶,因此在使用中受到严格的监管标准。通过细胞标志物如分化抗原(cluster of differentiation,CD)可以对SVF的细胞成分进行鉴别,Bourin等[31]在国际脂肪联合会(International Federation for Adipose Therapeutics and Science,IFATS)和国际细胞治疗协会(International Society for Cellular Therapy,ISCT)的联合声明中指出,SVF细胞群中含有间充质干细胞(adipose-derived stem cells,ADSC)、造血干(祖)细胞、淋巴细胞,单核细胞(巨噬细胞)、内皮细胞和周细胞等,并建议以CD45-/CD235a-/CD31-/CD34+作为鉴定SVF细胞的标志物组合。ADSC是SVF中较为重要的细胞之一,占SVF细胞群1% ~ 10%[32],ADSC赋予了SVF干性特征,其他的细胞在分泌活性细胞因子、调节机体免疫方面也具有一定积极作用。SVF在组织再生、血管重建和抗炎等方面均显示出优异的治疗价值,使其在临床中得到广泛的应用。在临床研究数据库(www.ClinicalTrials.gov)中以“基质血管组分”为关键词进行搜索,除去已被撤回的研究外,可得到SVF治疗相关的临床试验研究的现状(见表1)。

表1 脂肪来源基质血管组分临床试验现状Table 1 Current status of SVF clinical trials
3 SVF治疗OA的临床研究概述
临床上对于OA的药物治疗通常治标不治本,仅能减轻疼痛和部分症状,无法修复或抑制软骨和其他关节组织的损伤,因此不能从根本上解决软骨退变的问题,也不能阻断早期OA的发展。目前可修复软骨损伤的治疗方法包括手术治疗中的微骨折、异体/自体软骨细胞移植和关节腔注射疗法中的干细胞治疗等,以上手术治疗技术对OA的长期治疗效果有限[33],且手术治疗作为中晚期OA患者的治疗方式,存在很多弊端和风险,因此干细胞疗法获得了更多的关注和使用。ADSC来源于中胚层,可分化为脂肪细胞、成骨细胞、软骨细胞等多种中胚层细胞[34],这种分化潜能使其成为治疗OA的选择。脐带、骨髓、脂肪等都有ADSC,与其他来源组织相比,脂肪组织含量丰富,获取简单(通过抽脂手术即可获取),干细胞含量较高[35],此外脂肪组织来源的细胞具有更高的遗传稳定性、增殖和分化能力、更低的衰老率以及更长的端粒长度[36],因此脂肪来源ADSC是治疗OA的最佳选择。ADSC可由SVF经体外培养贴壁后扩增获得,但由于繁琐的体外扩增步骤,给ADSC的应用带来了一定的污染风险和时间经济成本,因此研究者们的眼光逐渐转移到不需培养的SVF上,SVF中丰富的细胞成分不仅可以分化为软骨细胞帮助组织修复,还可以分泌活性细胞因子、调节机体免疫发挥抗炎作用等,因此更受到临床研究者们的青睐。
本文在数据库PubMed、Web of Science、Cochrane Library以及Google Scholar中以“stromal vascular fraction”和“osteoarthritis”为关键词进行检索,去除重复以及非英文撰写的文献,以于2016—2020年发表的SVF治疗OA的临床试验研究为筛选条件,最终得到24篇文献,现总结如下(见表2)。
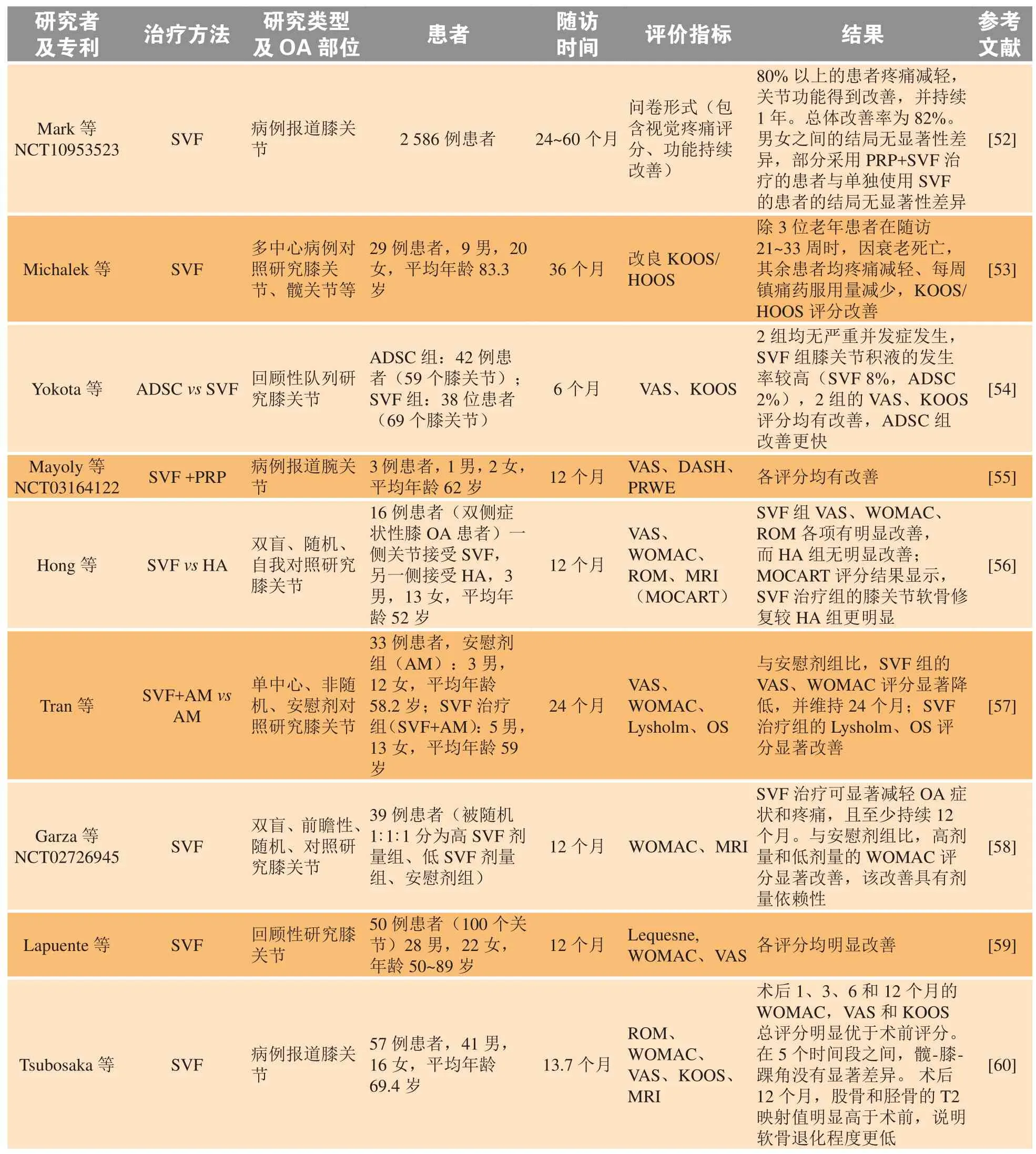
续表2
Yokota等[54]将80例患者根据生理特征和临床表现平衡分为2组(ADSC组,42位患者:关节内注射培养后的1.275h107个ADSC;SVF组,38例患者:关节内注射未经培养的5 mL SVF制剂),并回顾性地比较了2组膝骨关节炎患者经治疗后的临床结果,结果表明2组患者均未发生严重不良事件,且2组的KOOS、VAS评分都出现了明显的改善,ADSC组的改善出现得更早,改善幅度也更大,但在随访6个月后,2组各评分的差异没有显著性。研究者对ADSC组的患者抽取了20 mL脂肪,最终培养获得了1.275h107个ADSC ;SVF组(双膝)患者抽取了大于200 mL脂肪,但未对提取到的SVF细胞进行计数,而将最终5 mL SVF产物全部注射,因此该研究在2种细胞数量及细胞质量上未做到统一,随访时间也较短,仅为6个月,因此临床结果存在一定的局限性。
HA是一种分布于细胞间质中的天然非硫酸化粘多糖,主要分布于关节软骨、滑液、皮肤和房水中,具有黏弹性、润滑性、生物相容性、可降解性及抗炎活性等,关节腔内注射HA可有效改善OA的症状并减慢OA的进程[61],但不能逆转或修复变性软骨或骨骼[62]。在Hong等[56]的双盲随机自我对照研究中,对16例双侧症状性膝OA患者进行随机一侧关节腔注射4 mL(40 mg)HA,另一侧关节腔注射4 mL SVF(平均细胞数7.45h106· mL-1,平均细胞存活率70.25%),结果表明,在12个月的随访中2组患者均未观察到严重不良事件。与基线相比,SVF治疗组的平均VAS、WOMAC评分和ROM均有明显改善;而对照组的各评分没有显著性变化。基于MRI的全关节和软骨修复磁共振成像评分(即WORMS和MOCART)显示,SVF治疗组的关节软骨修复较HA组有显著改善。该研究说明,SVF治疗OA是安全有效的,且治疗效果远比HA的治疗效果好,但是依旧存在随访时间短、参与研究的患者少以及存在一侧给予SVF治疗是否会影响对侧膝盖的不确定等局限性。
在表2中,大部分研究对象为膝关节OA,且约半数的临床研究是无对照且无联用的只采取SVF治疗OA,均无感染、急性疼痛、癌症等严重不良反应发生的相关报道,由此表明SVF治疗是安全的,多数研究所用的脂肪取自于腹部、臀部及大腿外侧,脂肪体积(单膝)为60 ~ 215 mL不等,细胞数2h106~ 3h107不等,每个关节腔最终注射的SVF制剂体积为2.5 ~ 5 mL不等。虽然目前在患者OA发病程度与所用脂肪体积、SVF细胞数、细胞存活率和细胞活性上未能保持统一的标准,但现有的研究均显示出良好的治疗效果:包括VAS、WOMAC、ROM、MRI、KOOS和Lysholm等评分有所改善,患者的疼痛减轻,症状缓解,关节功能获得一定的改善等[39-40,45-53,58-60]。目前临床上用SVF治疗OA的步骤如图1所示。
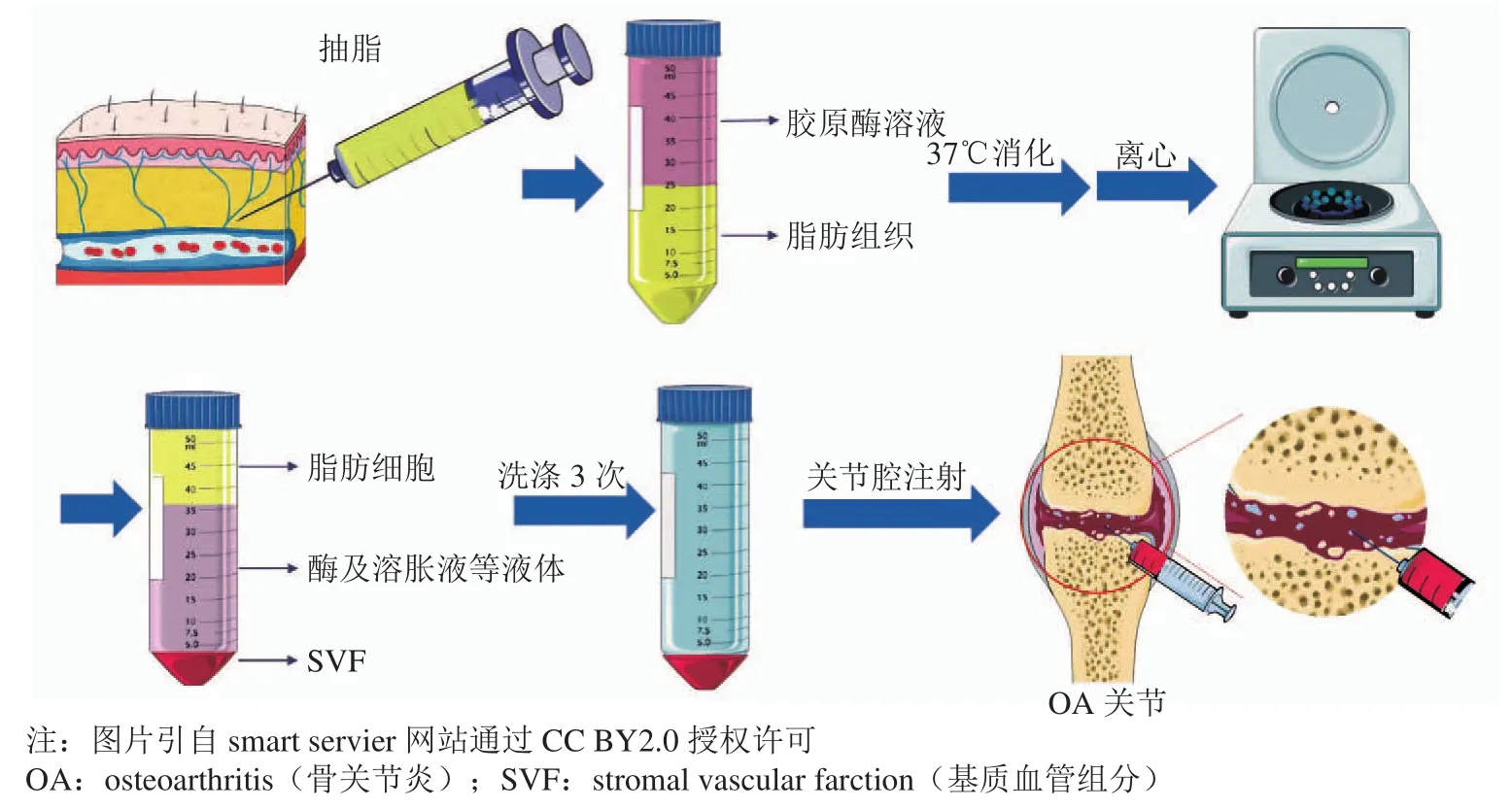
图1 提取SVF治疗OA的步骤Figure 1 Procedures for isolating SVF to treat OA
值得一提的是,Garza等[58]研究高(3h107)、低(1.5h107)SVF剂量组以及安慰剂组(无SVF的HA)的OA患者最终的治疗效果,结果表明各组患者在治疗后6个月的WOMAC评分与基线相比均出现不同程度的降低,与安慰剂组相比,高剂量和低剂量组的WOMAC评分具有统计学显著性差异,且此改善程度是剂量依赖性的。此外,SVF对于OA的治疗效果可以维持1年,而安慰剂组在1年后已无治疗效果。Michalek等[44]使用了2种不同分离装置:Cellthera KitⅠ、Cellthera KitⅡ,前者利用胶原酶消化法获得SVF,后者使用机械法获得SVF。预实验表明,前者所得细胞产量比后者高3.4倍,随后使用该2种方法提取的SVF随机对1 128例OA患者进行治疗,结果表明KitⅠ和KitⅡ所得SVF平均产量分别约为1.63h106和0.39h106/mL-1脂肪组织,细胞存活率分别约为87.4%和95.8%。最终治疗效果以KOOS/HOOS评价,结果表明2种提取方式所得SVF对于OA患者均有治疗效果,且两者无显著性差异。因此,采取何种方式提取SVF可由研究者根据具体情况进行选择。在对1例来自澳大利亚的27岁女性OA患者进行SVF治疗时,Bright等[48]发现该患者不仅OA症状缓解、疼痛减轻,而且其强直性脊柱炎、抑郁症、焦虑症和疲劳症等合并症也出现了明显的改善。因此,SVF可能不仅在OA的治疗中有重要的意义,在其他炎症、精神等疾病中也有潜在的治疗价值。这不仅给SVF的应用拓宽了道路,也给我们对于SVF的应用研究开拓了视野。
活化的血小板能释放多种生长因子,例如血小板衍生生长因子(platelet derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)和各种IL等,这些生长因子能够调节机体免疫反应,刺激软骨细胞增殖分化,促进软骨组织损伤修复以及调节内源性HA的合成,从而具有保护软骨并润滑关节的作用,还可以促进和增强干细胞的修复功能[63]。Bansal等[43]研究了使用PRP与SVF联用治疗OA患者,发现10例患者的WOMAC和6MWD评分均得到了显著的改善,MRI检测结果显示6例患者软骨厚度增加了至少0.2 mm,2例患者没有改变,2例患者降低了至少0.2 mm。总体而言,所有患者都对治疗结果满意,没有严重不良反应发生。此外,有研究表明,与单独使用PRP的患者相比,使用PRP+SVF联合治疗的患者可以获得更好的治疗效果[64],但是PRP也有其制备工艺较SVF简单、创口更小等优点,因此其常作为SVF治疗的佐剂。在Mayoly等[55]的研究中,对3例手腕OA患者进行PRP+SVF联合治疗,12个月的随访结果表明,疼痛指数(VAS)降低了至少50%。Pak等[37]在SVF+PRP的基础上,又联用了HA,在2016年治疗了3例膝关节OA患者,在2017年治疗了1例髋关节OA患者[42],均显示出良好的治疗效果,患者疼痛减轻,MRI显示软骨出现了修复,关节运动范围和关节功能都出现了明显的改善,但以上4个研究均存在一定的局限性:没有设置对照组以及参与研究的样本量均较少。AM是在关节镜下,于软骨缺损部位垂直方向使用微骨折椎的椎尖进行钻孔,使得骨髓和血液渗出,在缺损处凝结血块,因此骨髓间充质干细胞可驻留在软骨损伤处,修复损伤软骨,微骨折技术是临床常用的治疗OA的手术方法之一,可短期获得良好的治疗效果,但其远期效果不理想[65]。Tran等[57]将SVF与微骨折联用治疗OA并将单独使用微骨折的OA患者作为对照组,结果发现与对照组相比,联用治疗组的VAS、WOMAC、Lysholm和OS评分的改善更加显著,治疗效果更好。Nguyen等[41]在SVF+AM的基础上又联用了PRP,对照组为AM组,结果表明,联用组的治疗效果也显著优于对照组,在随访18个月时,这种治疗效果依旧可以维持。与接受关节内注射皮质类固醇激素相比,接受关节内注射HA的OA患者的症状得到了更显著的缓解[66];而PRP对OA的治疗作用也较HA更有效[67];亦有研究表明,SVF的治疗效果也较PRP[64]和HA[56]更为优异,但是缺乏单独的SVF与其他多种治疗手段的临床水平比较研究,因此SVF可能是目前最值得被选择的治疗方式之一。
4 基质血管组分治疗骨关节炎的机制
当机体产生损伤时,受损部位可以产生信号分子,从而激活干细胞的“归巢”作用,使得干细胞迁移至损伤位置发挥修复组织的作用[68]。但是软骨组织无血管分布,即使是骨髓中的ADSC也难以迁移至损伤处,因此需要外源注入干细胞。在OA患者的关节腔注射SVF,其中的ADSC可以通过多种趋化因子受体如趋化因子受体4(chemokine receptor 4,CXCR4)、整合素、选择素以及血管细胞黏附分子-1等相互作用从而迁移至受损处[69]。虽然ADSC在体外能诱导分化为软骨细胞,但在OA治疗的过程中却没有足够的证据证明ADSC在体内可自身分化为软骨细胞来修复损伤的软骨组织。现有的研究表明,ADSC的治疗作用的重要机制是ADSC的“营养”作用,其可以分泌生长因子和细胞因子等,如TGF-β、骨形态发生蛋白(BMP-2、BMP-4、BMP-7)、胰岛素样生长因子1(insulinlike growth factor 1,IGF-1)和FGF-2等,从而具有促进软骨形成,诱导细胞增殖、分化、迁移等作用,最终促进软骨损伤修复[70]。此外,ADSC还可分泌一氧化氮(NO)、TNF-α和IL等细胞因子,起到调节机体免疫、抗炎的作用[71]。ADSC还可以通过表达抗凋亡蛋白抑制软骨细胞凋亡[72]。SVF是一种多细胞组分,除ADSC外,祖细胞、周细胞、内皮细胞、成纤维细胞以及多种免疫细胞等在OA的治疗中也发挥重要作用,如构成微环境、分泌细胞因子、促进软骨修复及调节免疫等[54]。Veronesi 等[73]对早期OA绵羊分别用SVF、扩增的ADSC或羊膜上皮干细胞进行治疗,结果表明各治疗方法在杨氏模量、软骨厚度以及滑膜液中促炎因子的含量方面均有一定的改善作用,其中SVF的治疗效果最佳。这说明SVF的复杂细胞成分使得其相较ADSC在OA的治疗中更具优势。
5 结语与展望
软骨一旦发生病变,将是一个进行性退化过程。目前临床上尚无完全治愈OA的方法,因此对于早期OA的诊疗和逆转关节退化非常重要。越来越多的证据表明,SVF是一个能有效修复关节软骨损伤的治疗选择,但是缺乏长期随访的临床结果数据,此外,SVF治疗具有一定的个体差异性,包括提取方法和设备的不同导致提取的细胞数量和质量不尽相同,同时不同患者的脂肪量和最终细胞获得量也不尽相同,甚至不同的研究中最终治疗OA的SVF细胞数目相差10倍之多,因此使用SVF治疗OA需要制定更加详细全面的治疗操作标准。
令人鼓舞的是SVF治疗具有很高的安全性。所有接受SVF治疗的OA患者没有出现感染、急性疼痛、癌症等严重不良反应,虽然偶见关节积液、肿胀,抽脂部位疼痛或者淤血瘙痒等轻微反应,但经简单护理即可缓解。临床上常使用的镇痛抗炎类药物,长期使用可能增加氧化应激并改变软骨细胞的基因表达,甚至促进OA的发展,而关节内注射药物由于需要多次进行关节腔注射,不仅影响患者的顺应性,其导致不良反应的风险也显著增加[74]。因此在安全性方面,SVF有其独特的优势。但是,对于大部分SVF治疗OA的临床研究均具有一定的局限性,例如参与研究的OA患者数不多且缺乏随机对照研究等,因此在后续的研究中需要制定更加全面合理的研究设计。目前,有些研究者采用了SVF与其他方式(如HA、微骨折、PRP等)联用的治疗方案,其治疗效果显著优于对照组,因此,可以考虑用多种治疗手段联用,如SVF配合减肥、运动及针灸等物理疗法来治疗OA,相信在未来也可以获得更好的治疗效果。

