椎间盘软骨终板干细胞衰老初探*
刘 宁 陈 勤 伍耀宏 江西省赣州市人民医院 341000
脊柱退行性疾病是骨科常见疾病,目前认为椎间盘退变是这一系列脊柱退行性疾病的病理基础。严重影响患者的生活质量,给社会带来巨大的经济负担。由于椎间盘的退变,椎间盘的生物力学发生了显著变化,椎间盘间隙的高度降低,导致脊柱不稳、椎间盘突出、脊髓或神经根受压,引起肢体疼痛、麻木等症状[1-3]。软骨终板可以维持椎体的正常形态,防止髓核向相邻椎体凸出,保护椎体在承受压力时避免压迫性骨萎缩。同时,软骨终板能够吸收来自脊柱负重的静态压力。软骨终板作为椎间盘的主要营养途径,通过渗透作用为椎间盘提供营养和体液交换[4]。目前,椎间盘干细胞已成为研究的焦点,软骨终板中干细胞的存在引起了临床研究者的关注[5]。细胞衰老是指细胞周期的阻滞,衰老相关标志物的表达以及衰老相关通路的激活,如p53-p21、p16等,在机体变性中起着非常重要的作用。近年来的研究表明,干细胞的老化是组织变性或器官疾病的重要原因。研究证实了软骨终板干细胞存在于人类椎间盘终板组织中[6]。然而,软骨终板干细胞在衰老过程中的存在国内外鲜有报道,其在椎间盘退变中的作用机制尚不清楚。因此,本研究将通过检测不同年龄组获得的人软骨终板干细胞的增殖活性、周期停滞、细胞衰老等指标来验证人软骨终板干细胞的衰老现象。
1 资料与方法
1.1 一般资料 本研究收集了本院2020年1—5月因腰椎间盘退变性疾病行腰椎间盘摘除术植骨融合的30例临床标本,女13例,男17例,年龄35~58岁,将其按不同年龄段分为高年龄组(≥46岁,n=16)和低年龄组(<46岁,n=14)。高龄组中男9例,女7例,平均年龄(51.69±4.09)岁;低龄组中男8例,女6例,平均年龄(40.64±3.77)岁。所有患者均行腰椎MRI等常规检查判断椎间盘退变程度,且既往无腰痛病史,本研究所需标本均经患者或家属签字同意, 并得到医院伦理委员会批准。
1.2 试剂及仪器 倒置显微镜(青岛富堡精密仪器有限公司)、细胞衰老β-半乳糖苷酶染色试剂盒(上海研生实业有限公司)、CCK-8 试剂盒(翌圣生物科技有限公司)、酶标系统多功能仪(青岛聚创环保有限公司)、流式细胞仪(贝克曼库尔特商贸有限公司)、一次性培养皿(山东博科控股集团)、PBS缓冲液(东莞市斯巴达化学有限公司)。
1.3 方法
1.3.1 软骨终板干细胞提取、培养:取软骨终板,去除周围纤维环、髓核和软骨。清洗后,用PBS清洗。将部分组织放入玻璃皿中,加入透明质酸酶和Ⅱ型胶原酶消化液。细胞在37℃培养箱中培养过夜。然后将消化块加入培养基中,收集细胞悬浮液,离心10min,丢弃上清液,将细胞重新悬浮并在培养皿中培养。
1.3.2 β-半乳糖苷酶染色法观察细胞形态和衰老活性:培养孔板中的培养基清除,用 PBS清洗细胞2次,加入染色固定液,固定15min,PBS清洗3次,3min/次,加人工作液混匀后,滴加至细胞培养板中,覆盖所有的细胞,37℃孵箱孵育过夜,PBS清洗后,显微镜下观察染色情况,记录染色结果,采用 ImageJ软件进行分析。
1.3.3 流式细胞术检测细胞周期阻滞情况:将中板软骨细胞常规胰酶消化、收集、离心(1 000r,5min);再用PBS缓冲液冲洗后再次离心5min,加入乙醇溶液后固定24h,然后用流式细胞仪检测,最后分析计算结果。
1.3.4 CCK-8检测各组细胞的增殖活性:为验证所分离出细胞的增殖能力,采用CCK-8实验检测细胞的活力,向每个小孔内滴加10μl CCK-8显色溶液,然后置于细胞培养箱内。分别于12h、24h后,迅速在酶标仪上检测每组细胞的OD值。
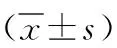
2 结果
2.1 两组椎间盘软骨终板干细胞的形态比较 低年龄组椎间盘终板软骨细胞呈圆形、多角形,形态较饱满,高年龄组细胞形态明显细长、较扁,呈长梭形改变,呈明显的退变形态。见图1。

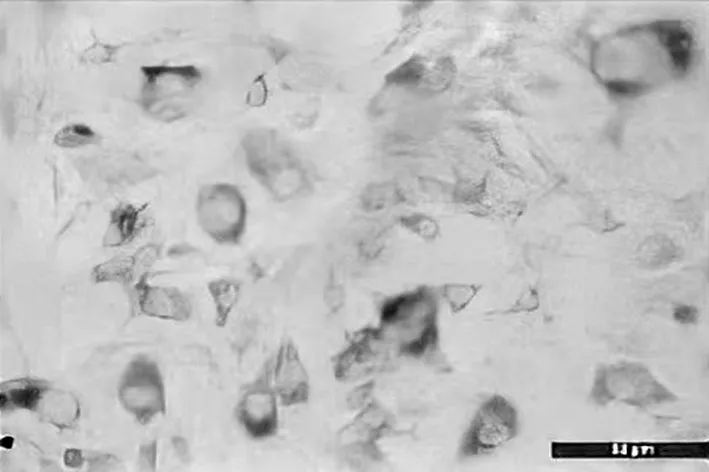
图1 各组软骨终板干细胞的形态
2.2 两组衰老细胞阳性比比较 高年龄组衰老细胞阳性比为(73.6±3.56)%,明显高于低年龄组的(35.4±2.89)%,差异有统计学意义(t=31.94,P<0.05)。
2.3 两组细胞周期情况比较 高年龄组的G1期细胞比和(S+G2/M)期细胞比均低于低年龄组(P<0.05)。说明高年龄组的细胞周期阻滞情况较低年龄组更明显。见表1。

表1 两组细胞周期情况比较
2.4 两组细胞的增殖活性比较 高年龄组的12hOD、24hOD均低于低年龄组(P<0.05)。说明高年龄组的软骨干细胞增殖活性低于低年龄组。见表2
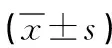
表2 两组细胞OD值比较
3 讨论
临床上椎间盘退变导致的脊柱疾病很常见,正在不同程度地影响着70%以上的年轻人,致残率较高,极大降低患者生活质量[7],目前,主要的治疗策略是椎间盘切除术。近年来,椎间盘退变的细胞替代疗法和组织工程已成为研究的热点。随着间充质干细胞作为细胞替代治疗的理想种子细胞的发现,软骨终板干细胞的发现为椎间盘退行性细胞治疗的种子细胞提供了新的选择[8]。虽然已经发现导致椎间盘退变的因素很多,如遗传因素、机械负荷、炎症因素等,但椎间盘退变的确切机制尚不清楚。目前有大量研究认为细胞衰老与椎间盘退变有非常重要的关系,细胞衰老可能是椎间盘退变的重要影响因素[9-10],特别是椎间盘的髓核和纤维环。β-半乳糖苷酶阳性细胞可见于退变椎间盘的髓核和纤维环中,β-半乳糖苷酶阳性细胞数量的减少和细胞的复制潜能与椎间盘的退变程度密切相关[11]。然而,尚未见椎间盘软骨老化的报道。椎间盘的终板被认为是椎间盘的营养通道。因此,椎间盘终板的退变和钙化会降低其均匀传递的能力,阻碍NP营养物质的扩散,诱发或加速椎间盘的退变。因此,探讨椎间盘终板软骨细胞的老化对椎间盘退变具有重要意义,可以更好地指导椎间盘退变的预防,使部分患者可以避免手术治疗。
在本研究中,高年龄组细胞形态的退变程度要高于低年龄组,说明随着年龄的增加,软骨细胞的退变会更加明显,在β-半乳糖苷酶染色法中,高年龄组衰老阳性细胞比明显高于低年龄组;高年龄组细胞增值率低于低年龄组,而且周期阻滞强于低年龄组,以上研究结果表明,软骨终板中干细胞的衰老现象是存在的,并且随着年龄的增加软骨细胞的代谢、增值率降低,这造成了软骨细胞的数量减少,从而间接引起临近细胞的凋亡。有学者指出,软骨终板是作为椎间盘最重要的组成部分而存在,是维持其正常形态的重要因素,其退变过程是一个多因素的复杂过程,主要与年龄、局部炎症因子、终板软骨细胞功能等因素相关[4]。研究指出,软骨终板细胞凋亡的增加,使单位体积内细胞数量减少,细胞外基质含量也下降,软骨终板物理结构、化学成分及生物效应发生变化,软骨终板细胞外基质产生的有效胶体渗透压不能稳定维持,营养代谢紊乱,软骨终板骨化,加快了终板组织变形,同时变形加快了细胞凋亡,形成恶性循环,最终导致细胞密度显著降低,并持续钙化、骨化,脆性增加而出现裂隙和破坏[12]。这也与本文研究结果相一致。
综上所述,椎间盘软骨终板干细胞存在衰老现象,具体表现为细胞形态的退变、细胞周期改变、增殖能力下降等。且椎间盘软骨终板干细胞的衰老现象会随着年龄的增长而愈发明显,这为椎间盘退变的预防提供了较好的指导,具有重要的临床意义。

