发酵米糠水提物的抗氧化活性研究
■董琛琳 刘 娜 王 园 宋 敏 王瑞芳 杨艳平 安晓萍 齐景伟
(内蒙古农业大学动物科学学院,内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
米糠(rice bran),稻谷加工的主要副产品,由种皮、果皮、糊粉层和珠心层组成[1],占稻谷总重量的5%~8%[2]。稻谷是全球产量最高的粮食作物之一[3],而米糠作为其副产物,产量也极为丰富,但利用率却很低。国际相关组织把米糠列为未充分利用的天然原材料之一[4]。米糠中除糖类、脂肪、维生素等营养物质外,还含有大量多酚、黄酮、蛋白等天然抗氧化剂和功能性物质,在生产实践中具有重要意义。如提高鸡的产蛋量[5]、促进宁乡猪的小肠绒毛发育,提高其生长性能[6]、提高肉牛的平均日增重[7]等。
微生物发酵是指在有氧或无氧条件下进行生长繁殖产生代谢产物的过程,微生物发酵不仅能促进许多功能性物质的释放,而且还能够抑制有害微生物的生长繁殖[8]。用微生物来发酵饲料原料不仅可以降低、消除饲料原料中的有毒有害物质、抗营养因子,还可以促进营养物质的消化吸收利用、补充有益微生物、调控宿主肠道微生态平衡、提高机体免疫力等[9]。微生物发酵可以改变米糠中的活性成分含量,从而改善米糠稳定性差、易哈变的特质[10]。水提是一种较为便捷且成本较低的提取方法[11]。1,1-二苯基-2-三硝基苯肼(DPPH)是一种较稳定的自由基,其乙醇水溶液呈较深的紫色,而样品中的抗氧化物质可将其清除从而使紫色变浅,所以可根据其吸光度值减少的程度来判断样品抗氧化能力的强弱,是一种简单快速的测定方法[12]。本试验以DPPH 自由基清除率为指标,优化了发酵米糠水提物的提取时间、提取温度和料水比,并对其活性成分以及体外抗氧化活性进行了研究,为米糠深加工提供基础数据。
1 材料与方法
1.1 材料与仪器
米糠、麸皮、腐植酸钠、博善菌均购于市场;葡萄糖、苯酚、浓硫酸、无水乙醇、DPPH、水杨酸钠、琼脂糖等均为分析纯;葡聚糖酶购于济南诺能生物工程有限公司;Bradford 试剂盒购于南京建成生物研究所;pBRR322 质粒DNA 购于美国Thermo Fisher 公司;5xTBE Buffer购于北京酷来搏科技有限公司。
1.2 试验方法
1.2.1 发酵米糠的制备
在发酵袋中加入80%的米糠原料和20%的麸皮辅料,加入0.5%的腐植酸钠,再添加葡聚糖酶2 000 U,接种博善菌5‰,添加50%的蒸馏水,搅拌均匀,然后封口,排出发酵袋中的气体,在28 ℃的培养箱中发酵72 h。
1.2.2 发酵米糠水提物的制备
根据1.2.1 制备出发酵米糠。以DPPH 自由基清除率为指标,优化发酵米糠水提物的提取时间、提取温度和料水比。
1.2.2.1 提取时间
称取1 g发酵米糠样品和20 mL蒸馏水,在80 ℃水浴锅中分别浸提0、20、40、60、80 min,冷却后5 000 r/min 离心15 min,吸取上清液,稀释8倍作为样液待测。
1.2.2.2 提取温度
称取1 g 发酵米糠样品和20 mL 蒸馏水,分别在70、75、80、85、90 ℃水浴锅中浸提60 min,冷却后5 000 r/min 离心15 min,吸取上清液,稀释8 倍作为样液待测。
1.2.2.3 料水比
称取1 g 发酵米糠样品,分别添加10、15、20、25、30 mL 蒸馏水,在85 ℃水浴锅中浸提60 min,冷却后5 000 r/min离心15 min,吸取上清液,稀释8倍作为样液待测。
1.2.2.4 DPPH自由基清除率测定
参照Musa[13]的方法略做修改。吸取样液1 mL,加1 mL DPPH应用液,混匀静置30 min,在517 nm处测定吸光度A1;用蒸馏水代替样液测定吸光度A2;用95%乙醇代替DPPH应用液测定吸光度A3。
DPPH自由基清除率(%)=[1-(A1-A3)/A2]×100
1.2.3 发酵米糠水提物活性成分含量测定
多糖含量的测定采用苯酚-硫酸法[14];多酚含量的测定采用任雪荣等[15]的方法;黄酮含量的测定采用傅杰[16]的方法;蛋白含量的测定采用Bradford试剂盒;具体方法参照说明书,根据蛋白标准曲线公式计算其含量。
1.2.4 发酵米糠水提物的体外抗氧化活性分析
1.2.4.1 羟基自由基清除能力
参考Rajauria 等[17]的方法略做修改。吸取样液0.5 mL,加入0.5 mL(9.0 mmol/L)硫酸亚铁溶液和0.5 mL(8.8 mmol/L)过氧化氢溶液,室温反应10 min后,加入0.5 mL(9.0 mmol/L)水杨酸乙醇溶液,室温反应30 min 后,在510 nm 处测吸光度A1。用蒸馏水代替硫酸亚铁溶液重复上述步骤测吸光度A2,用蒸馏水代替样液重复上述步骤测吸光度A3。
羟基自由基清除率(%)=[1-(A1-A2)/A3]×100
1.2.4.2 还原力
1.2.4.3 DNA损伤保护
参考张溢等[19]的方法略做修改,采用琼脂糖凝胶电泳法研究发酵米糠水提物对质粒DNA 氧化损伤的保护作用。精密量取1 μL pBR322DNA(0.1 μg/μL),2 μL发酵米糠水提物的水溶液加入离心管中,混合均匀后再加入30%过氧化氢2 μL,反应总体积为5 μL。在超净台中紫外线照射15 min,室温静置20 min。结束后,加入6×Loading Buffer 2.5 μL,混匀后点样于0.5%琼脂糖凝胶,110 V 电压下电泳,40 min 后停止电泳。在凝胶成像系统下观察电泳结果,试验数据用Fluor Chem分析软件进行处理。
1.2.5 数据统计分析
试验数据用SAS 9.2 单因素方差分析(one-way ANOVA),并用Duncan’s 法对各组间进行多重比较,P<0.05为差异显著。
2 结果分析与讨论
2.1 不同提取条件下发酵米糠水提物的DPPH清除力
2.1.1 提取时间(见图1)

图1 提取时间对发酵米糠水提物抗氧化活性的影响
提取时间对发酵米糠水提物抗氧化活性的影响见图1。由图1可知,随着提取时间的增加,发酵米糠水提物的DPPH 自由基清除率呈现先增加后下降的趋势,其中提取时间为60 min 时,发酵米糠水提物的DPPH 自由基清除率最高且显著高于其他组(P<0.05);提取时间为20、40、80 min时,发酵米糠水提物的DPPH 自由基清除率差异不显著(P>0.05),但显著高于0 min 组(P<0.05)。原因可能在于,未提取或提取时间过短时,发酵米糠中的活性物质未充分释放出来,发酵米糠抗氧化活性较低。提取时间过长时,发酵米糠抗氧化活性也较低,是因为随着加热时间的延长,释放出来的活性物质被破坏[20]。综上所述,80 ℃水浴浸提时,60 min为发酵米糠水提物的最佳水提时间。
2.1.2 提取温度(见图2)
提取温度对发酵米糠水提物抗氧化活性的影响见图2。由图2可知,发酵米糠水提物的DPPH自由基清除率随着提取温度的增加呈现先上升再下降的趋势;其中提取温度为85 ℃时,发酵米糠水提物的DPPH 自由基清除率达到最大值,且显著高于70、75、80 ℃组(P<0.05),但与90 ℃组无显著差异(P>0.05)。原因可能在于提取温度主要通过影响活性物质的释放速度来影响发酵米糠的抗氧化活性。提取温度较低时,分子的活动较弱,活性物质释放得较慢。提取温度较高时,活性物质变性而被破坏了[21]。由此可得,85 ℃为发酵米糠水提物的最佳水提温度。

图2 提取温度对发酵米糠水提物抗氧化活性的影响
2.1.3 料水比(见图3)
曾有人问任正非,华为成功的关键是什么?“还是财务体系和人力资源体系。”任正非的这个回答被看作是对孟晚舟的极大肯定。

图3 料水比对发酵米糠水提物抗氧化活性的影响
料水比对发酵米糠水提物抗氧化活性的影响见图3。由图3可知,发酵米糠水提物的DPPH自由基清除率随着料水比的增加呈现先上升后下降的趋势;在料水比为1∶30(g/mL)时,发酵米糠水提物的DPPH自由基清除率最低,且显著低于其他组;在料水比为1∶10、1∶15、1∶20(g/mL)和1∶25(g/mL)时,各组无显著差异(P>0.05),但在1∶20(g/mL)时,发酵米糠水提物的DPPH自由基清除率达到最高。原因可能在于水作为一种溶剂,在其体积不断增加的过程中,水的传质动力增大,从而导致传质效率也增大,使得发酵米糠水提物的DPPH 自由基清除率增大。随着料水比不断增加,其清除率开始下降,可能是水体积的增加致使传质扩散达到一种过饱和稳定状态[22]。综上所述,料水比为1∶20(g/mL)为发酵米糠水提物的最佳料水比。
综上所述,确定发酵米糠水提物提取时间为60 min,提取温度为85 ℃,料水比为1∶20(g/mL)。此时其DPPH自由基清除率可达85.55%,较原料提高了52.63%。因此,发酵可明显提高米糠的抗氧化活性,这与其活性成分在发酵过程中得到了大量释放有关。
2.2 发酵米糠水提物活性成分分析(见表1)

表1 发酵米糠水提物活性物质含量(n=3)
由表1可知,与米糠水提物(RBE)相比,发酵米糠水提物中多酚、黄酮、蛋白均显著增加(P<0.05),且分别增加了68.16%、80.31%、28.92%。原因可能在于在米糠发酵过程中,米糠中葡萄糖等营养成分被微生物所利用了,从而导致米糠中的其他活性物质被释放出来,而这些活性物质的增加可能就是发酵米糠抗氧化活性增加的原因[23]。
2.3 发酵米糠水提物的体外抗氧化活性分析
2.3.1 羟基自由基清除能力(见图4)

图4 不同浓度米糠水提物和发酵米糠水提物羟基自由基清除率
羟基自由基被认为是最活泼最有害的氧自由基,其可穿过细胞膜,从而损伤核生物大分子,导致组织产生氧化损伤[24]。不同浓度米糠水提物和发酵米糠水提物羟基自由基清除率见图4,由图4可知,同一浓度下,发酵米糠水提物羟基自由基清除率显著高于米糠水提物(P<0.05),且显著高于标准品(BHA)(P<0.05);当浓度为4 mg/mL 时,标准品对羟基自由基清除率为33.69%,而发酵米糠水提物可达到78.58%。原因可能在于发酵有利于活性成分的释放,使其更容易和羟基自由基反应,因此发酵米糠水提物具有较高羟基自由基清除能力[25]。
2.3.2 还原力(见图5)
衡量一种抗氧化物质是否可以高效地提供电子的一个重要指标就是还原力,还原力强的物质可提供电子从而使自由基变为稳定的物质,阻止自由基所产生的连锁反应[26]。不同浓度米糠水提物和发酵米糠水提物还原力见图5。由图5可知,同一浓度下,发酵米糠水提物的还原力显著高于米糠水提物(P<0.05),虽然其还原力显著低于标准品(P<0.05),但在浓度为4 mg/mL时,其还原力可达到1.432。原因可能在于发酵能够提高米糠中酚酸的含量,而酚酸具有较强的还原力。因此,发酵米糠水提物具有较强的还原力[27]。

图5 不同浓度米糠水提物和发酵米糠水提物还原力
2.3.3 DNA损伤保护(见图6~图8和表2)
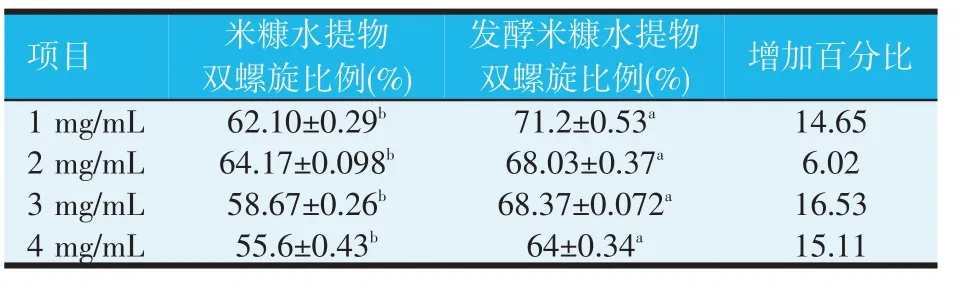
表2 发酵米糠水提物对·OH 介导的DNA损伤的保护作用

图6 不同处理对·OH介导的DNA的损伤

图8 米糠水提物与发酵米糠水提物对·OH介导的DNA损伤的保护作用
米糠水提物与发酵米糠水提物对羟自由基(·OH)介导的DNA损伤保护作用以DNA双螺旋比例进行表征。在一定的场强下,DNA分子的迁移速率与其自身的大小和构型有关,通常情况下,DNA 分子为双螺旋结构,条带移动较快。但当DNA分子受到损伤后,双螺旋结构会变成开环结构或线性结构,条带移动较慢[28]。双螺旋比例越高表明其对DNA损伤的保护作用越强[29]。由图6、图7可知,正常pBRR322质粒DNA以双螺旋结构为主(泳道1),被·OH损伤后,部分双螺旋结构转变为开环或线型(泳道4)。与正常pBRR322质粒DNA 相比,在紫外光(UV)的照射下(泳道2),DNA双螺旋比例无显著差异(P>0.05);加入30% H2O2(泳道3)时,DNA 双螺旋比例显著低于正常pBRR322 质粒DNA组(P<0.05);当两者共同作用时(泳道4),DNA双螺旋比例显著低于30% H2O2组(P<0.05);这表明在紫外光(UV)的照射下或者加入30% H2O2时,不足以直接损伤DNA,而两者共同作用时,过氧化氢可被光解产生羟自由基(·OH),而·OH被认为是最活泼的活性氧,也是引起DNA 氧化损伤的主要因素之一。

图7 不同处理对·OH介导的DNA的损伤
发酵米糠水提物对·OH介导的DNA损伤的保护作用见图8 以及表2。由表2 可知,在同一浓度下,各组之间的差异都显著(P<0.05),这表明,发酵米糠水提物对·OH介导的DNA损伤保护作用显著高于米糠水提物。
综上所述,文章以DPPH 自由基清除率为指标,优化了发酵米糠水提物的提取时间、提取温度和料水比,得出发酵米糠水提物提取时间为60 min,提取温度为85 ℃,料液比为1∶20(g/mL)时,其DPPH 自由基清除率可达85.55%,较原料提高了52.63%。对其活性成分含量进行测定,得出发酵米糠水提物中多酚、黄酮、蛋白含量可达29.58、8.15、74.44 mg/g,较米糠水提物分别增加了68.16%、80.31%、28.92%;对其体外抗氧化活性进行了研究,发酵米糠水提物的羟基自由基清除率、还原力以及对羟自由基(·OH)介导的DNA 损伤的保护作用都显著强于米糠水提物。徐磊等[30]研究了米根霉发酵对脱脂薏米麸皮抗氧化活性的影响,发现与未发酵脱脂薏米麸皮相比,发酵处理后脱脂薏米麸皮的游离型酚类提取物的抗氧化活力显著提高。李冰等[31]研究了发酵前后芍药花中总酚总黄酮含量的变化及抗氧化活性,发现与发酵前相比,发酵后芍药花的总酚、总黄酮含量和抗氧化活性显著提高。本研究结果与此相一致。
3 结论
总体而言,发酵后米糠的活性成分含量和抗氧化活性均显著提高,试验研究结果将为深度开发利用米糠资源提供一定的理论依据。

