脂肪酶与乳化剂联合应用对吉富罗非鱼饲料中脂肪的节约效应
■吴建军 刘 伟 邱 权 周 樱 付大波 徐 丽
(1.武汉新华扬生物股份有限公司,湖北武汉 430074;2.中国水产科学研究院长江水产研究所,湖北武汉 430223)
脂肪在鱼类生命代谢过程中具有多种生理作用,除了为鱼类生长发育提供能量和必需脂肪酸、作为组织细胞的组成外,还有助于脂溶性维生素的吸收和在体内的运输、节省饲料蛋白质,是鱼类必需的营养物质之一[1]。但脂肪含量过高或过低,都会影响鱼类的正常生长。饲料中脂肪含量不足或缺乏可导致鱼体代谢紊乱、饲料蛋白质利用率下降,还可并发脂溶性维生素和必需脂肪酸缺乏症[2-3]。饲料中脂肪含量过高又会导致鱼体脂肪沉积过多,造成鱼体抗病力下降[4]。在当前的商品饲料生产过程中,为了促进养殖鱼类的快速生长,饲料中的油脂添加量有逐渐增加的趋势,这不仅增加了饲料的配方成本,而且还增加了养殖鱼类脂肪肝等问题的发生[5-7],因此,如何有效提高鱼类对饲料中脂肪的利用率,减少脂肪在肝脏的积累,避免脂肪肝等疾病的发生已成为水产饲料研究与开发中首要关注问题。
脂肪酶和乳化剂是能够促进饲料脂肪消化、吸收的两种添加剂,已经被广泛应用于畜禽饲料中,并取得了较好的应用效果[8]。相关的研究也表明,在饲料中添加脂肪酶或乳化剂,对于提高脂肪的利用效率、减少油脂的添加量和促进肝脏脂肪代谢是有利的[9-11]。但是,关于脂肪酶和乳化剂对水产饲料中脂肪节约效应以及对养殖鱼类肝脏健康的影响方面的研究尚不多见,因此本研究拟通过补充外源性的乳化剂和脂肪酶来提高罗非鱼对饲料中脂肪的消化吸收率,从而降低饲料中油脂的添加水平,以达到降低饲料成本和解决当前饲料脂肪水平过高引起脂肪消化吸收不畅的问题。
1 材料与方法
1.1 试验饲料与试验设计
试验用脂肪酶LP100(酶活为10 000 U/g)和乳化剂分别由武汉新华扬生物股份有限公司和湖北华扬科技有限公司提供。
以鱼粉、豆粕、菜粕、棉粕、小麦和米糠等为原料配制4 组饲料。HL、LL 组分别为高脂组、低脂组,HLEE、LLEE组分别为高脂+脂肪酶+乳化剂组、低脂+脂肪酶+乳化剂组。原料粉碎后过60目筛,按配方准确称量各种饲料原料,微量组分采用逐级扩大法混合,混合均匀后用小型环模颗粒机压制成粒径为2.0 mm的颗粒饲料,风干后用封口袋包装置于-20 ℃保存备用。饲料成分分析参照AOAC(2020)的方法[12],即水分含量采用105 ℃常压干燥法测定,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定。试验饲料组成及营养水平见表1。

表1 试验饲料组成及营养水平(干物质基础,g/kg)
1.2 试验过程
养殖试验在中国水产科学研究院长江水产研究所(武汉)室内试验基地进行。吉富罗非鱼(Genetic improvement of farmed tilapia, GIFT)由中国水产科学研究院长江水产研究所饲料室提供。试验前先将试验鱼用高锰酸钾溶液浸泡消毒后,置暂养池暂养2周,投喂商品饲料以适应养殖环境。待试验鱼驯养稳定后,挑选大小一致、鳞片完整的健康鱼[平均体重为(40.55±0.14)g]360 尾,放入1 套循环水养殖系统的12 个养殖桶中(有效容积100 L),随机分成4组,每组设3 个重复,每个重复30 尾鱼。试验期56 d,采用循环水控温养鱼,24 h充气增氧,水温控制在(25±2)℃,pH控制在7.5~8.5,氨氮浓度控制在0.3 mg/L以下,亚硝酸盐浓度低于0.1 mg/L。每天投喂2 次,时间分别为9:00和16:00,投喂率为鱼体重的4%~5%。
1.3 样品采集
试验开始和结束时,鱼体均禁食24 h,称量并记录试验鱼初始体重(initial body weight, IBW)和终末体重(final body weight, FBW),同时计数罗非鱼尾数,计算增重率(weight gain rate, WGR)和成活率(survival rate, SR)。试验结束后统计每个重复投喂的饲料重量,计算饲料系数(feed conversion rate, FCR)和蛋白质效率(protein efficiency ratio, PER)。
每个养殖桶随机取3尾鱼,用于测定全鱼基本营养成分;另从每个养殖桶中随机取3尾鱼并测量其体重和体长,计算肥满度(condition factor,CF);之后从尾部静脉采血,4 ℃静置2 h,3 000 r/min离心10 min,取上层血清用Sysmex 全自动生化分析仪(Chemix-800)测定血清谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶活性(alkaline phosphatase,ALP),总胆固醇(total cholesterol,TCHO)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)、葡萄糖(glucose,GLU)、白蛋白(albumin,ALB)、总蛋白(Total protein,TP)和三酰甘油(triglyceride,TG)的含量;将试验鱼进行解剖,分离内脏和肝脏并称重,计算肝体比(hepatosomatic index,HSI)和脏体比(viscerosomatic index,VSI);将肝脏保存于-80 ℃冰柜,用于肝脏抗氧化指标的测定。丙二醛(malonaldehyde,MDA)含量,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性均采用南京建成生物技术研究所试剂盒测定。每桶另取3尾鱼解剖并取其肝脏,用波恩氏液固定,石蜡包埋切片(切片厚度6 μm),苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜观察并照相。
每桶另外随机取3尾鱼于冰盘上处死,取出全部的肠道,剥除肠道外的脂肪和结缔组织,用冷冻去离子水洗净肠道中的内容物,滤纸吸干水分后称重。加入10倍冷冻去离子水,于4 ℃冰浴中匀浆,离心15 min(4 ℃、12 000 r/min),所得上清液即为消化酶粗酶液。酶液于4 ℃保存,24 h内检测完毕。蛋白酶活性按照GB/T 23527—2009中的福林酚法测定,酶活性的定义为:在30 ℃、pH 7.5、底物酪蛋白浓度为2%的条件下,1 min内1 g组织中蛋白酶分解酪蛋白产生1 μg酪氨酸为一个酶活性单位(U)[13]。淀粉酶活性按照GB/T 24401—2009的方法测定,酶活性的定义为:在30 ℃、pH 7.5、1%的可溶性淀粉作为底物条件下,1 min内1 g组织中的淀粉酶能完全水解淀粉产生1 mg麦芽糖为一个酶活性单位(U)[14]。脂肪酶活性按照GB/T 23535—2009 的方法测定,酶活性的定义为:在37 ℃条件下,每克组织蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活性单位(U)[15]。
增重率(WGR,%)=[(试验末鱼均重-试验初鱼均重)/试验初鱼均重]×100
特定生长率(SGR,%/d)=(ln 终末体重-ln 初始体重)/试验天数×100
肝体比(HSI,%)=肝重/体重×100
脏体比(VSI,%)=内脏重/体重×100
肥满度(CF,g/cm3)=平均体重/平均体长3×100
成活率(SR,%)=试验结束时鱼尾数/试验开始时鱼尾数×100
饲料系数(FCR)=饲料投喂量/试验鱼增重量;
蛋白质效率(PER)=(终末体重-初始体重)/(投料量×饲料中蛋白质含量)
1.4 数据分析
结果用“平均值±标准差”表示。数据采用SPSS 16.0软件进行two-way ANOVA分析,并以LSD作多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 脂肪酶和乳化剂联合应用对罗非鱼生长性能、饲料利用及形态的影响(见表2)

表2 饲料脂肪酶和乳化剂联合应用对罗非鱼生长性能、饲料利用和形态的影响
由表2 可知,经过56 d 的饲养,饲料中添加了脂肪酶和乳化剂的HLEE组和LLEE组试验鱼的终末体重、增重率和特定生长率均分别显著高于未添加这两种添加剂的HL 组和LL 组(P<0.05)。在饲料利用方面,HLEE 组和LLEE 组的饲料系数分别显著低于HL组和LL组(P<0.05),HLEE组的蛋白质效率也显著高于HL 组(P<0.05)。HLEE 组的肝体比分别显著高于HL组和LL组(P<0.05)。脂肪酶和乳化剂的联合使用对各组罗非鱼的肥满度均无显著影响(P>0.05)。双因素方差分析发现,脂肪酶和乳化剂的添加对试验鱼的终末体重、增重率、特定生长率及饲料系数均造成了显著影响(P<0.05);脂肪水平与脂肪酶和乳化剂的添加对试验鱼的饲料系数和蛋白质效率产生了交互影响(P<0.05)。
2.2 脂肪酶和乳化剂联合应用对罗非鱼鱼体成分组成的影响(见表3)

表3 脂肪酶和乳化剂联合应用对罗非鱼鱼体成分组成的影响
由表3可知,试验鱼的鱼体水分、粗蛋白和粗脂肪没有受到脂肪酶和乳化剂添加的影响(P>0.05),但HLEE组和LLEE组鱼体粗灰分分别较HL组和LL组降低了23.90%、17.71%(P>0.05)。脂肪水平与酶和乳化剂的添加没有对鱼体体成分造成交互影响(P>0.05)。
2.3 脂肪酶和乳化剂联合应用对罗非鱼内源消化酶活性的影响(见图1)
从图1 中可以看出,与HL 组和LL 组相比,HLEE组和LLEE 组有提高罗非鱼胃、前肠、中肠、后肠和肝脏等消化器官中蛋白酶和脂肪酶活性的趋势,但对淀粉酶活性没有产生明显的影响(P>0.05),仅有提高胃中淀粉酶活性的趋势。

图1 脂肪酶和乳化剂联合应用对罗非鱼内源消化酶活性的影响
2.4 脂肪酶和乳化剂联合应用对罗非鱼肝脏抗氧化能力的影响(见表4)
由表4可知,饲料中添加脂肪酶和乳化剂显著降低了LLEE 组肝脏过氧化氢酶(CAT)的活性以及HLEE 组和LLEE 组的总抗氧化能力(T-AOC)(P<0.05)。HLEE 组和LLEE 组罗非鱼肝脏中丙二醛(MDA)的含量均显著低于HL 组和LL 组(P<0.05)。各组罗非鱼肝脏中谷胱甘肽过氧化物酶(GSH-Px)的活性和超氧化物歧化酶(SOD)无显著性差异(P>0.05)。脂肪水平与脂肪酶和乳化剂的添加未对罗非鱼肝脏各抗氧化指标造成交互影响。
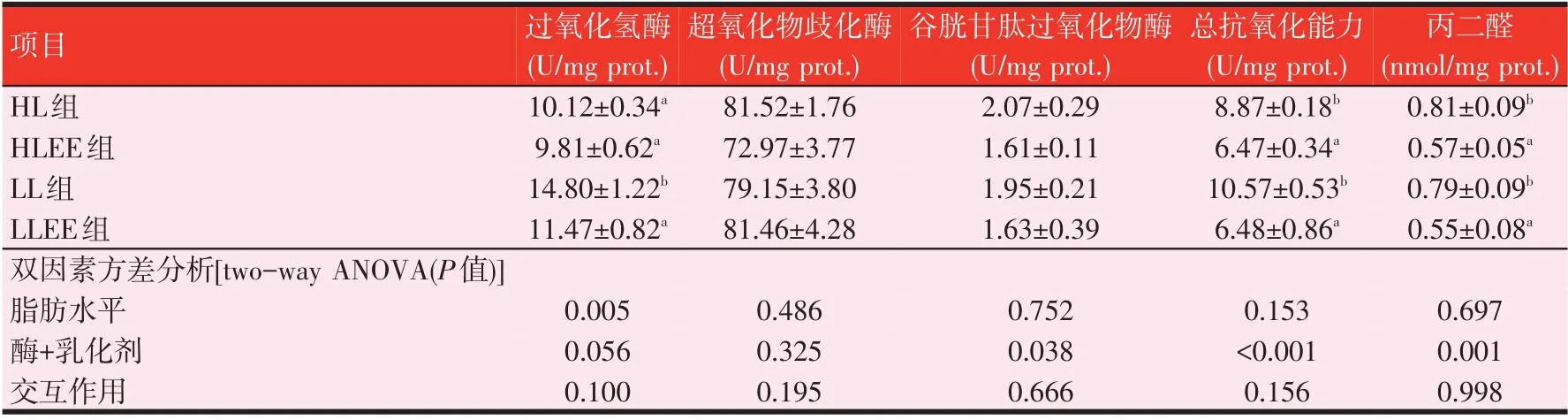
表4 脂肪酶和乳化剂联合应用对罗非鱼肝脏中抗氧化能力的影响
2.5 脂肪酶和乳化剂联合应用对罗非鱼血液生化指标的影响(见表5)
由表5可知,通过双因素方差分析,随着饲料脂肪水平的降低,罗非鱼血清中谷草转氨酶(AST)、碱性磷酸酶(ALP)的活性显著降低(P<0.05),而总蛋白(TP)和三酰甘油(TG)浓度则有提高趋势(P>0.05),其他血液生化指标未受脂肪水平变化的影响。在高脂肪饲料中添加脂肪酶和乳化剂显著降低了血液中ALT 的活性,而提高罗非鱼血液中TG的浓度;在低脂肪饲料中添加脂肪酶和乳化剂显著降低了血液中TP的浓度(P<0.05)。脂肪水平与脂肪酶和乳化剂的添加只对罗非鱼血液中LDLC和TP产生了交互影响。
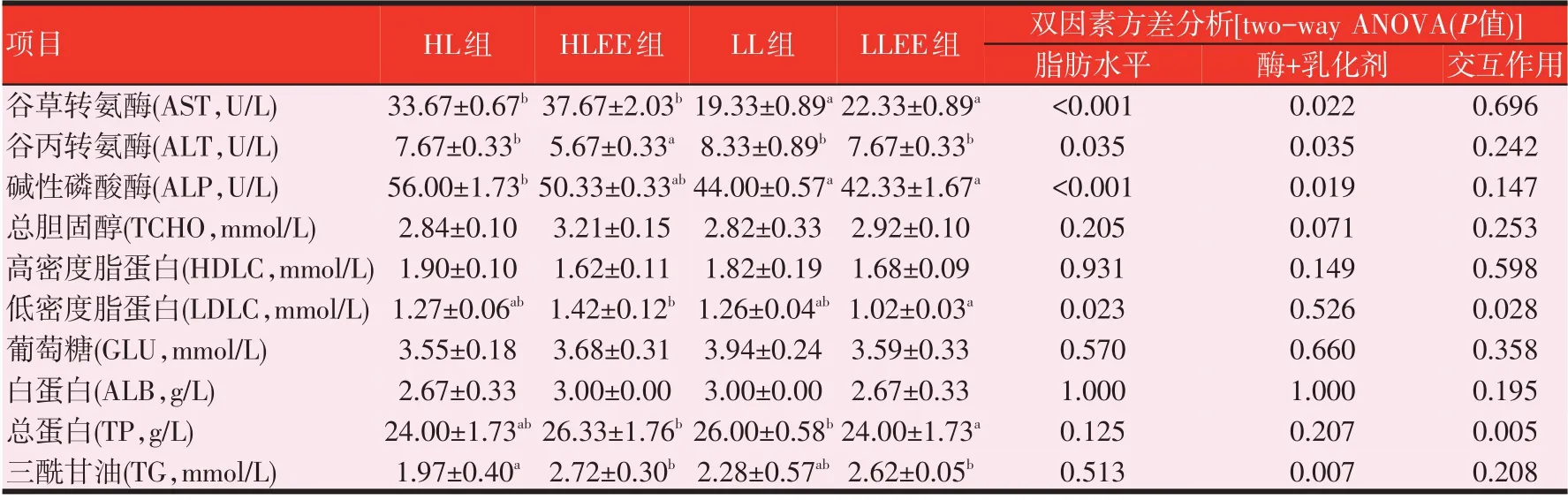
表5 脂肪酶和乳化剂联合应用对罗非鱼血清生化指数的影响
2.6 脂肪酶和乳化剂联合应用对罗非鱼肝脏组织形态学的影响(见图2)
如图2所示,肝脏切片显示,HL组和LL组罗非鱼肝脏中部分肝细胞出现核偏移,肝细胞的细胞质减少,细胞核消失,出现了大量的空泡现象,而在饲料中添加脂肪酶和乳化剂后,HLEE 组罗非鱼肝脏中肝细胞形态相对正常,细胞核位于细胞中间,仅见少量细胞出现空泡现象,LLEE 组罗非鱼肝脏中肝细胞索清晰,肝细胞形态正常,细胞核均居于细胞中间,未见空泡现象。

图2 罗非鱼肝脏组织学观察(×200,N:细胞核;NM:核偏移;V:空泡)
3 讨论
3.1 脂肪酶和乳化剂联合应用对罗非鱼生长性能、饲料利用的影响
脂肪酶和乳化剂是脂肪代谢中必不可少的两种消化物质,很多研究已经表明,在饲料中添加外源脂肪酶和乳化剂可以有效改善养殖动物的生长性能,促进其快速生长[16-18]。本试验研究结果也表明,在两种不同脂肪水平的罗非鱼饲料中添加脂肪酶和乳化剂,罗非鱼的增重率较对照组分别提高了6.77%、9.51%,特定生长率分别提高了3.75%、5.18%,而且在低脂肪水平饲料中添加脂肪酶和乳化剂后,罗非鱼的增重率和特定生长率均达到了甚至超过了高脂肪水平组,这说明脂肪酶和乳化剂的添加具有一定的节约饲料中脂肪的作用,意味着可以通过添加脂肪酶和乳化剂,在不影响罗非鱼生长性能的情况下,适当降低饲料中的脂肪水平。
从理论上讲,乳化剂除了可减少脂肪在分解过程中的表面张力,使分散体系的势能下降,加速乳化过程外,还可以提高消化道乳糜微粒的数量,使乳糜微粒能与脂肪酶充分接触,而脂肪酶可以促进脂肪的消化,提高其吸收效率,因而二者联用可以提高脂肪的消化吸收率。在本试验中,脂肪酶和乳化剂的联合应用显著提高了高脂肪组饲料的蛋白质效率,降低了不同脂肪水平罗非鱼的饲料系数。该结果与谷金皇等[19]的研究结果类似,他发现在黄颡鱼饲料中添加不同浓度的外源脂肪酶,对蛋白质效率没有产生显著的影响,而显著降低了饲料系数。这表明脂肪酶和乳化剂的添加对饲料利用的影响可能与饲料的配方结构、饲料的营养水平有关,这还有待进一步研究。
3.2 脂肪酶和乳化剂联合应用对罗非鱼内源消化酶活性的影响
消化酶的活性影响鱼对营养物质的消化吸收,决定生长速度。而肠道内容物中消化酶的活性反映了酶分泌与降解的动态平衡[20]。谷金皇[21]在黄颡鱼中的研究发现,脂肪酶的添加均可以显著提高胰蛋白酶和肠淀粉酶活性,100 mg/kg 的脂肪酶组还显著提高了胰脂肪酶和胰淀粉酶活性。Liu 等[22]报道,在草鱼饲料中添加脂肪酶可以显著提高肝脏和肠道蛋白酶、脂肪酶和淀粉酶活性。本试验的研究结果表明,脂肪酶和乳化剂的添加显著增加了HLEE组和LLEE组罗非鱼胃、肝、肠中蛋白酶的活性。而与王国霞等[23]的研究发现在花鲈饲料中添加外源脂肪酶对中肠和肝中的消化酶活性没有影响不一致。这些研究结果不尽一致,可能与动物(种类、年龄、生理状态等)、饲料组成、环境条件等诸多因素有关[24],也可能与酶制剂来源、添加的剂量以及本身的一些特性有关。
3.3 脂肪酶和乳化剂联合应用对罗非鱼生化指标的影响
ALT 和AST 主要存在于肝细胞内,肝细胞受损时,细胞膜通透性增强,细胞内释放ALT和AST,从而提高了血清中ALT 和AST 的活性,因此血清ALT 和AST的活性在一定程度反映了肝脏的健康程度[25]。血清中的ALP 主要来自肝脏,当肝脏发生病变时,血清中ALP的活性也会出现增高,因此在临床上也常用来衡量肝脏是否受损[26]。本试验中,无论是在高脂肪饲料还是在低脂肪饲料中添加脂肪酶和乳化剂都显著降低了血清中AST 和ALP 的活性。这说明了脂肪酶和乳化剂的添加有利于提高鱼体肝脏的健康状况。
TCHO、TG、LDLC、HDLC是反映机体脂肪代谢的重要指标[27]。谷金皇等[19]发现在黄颡鱼饲料中添加100~500 mg/kg 的脂肪酶可以降低黄颡鱼血清中TCHO、TG、LDLC 的含量。本试验中,脂肪酶和乳化剂在饲料中的添加,除了显著提高了高脂肪组TG 的含量外,其他指标均值出现了下降的趋势,这说明脂肪酶和乳化剂的添加有一定的促进脂肪代谢的作用,但是要进一步提高此效果,还有待深入研究。
血清GLU 是评估糖代谢的重要指标。血糖的来源有二:进食后淀粉在肠内水解生成的葡萄糖由门静脉吸收进入血液;肝糖原分解为葡萄糖是禁食时血糖的来源[27]。本研究表明,脂肪酶和乳化剂的添加有提高禁食时血糖的趋势,但与对照组差异不显著,这可能与添加量不足有关。
血清ALB和总蛋白TP可以反映蛋白质在机体内的代谢情况[28]。本试验中各组血清ALB 的含量没有受到脂肪酶和乳化剂添加的影响,但是高脂饲料中添加脂肪酶和乳化剂比在低脂饲料中的添加在一定程度上提高了血清TP 的浓度,表明脂肪酶和乳化剂的添加能够提高饲料中蛋白质的吸收。
3.4 脂肪酶和乳化剂联合应用对罗非鱼肝脏抗氧化指标的影响
由CAT、GSH-Px、SOD 等抗氧化酶指标和TAOC、MDA 等非酶指标组成的抗氧化系统在动物维持体内自由基平衡、减少机体的氧化损伤方面发挥着重要的作用[29]。Liu 等[22]的研究表明在罗非鱼饲料中添加不同含量的外源脂肪酶可以上调抗氧化酶的基因表达,从而提高抗氧化酶的活性。在本试验中,饲料中脂肪酶和乳化剂显著降低了HLEE组和LLEE组罗非鱼肝脏中MDA 的含量,而对各组罗非鱼肝脏中GSH-Px 的活性均无显著性影响。这表明脂肪酶和乳化剂的添加对提高罗非鱼肝脏抗氧化能力、减少体内自由基和过氧化物含量、降低脂质过氧化有良好的效果。
3.5 脂肪酶和乳化剂联合应用对罗非鱼肝脏形态的影响
脂肪是鱼类必需营养元素之一,适宜的脂肪水平是保证养殖鱼类正常生长的必要条件,但是饲料中脂肪含量过高又会导致养殖鱼类的脂肪肝病的发生,从而影响到养殖鱼类的健康[30-31]。已有研究表明饲料中脂肪含量在6%~9.35%之间对其生长最为有利[32-34],然而,即使是最适生长水平的饲料脂肪水平,因为加工方式[34]、脂肪源[35]不同等原因仍然会导致肝脏受损。已有研究发现,饲料中添加脂肪60 g/kg 和80 g/kg 会导致肝胰脏肿胀,肝细胞发生病理性改变[36]。本研究的结果也显示,投喂脂肪含量约为75 g/kg 和80 g/kg的饲料,试验罗非鱼的肝脏均出现不同程度的病变。投喂含有脂肪酶和乳化剂的饲料56 d 后,试验罗非鱼肝脏病变情况有了较大程度的改善,这说明脂肪酶和乳化剂的联合使用,能够有效改善罗非鱼肝脏的健康状况。

