浅析药品微生物限度检查法的若干影响因素
母 丹
(重庆市生物技术研究所有限责任公司 重庆 401121)
微生物限度检查法是指检查非规定灭菌制剂及其原、辅料受到微生物污染程度的方法[1]。反映了药品从原料、生产工艺、生产设备、生产环境到实验操作者整个过程的卫生状况。微生物限度指标是否符合《中国药典》第四部中的相关规定直接决定着药品最后合格与否,因而至关重要。下面将对容易引起误差的几个影响因素进行分析。
一、分析资料与方法
(一)检验资料
通过对2015年到2020年五年时间内,1000种药品微生物进行限度检查,其中包含了片剂、颗粒剂、胶囊剂、粉剂。观察这1000种药品微生物限度检查时发生的误差率及分析发生误差的影响因素和分布,结果如下表1:

表1 误差影响因素及分布
由表1显示可知,微生物限度检查的影响因素有很多,具体的影响因素将进一步分析。
二、影响因素的分析
(一)操作环境对微生物限度的影响
微生物限度检查应有单独的洁净室,洁净室内应设有无菌操作台和空气净化系统,应在不低于D级背景下的B级单向流空气区域内进行[2],应定期按要求对洁净室内的洁净度进行验证。微生物内容包括空气中菌落总数、沉降菌、尘埃粒子、浮游菌,操作台面、洁净服微生物的检测等。洁净室内应带有缓冲间,将无菌衣、无菌手套、口罩、鞋套放于缓冲间内,缓冲间的门应及时关闭且不能对开。洁净室内的温度控制在26℃左右,相对湿度控制在40%-60%之间。每次操作前都应打开紫外线灯进行照射杀菌30min,每次操作前后都应用75%的酒精或其他消毒液擦拭操作台及可能污染的死角。操作台应备有天平、酒精灯、火柴、酒精棉球、助吸器等设备。当初次检验结果为阳性需要进一步对阳性菌进行鉴定时,应在单独的洁净区内,不能与供试品在同一个区域,以免引起交叉污染[3]。
当进行阳性菌接种时,整个过程都应该在酒精灯旁完成。接种时按照以下步骤进行:先烧接种环,待稍微冷却及时沾取细菌样品,然后在培养基上划线接种,最后再给接种环灭菌。当接种时有试管时,一定要给试管口及试管帽进行灭菌,防止污染。
(二)设备及用具对微生物限度的影响
实验用所有器皿应按玻璃器皿的清洗方法洗干净烘干备用。用牛皮纸将实验所用器皿包裹密封后放于121℃的高压灭菌锅灭菌30min,灭菌完成后不能立即放置阴冷处,避免因急速冷却使灭菌物品内蒸汽冷凝造成负压易染菌[4],取出后应放置在恒温培养箱中烘干,待用。高压灭菌锅应配有专职人员经培训考试合格后持证上岗使用,避免使用过程中发生危险。所有仪器设备都应该按要求定期校准鉴定,包括所用设备(天平、压力容器、水浴锅、操作台、振摇器、培养箱等),每次使用都应该填写使用记录,并定期进行维护清理。值得注意的是,压力容器的压力表和温度表都应该定期检验,以防温度和压力出现异常而导致灭菌不彻底从而影响实验结果。另外对于一些实验耗材也应该定期校验,如烧杯、移液管或者加液枪,应注意的是使用加液枪前应该对其进行计量验证,以保证实验过程中所加样品量的准确性。
(三)操作人员对微生物限度的影响
检验人员应该经过岗前培训,考试合格后方能上岗,实验过程中要始终按照无菌检查的要求进行。此外操作人员还应该定期进行知识再教育,随时关注行业新动态,学习新的检测标准、方法等。检验人员的无菌服每次都应进行高压灭菌处理,禁止把无菌服穿出洁净区。实验前用肥皂水按照七步洗手法将手洗干净,然后用75%的酒精进行消毒,再戴上无菌手套。在缓冲间内换上衣服,戴上鞋套、口罩然后进入洁净区。检验人员在进入无菌室后不要频繁走动,不能大声喧哗及嬉戏打闹,不要咳嗽及打喷嚏,操作过程中如果需要传递物品,应通过传递仓。无关人员禁止出入无菌室,减少污染机会。操作人员除了专业素养以外,还应该具备一定的人文素养。操作人员本身应该身体健康,不能有皮肤病及一些传染疾病,以防污染实验结果。操作完成后应及时清理操作台及无菌间,避免滋生细菌污染环境。
(四)培养基对微生物限度的影响
1.培养基的储存
实验用培养基的质量,直接影响着实验结果的准确性。现在的培养基基本采用的是脱水培养基,实验人员应严格按照说明书上的条件进行储存,防止培养基吸潮结块。应使用在保质期内的培养基,超过保质期虽未有明显变化但依然会影响实验数据。
2.培养基的配置使用
培养基每次应按照供试品的量决定配置的多少,且只能经过一次高压灭菌。配置好的培养基应保存在2-25℃,避光的环境。灭菌过后的培养基应尽量避免过度加热,以免造成营养成分破坏。使用前的培养基应放置在(50±2℃)的水浴锅或培养箱中,以防培养基在供试品稀释液制备过程中冷凝。按梯度进行制备样品并加入到相应梯度的培养皿中,然后将培养基缓缓倾倒入培养皿中并轻轻转动,以便样品分布均匀。此处培养基的温度最好控制在45℃左右,因为温度过高可能杀死待检品中的细菌,温度过低又会造成凝固。待培养皿内的培养基冷凝后,把培养皿倒置放于符合培养要求的培养箱内进行培养。
3.培养基的检查
实验用的培养基都应按照《中国药典》第四部通则1101无菌检查法中的要求做培养基的无菌性检查,且每批培养基的无菌检查结果必须为无菌生长方可使用。另外还应按此通则做培养基的灵敏度检查,需注意的是用于培养基灵敏度检查的菌株传代次数不得超过5代(从菌种保存中心获得的干燥菌种为0代)[5]。
(五)供试液制备过程对微生物限度的影响
1.供试液的制备
供试品检验的整个过程必须符合《中国药典》中无菌检测的要求。按照被检测菌种相关技术要求,按1∶10的比例称取定量的供试品加入到灭菌后的稀释液中,再放入均质器中振摇均匀,此溶液为10倍供试液。取1ml混合均匀的10倍供试液加入到9ml灭菌后的稀释液中,应用助吸器和移液管反复吹打以混匀,此溶液为100倍供试液。按照100倍供试液的方法制备1000倍供试液,三种溶液制备完成后待用。
2.实验过程
对应三个梯度的供试液准备相应的培养皿,每个梯度需要2个培养皿,计数结果以平均值为准。取1ml上述制备好的供试液加入到相应的培养皿中,需注意每次移取供试液时都应混匀,否则取上清液或沉淀物都将会对实验结果产生影响。然后再倒入15-20ml温度不超过45℃的培养基,并使供试液和培养基充分混匀,防止细菌成片或重叠生产,影响计数。从制备供试液到注入培养基操作人员应该熟练迅速完成,整个过程应尽量控制在1h内,因为操作时间过长会导致微生物繁殖或死亡影响结果计数。供试品、稀释液、培养基必须定量加入,使检查标准化,以便控制实验结果[5],千万不能估量取样。应在与供试品制备相同实验条件下设置阴性对照组且阴性对照组不能生长菌落数,否则本次实验无效。
(六)样品的影响
检测过程中应注意被检样品的特殊性,不同的样品对微生物的影响也会不同。药品对外来微生物的污染可多可少,种类繁多。注意被检样品中抑制微生物生长的成分。根据平时工作经验发现很多药品中有抑制微生物生长的成分,在实验过程中应考虑这一因素。不同样品对温度的感知也会出现差别。有的检品在规定培养温度下的生长较为缓慢,这时就应该延长培养时间来计数更为准确。在抽取被检样品时应具有随机性、代表性、可疑性。
(七)菌种及菌落计数
不同菌种培养的时间和条件会有所不同,应按相关技术规定培养。菌种计数是以肉眼直接点计,故要求检验人员仔细观察,可以借用放大镜等外来工具。应选用菌落数在适宜范围内的培养皿来观察计数,并取两个培养皿菌落数的平均值作为该梯度的最后结果。根据药典规定蔓延生长的培养皿不宜计数,检验人员在计数时要注意鉴别培养基的气泡、供试品沉淀物、颗粒等,应注意培养基边缘的菌落,以防多计或漏计影响实验结果。当培养基中菌落数较多不易点计时,可将培养基平均分为四个区域,计数其中一个区域的菌落数然后乘以四作为该平板的最后计数结果。
计数时应注意平板边缘和琼脂内的菌落,以防漏记。计数过程中遇到有争议时可以用放大镜观察或者在低倍显微镜下直接观察,亦可挑取可疑菌落涂片后镜检,也可以适当地延长培养时间以便观察计数。
实验过程中,应严格按照规定的时间进行培养。但是当出现蔓延生长趋势时,菌落总数点计要从24小时开始观察计数,霉菌、酵母菌从48小时开始观察计数,最终结果菌落总数还是以48小时计数结果为准,霉菌、酵母菌以72小时计数结果为准。
(八)实验注意事项
微生物限度检查的实验中,操作人员应注意以下几点:
1.微生物限度检查不允许复测,均以第一次实验结果为准。
2.供试品取样应具有代表性,应按照相关规定的方法取样再加以混合。
3.整个实验过程要牢记无菌观念,以防外来污染。
4.实验中应做好标记,以防混淆。
5.片剂应用灭菌烘干的乳钵研磨成粉末后再检测;胶囊剂应加入45℃的稀释液中并且放置在水浴中保温、振摇,使胶囊充分溶解后再进行检测;凝固很快的样品应在加快操作者的速度,必要时可以考虑加大稀释倍数。
6.实验室所用的纯净水应该定期检验,应符合实验用水要求,每次实验的器皿应及时清洗,实验室所用消毒剂应经常更换,以防产生耐受菌。
7.为了保证实验结果的准确性,在对药品进行微生物检查实验前应对检测方法进行验证。
三、实验设计
待测样品:100g/袋破壁灵芝孢子粉
检测项目:菌落总数、霉菌、酵母菌、大肠菌群
试剂:平板计数琼脂培养基 无菌生理盐水
实验步骤:1.称取25g样品加入到225ml生理盐水的无菌均质杯中,1000r/min均质2min,制成1∶10的样品匀液。2.用1ml的无菌加样器吸取1ml1∶10的样品沿着杯壁缓慢加入到含有9ml生理盐水稀释液的试管中,震荡试管制成1∶100的样品匀液。注意加样时吸头不要接触稀释液面。3.按照“2”的方法制备10倍稀释液,得1∶1000的样品匀液。没增加一个梯度的稀释液注意标记以防混淆,不同梯度需要换一个吸头以防污染。4.分别吸取1ml制得的三个梯度稀释液注入到无菌平皿中,每个梯度2个平皿。再分别吸取1ml生理盐水注入到2个空白无菌平皿中,作为空白对照。各梯度平皿应做好标记。5.迅速倾倒15-20ml冷却到45℃±1℃平板计数琼脂培养基,缓缓转动平皿使其混合均匀。6.待琼脂凝固后,将平板翻转于36℃±1℃生化培养箱中培养48h±2h。7.选取菌落数在30CFU-300 CFU之间的,无蔓延菌落生长的平皿计数菌落总数。低于30CFU的记录实际菌落数,大于300CFU的可计为多不可计。每个稀释度的采用两个平皿的平均值作为最终计数。8.按照菌落总数的操作方法同理操作霉菌和酵母菌,培养基用孟加拉红培养基;大肠菌群用无菌试管替代平皿,培养基用月桂基硫酸盐胰蛋白胨。
菌落总数实验结果如下表2

稀释度 10-1 10-2 10-3 空白菌落数 10 8 1 1 0 0 0 0平均数 9 1 0 0检验结果(CFU/g) 90
霉菌、酵母菌实验结果如下表3
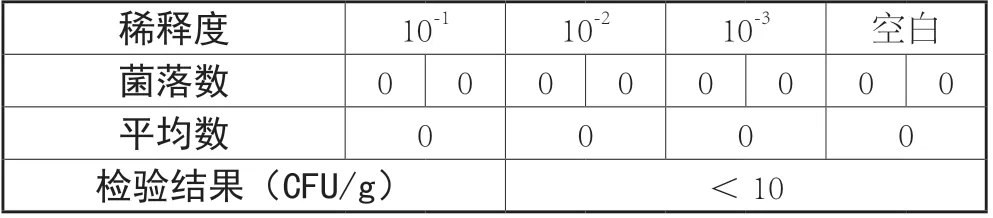
稀释度 10-1 10-2 10-3 空白菌落数 0 0 0 0 0 0 0 0平均数 0 0 0 0检验结果(CFU/g) <10
大肠菌群实验结果如下表4

稀释度 LST BGLB 0.1mL(g)×3 - - -0.01mL(g)×3 - - -0.001mL(g)×3 - - -检验结果MPN/100g <0.3
四、结论
综上所述,微生物限度检查的结果受多方面因素的影响,从环境、设备、人员到培养基、供试品、菌种及菌落计数等,每一个环节都有可能影响微生物的最终结果,因此加强对微生物限度检查实验过程的质量控制显得尤其重要,也是今后实验中保证实验结果准确性的一个重要手段。

