藜麦不同生长时期内生细菌群落结构分析
谭佳淇,何小慧,赵江林,李丽娇,涂文应,鲍志杰,李 强
(成都大学食品与生物工程学院 农业农村部杂粮加工重点实验室,四川 成都 610106)
0 引 言
藜麦(Chenopodium quinoaWilld)原产于南美洲,是一种富含蛋白质、淀粉、脂肪、矿物质、维生素的高价值谷物[1]。联合国粮农组织(FAO)确认藜麦是一种可满足人体全部营养需求的单体粮食作物,美国航天局(NASA)将藜麦列为理想“太空粮食”[2-5]。藜麦中的多酚、黄酮、皂苷等活性成分具有抗氧化、降血糖、消炎、抑菌、免疫等生物活性,对心血管疾病、肥胖、糖尿病等有很好的预防效果[2]。植物内生菌是指生活史一定阶段或全部阶段生活于健康植物的组织或器官内部的微生物,包括真菌、细菌和放线菌等[6]。植物内生菌与植物在长期的协同进化过程中,形成了互利共生关系:宿主植物为内生菌的生存繁殖提供了稳定的生活环境,而内生菌可增强宿主植物的抗病、抗旱和固氮等能力,也可产生次生代谢产物促进植物的生长发育[7-8]。此外,植物内生菌次生代谢产物还具有抗菌、抗肿瘤、抗病毒、抗氧化、杀虫、免疫抑制和降糖等活性[9]。
国内引种藜麦的时间较短,关于藜麦内生菌的群落结构、多样性和次生代谢产物等还不够了解。因此,解析藜麦内生微生物的群落结构,了解其内生菌的优势种群,将为藜麦的栽培和分离筛选有益微生物打下基础。目前,已有学者采用高通量测序技术揭示了连作藜麦土壤细菌群落结构和多样性变化,但尚未见藜麦不同组织间内生微生物群落结构和多样性变化的相关报道[10]。随着高通量测序技术的发展,学者们可以直接获取自然环境中微生物的遗传信息,利用生物信息学分析手段对序列进行比对分析, 从而获得不同物种的多样性和丰度信息[11-12]。与传统的第一代测序方法相比,16S rRNA高通量测序具有操作简便,提供的遗传信息丰富等特点,具有广阔的应用前景[13-16]。本试验采用高通量测序技术,以藜麦作为研究对象,分析了藜麦不同生长时期、不同部位(根、茎、叶、籽粒)的微生物种群丰度和多样性变化,对于藜麦的栽培提供了一定的理论参考。
1 材料与方法
1.1 样品采集
藜麦幼苗期和成熟期样品2019年采集于成都大学栽培试验基地,分别采集3株藜麦幼苗和3株成熟藜麦的根、茎、叶,装于无菌封口袋中,保存于冰盒,带回实验室用于后续分析。后文分别采用MR、MS、ML、 MSpike、YR、YS、YL 代表藜麦成熟期根部、成熟茎部、成熟期叶部、籽粒、幼苗期根部、幼苗期茎部和幼苗期叶部样品编码。
1.2 样品前处理
根据刘金花[17]的方法将藜麦样品叶切成 1 cm2,茎和根切成 1 cm 左右小段(两端皆有切口)。然后将根、茎、叶、籽粒分别用 75% 酒精浸泡 1 min ,1%次氯酸钠溶液(含游离氯>2.5%)浸泡10~15 min,75% 酒精再浸泡 1 min,之后用无菌水冲洗 5遍进行表面消毒,并用最后一次淋洗的无菌水涂布到LB平板上30 ℃培养24 h检测表面消毒效果。
1.3 DNA提取及PCR扩增
采用 CTAB方法对样本的基因组 DNA 进行提取,之后利用1%琼脂糖凝胶电泳检测提取的DNA。以提取的基因组DNA为模板,根据测序区域的选择,使用带 Barcode 的特异引物进行扩增。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测。
1.4 文库构建及上机测序
使用 TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行测序文库构建,构建好的文库经过Qubit和Q-PCR定量,文库库检合格后,使用Hiseq进行上机测序。藜麦内生菌样本高通量测序委托北京诺禾致源生物公司完成。数据下机后分析藜麦内生菌的α和 β多样性。
2 结果与分析
2.1 稀疏曲线分析
为探究检测样本α多样性指数随着测序深度的变化趋势,以评价实验测序深度能否充分反映所测样本的微生物多样性情况,根据观察到的物种数与测序条带数绘制稀疏曲线如图1所示。由图可知所有样本检测到的物种数随着测序条带数增加至期的根部细菌Observed species指数、Shannon指数和Chao1指数均显著高于藜麦幼苗期(P< 0.05);成熟期和幼苗期的藜麦根部细菌Observed species指数、Shannon指数、Simpson指数和Chao1指数显著高于成熟期和幼苗期的藜麦茎、叶细菌(P< 0.05)。图2所示箱线图则是不同样本Alpha多样性指数的直观展示,各指数大小通过中位线高低判断。由表1和图2可知,整体上成熟期的根、茎、叶多样性指数50000时,虽物种数目仍然有所增加,但整体曲线势均趋于平缓,说明实验所测样本能充分地反映真实情况下藜麦样品绝大部分细菌的群落多样性。
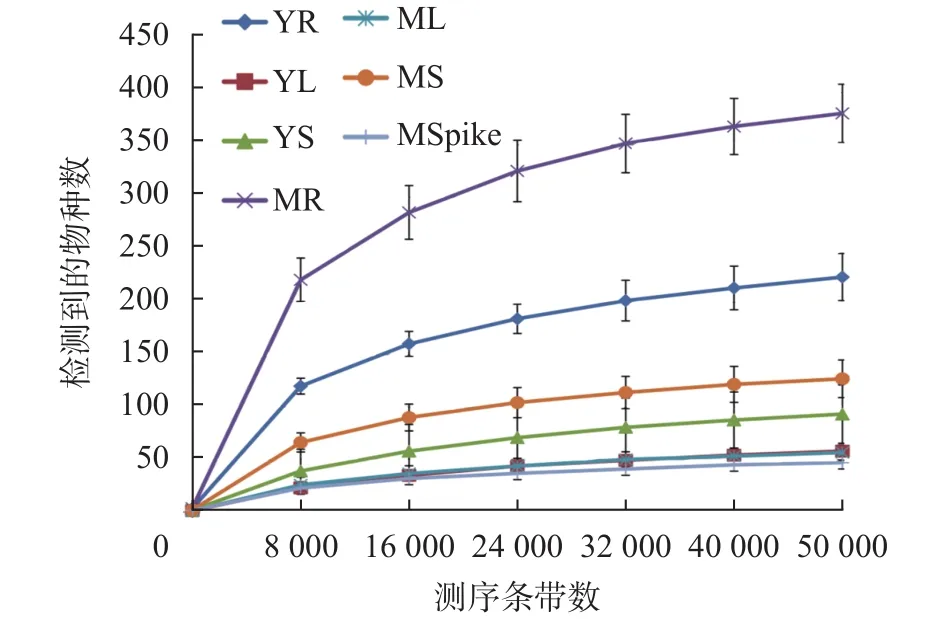
图1 样本稀疏曲线
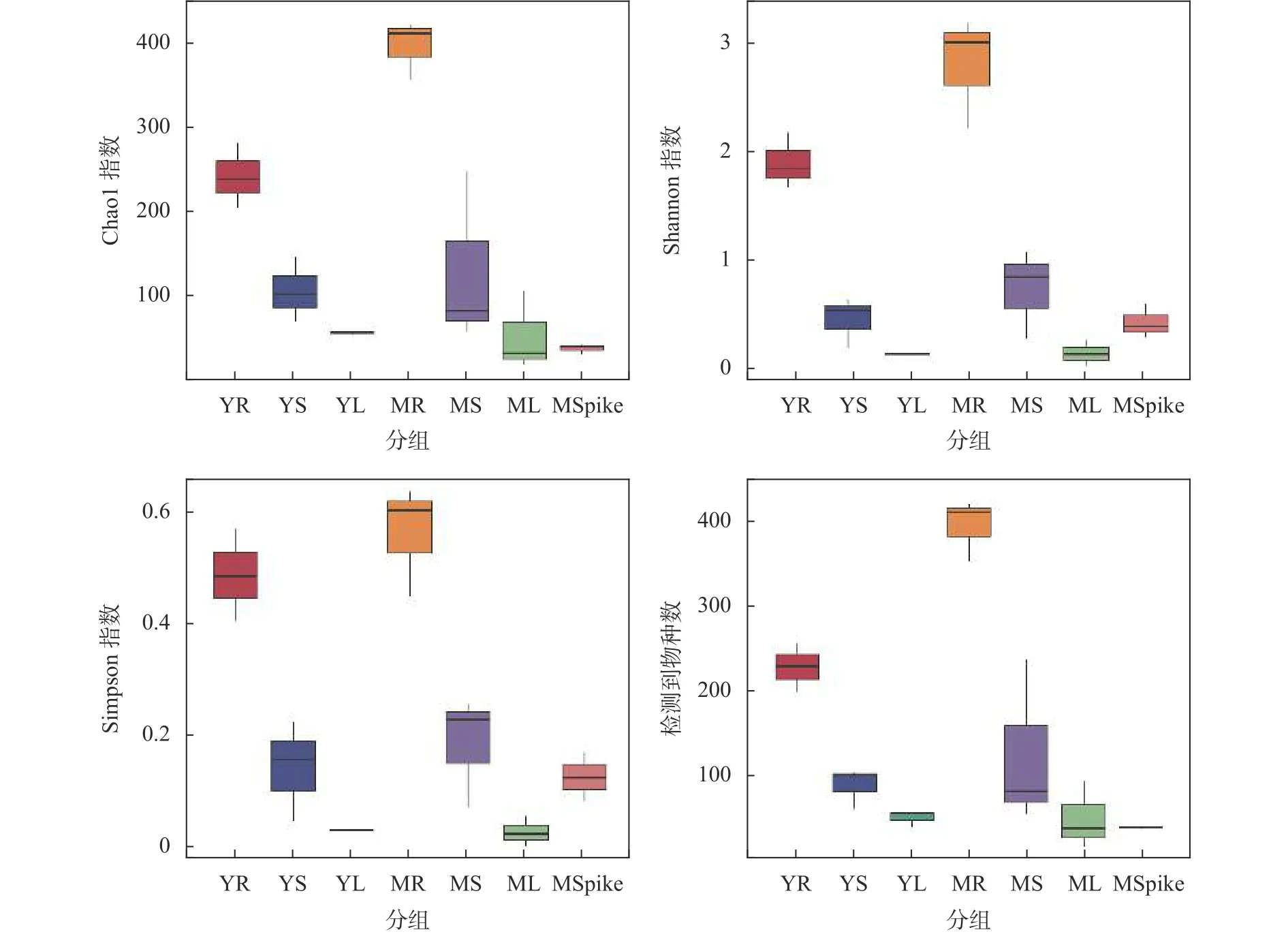
图2 多样性指数分组箱线图
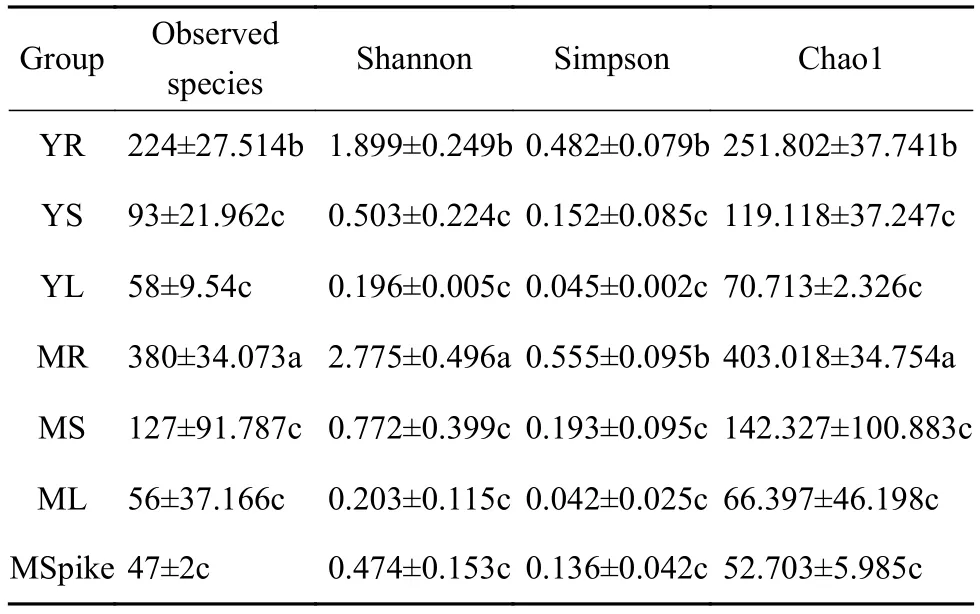
表1 藜麦微生物多样性指数表1)
2.2 藜麦样品Alpha多样性分析
对各藜麦样品的微生物多样性指数进行统计计算,选取Chao1指数[18],Shannon指数[19]和Simpson指数[20]来表征藜麦微生物群落的Alpha多样性。如表1所示,指数数据越大,表明其相对微生物多样性和丰富度越高。单因素方差分显示,藜麦成熟相对幼苗期较大,说明藜麦成长过程中其内生菌与藜麦在协同进化过程中,其微生物多样性会增加,导致成熟期微生物多样性明显高于幼苗期。对比不同部位多样性指数发现,无论是成熟期还是幼苗期,均呈现根部远高于茎部,叶部最低的现象。呈现距离地面土壤越近,微生物多样性指数越高的趋势,推测可能藜麦生长过程中越靠近土壤内生微生物越容易附着生长,而越靠近土壤,根系土壤中的部分微生物种群进入到植物根部定植,导致微生物多样性高。
2.3 藜麦群落结构组成分析
如图3所示,对藜麦样品丰度前10的门进行注释,整体上看各样本蓝细菌门(Cyanobacteria)占比最大,各样本中丰度均超过60%,其次是变形菌门(Proteobactrtia)和放线菌门(Actinobacteria),这三类细菌是藜麦主要的内生菌。对比不同位置丰度发现,蓝细菌门(Cyanobacteria)呈现叶部>茎部>根部的趋势,而变形菌门(Proteobactrtia)则呈现相反的叶部<茎部<根部的趋势,而放线菌门(Actinobacteria)仅在根部含有且占据一定比例丰度,说明根茎叶主要内生菌存在较大差异。而籽粒内生菌情况则与茎部较为相似。对比成熟期和幼苗期相同位置的内生菌情况发现,相同位置主要内生菌结构大体相似,并未呈现明显差异,但成熟期内生菌种类明显较幼苗期更为丰富,这与前文Alpha多样性分析结论一致。综上表明,不同位置群落结构会出现较为明显的分化情况,且分化呈现一定规律,但成熟期和幼苗期的群落结构除内生菌种类明显增加外并未出现明显分化。
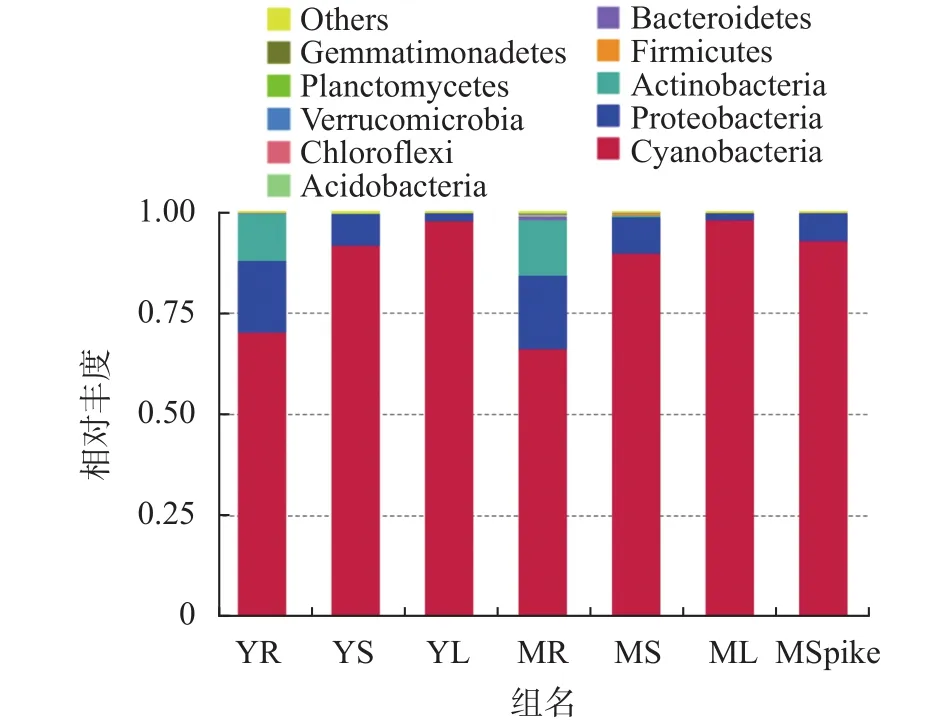
图3 门水平群落结构
如图4所示,对藜麦样品丰度前10的属进行注释。整体上看成熟期其他种属(others)的内生细菌含量高于相同部位的幼苗期藜麦,表明幼苗期藜麦内生菌的种群丰度较为集中。Cyanobacteria和Rickettsiales中的未知属以及链霉菌属(Streptomyces)是藜麦样品中丰度最高的内生菌,各样本中丰度均超过60%。成熟期内生菌群落结构与幼苗期并未出现明显分化,Cyanobacteria中的未知属呈现叶部>茎部>根部的趋势,Rickettsiales中的未知属呈现相反的叶部<茎部<根部的趋势。

图4 属水平群落结构
链霉菌属(Streptomyces)和拟无枝菌酸菌属(Amycolatopsis)是根部丰度较高的内生菌种群。链霉菌属(Streptomyces)和拟无枝菌酸菌属(Amycolatopsis)广泛分布在土壤中,是重要的产抗生素的细菌。Igarashi[21]等从韭菜中分离得到的链霉菌,其发酵后可产生生物碱类活性化合物6-Prenylindole,能有效控制尖孢镰刀菌 (Fusarium oxysoorum)的生长。Pullen[22]等从卫茅科植物中分离出西唐链霉菌(S. setonii)和桑氏链霉菌(S.sampsonii),其产生的抗生素氯吡咯对耐药细菌抗性明显。McCormick[23]等于1956年从印度尼西亚土壤中筛选到的东方拟无枝酸菌(Amycolatopsis orientalis)的发酵液中分离得到万古霉素,万古霉素是临床上极为重要的糖肽类抗生素[24]。结合前文分析中根部微生物丰富度明显高于茎部和叶部。由此推测正是由于藜麦根部含有较高丰度的链霉菌属(Streptomyces)和拟无枝菌酸菌属(Amycolatopsis)等产抗生素的细菌,它们共同形成了保护藜麦内部生态系统免受其他有害菌的微生态屏障,将大量不利于藜麦生长发育的微生物拦截在根部以下,从而保证了藜麦植株的茎叶内生菌系统的稳定,从而使得藜麦生长发育过程中免受致病菌等有害微生物的侵害。
物种丰度热图可以直观地观察菌群丰度差异,颜色越红代表菌群丰度越大,颜色越蓝代表菌群丰度越小。对藜麦样本进行属水平热图分析(见图5)发现,链霉菌属(Streptomyces)、拟无枝菌酸菌属(Amycolatopsis)、立克次体目中未识别的属(unidentified-Rickettsiales)、马赛菌属(Massilia)等各类内生菌含量在根部相对较高,而在茎部和叶部含量小,则代表根部这些菌群的丰度高于茎部和叶部。对比发现,成熟期的根部氏菌属(Bosea)、柄细菌属(Caulobacter)、溶杆菌属(Lysobacter)、鞘氨醇盒菌属 (Sphingopyxis)、德沃斯氏菌属(Devosia) 等较幼苗期根部各类内生菌含量更高,说明随着藜麦的生长发育,这些种群内生菌得到了富集。此外,根部链霉菌属(Streptomyces)和拟无枝菌酸菌属(Amycolatopsis)在成熟期和幼苗期的根部均保持了较高水平丰度,表明其可能在藜麦根部发挥重要生理、生态作用。
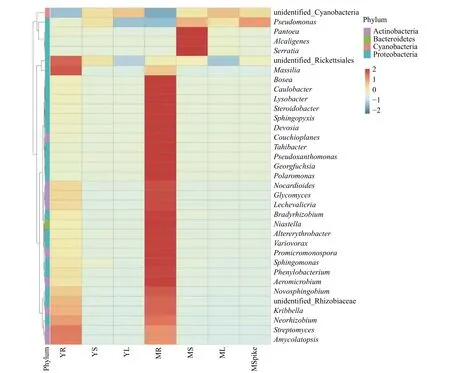
图5 属水平物种丰度热图
用 UPGMA 算法以 Weighted Unifrac Distance为度量进行聚类分析,聚类结果如图6所示。聚类结果与PCA和PCoA聚类结果一致,成熟期和幼苗期相同位置群聚类相近,整体上根部和根部以上(茎、叶、籽粒)聚分为2大类。进一步细分根、茎、叶被分别聚为三类,符合前文不同部位之间分化差异较大的结论。其中籽粒与茎部聚为一类,说明籽粒内生菌群落结构和茎部有较大相似性。
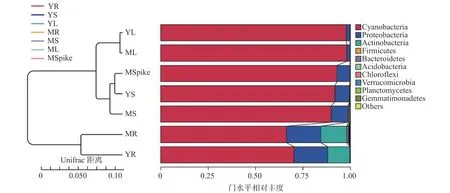
图6 UPGMA聚类图
3 结束语
内生菌在寄主植物生长发育中扮演了重要的角色[25-28],同时也会参与到寄主的生长代谢,生物合成和抑菌等生命活动中,对其寄主植株的生长发育和产品品质有着重要影响,因此研究植物内生菌对于农业生产有着重要意义。藜麦是我国重要的农作物,但目前关于藜麦内生菌的报道较为少见,本文对成熟期和幼苗期藜麦的根部、茎部、叶部以及籽粒进行取样,采用16 s高通量测序技术对其内生菌进行分析。并对分析了不同部位和不同生长时期之间藜麦内生细菌群落结构差异,对其中关键内生菌进行了分析,主要结论如下:
藜麦成熟期的根部细菌Observed species指数、Shannon指数和Chao1指数均显著高于藜麦幼苗期(P<0.05);成熟期和幼苗期的藜麦根部细菌Observed species指数、Shannon指数、Simpson指数和Chao1指数显著高于成熟期和幼苗期的藜麦茎、叶细菌(P<0.05);藜麦不同位置内生菌差异较大,不同时期内生菌未出现明显分化。根部内生菌多样性和群落结构与茎部、叶部、籽粒存在较大差异,根部内生菌的丰度、内生菌种类均远高于茎部、叶部、籽粒部分,而茎部、叶部、籽粒之间则差异较小,籽粒内生菌结构与茎部最为相似;对比不同位置丰度发现,蓝细菌门(Cyanobacteria)呈现叶部>茎部>根部的趋势,而变形菌门(Proteobactrtia)则呈现相反的叶部<茎部<根部的趋势。无论是成熟期还是幼苗期藜麦茎部和叶部群落结构均较为稳定,由于藜麦根部含有较高丰度的链霉菌属(Streptomyces)和拟无枝菌酸菌属(Amycolatopsis) 等产抗生素的细菌,它们共同维持了藜麦植株的茎叶内生菌系统的平衡,从而使得藜麦生长发育过程中拥有优良的抗菌性和环境适应性。

