副干酪乳杆菌抑制动脉粥样硬化进展的作用及其机制
王小惠,白新秀,朱姗姗,刘鲁笛,赵雅文,杨嘉璐,夏 敏
(中山大学公共卫生学院,广东广州 510080)
动脉粥样硬化(atherosclerosis,AS)及其所导致的心血管疾病(cardiovascular diseases,CVD)已经成为严重危害人类健康的重大非传染性疾病。据世界卫生组织(WHO)统计的数据显示,2016 年大约有1 790 万人死于心血管疾病,占全球总死亡人数的31%[1]。动脉粥样硬化是由脂质、血管内皮细胞、单核来源的巨噬细胞、T 细胞、血管平滑肌细胞等多因素共同参与的慢性炎症性疾病[2-4],但由于其发病机制错综复杂,目前尚未完全阐明,仍然缺乏有效的预防及治疗措施。肠道菌群指的是定植在宿主肠道内的所有微生物群落,人类肠道细菌群的微生物体数量可达1014[5]。肠道菌群在调节宿主机体营养、代谢和免疫方面发挥了重要作用。以往多项研究表明,肠道菌群失调与多种代谢性疾病有关,包括肥胖、糖尿病、非酒精性脂肪肝、心血管疾病[6-8]。膳食干预调节肠道菌群及其代谢物是防治心血管疾病的重要手段。副干酪乳杆菌属于厚壁菌门、杆菌科、乳酸杆菌属,广泛存在于人体肠道和口腔中,是一类常用于发酵乳制品和蔬菜制品的益生菌[9]。研究结果显示,副干酪乳杆菌具有一系列有益于机体健康的作用,在多种慢性代谢性疾病如肥胖、2 型糖尿病、非酒精性脂肪肝、肠易激综合征等的转归方面发挥了重要的作用[10-13]。目前,关于副干酪乳杆菌延缓动脉粥样硬化进展的作用及其具体的作用机制尚未清楚,需要进一步的研究验证。本研究拟通过高脂高胆固醇饮食喂养ApoE-/-小鼠,建立动脉粥样硬化小鼠模型,进而通过副干酪乳杆菌干预,观察ApoE-/-小鼠动脉粥样硬化斑块的面积、动脉局部的炎症反应程度、巨噬细胞脂质蓄积,探讨副干酪乳杆菌抑制动脉粥样硬化的作用及其可能的分子机制。
1 材料与方法
1.1 实验动物
雄性SPF 级ApoE-/-小鼠(C57BL/6)30 只,6 周龄,采购于北京维通利华实验动物技术有限公司,实验动物使用许可证号:SYXX(粤)2017-0080,动物房温度(22±2)℃,湿度(45±15)%,适应性喂养2周后进行实验。
1.2 仪器与试剂
正常对照饲料(1010009,3 616 kcal/kg)采购于江苏省协同生物医药工程有限责任公司,高脂高胆固醇饲料(B12790D,4686kcal/kg)采购于RD 公司;总胆固醇(total cholesterol,TC)、总甘油三酯(total triglyceride,TG)高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)试剂盒购自南京建成生物工程研究所;CD36 抗体(sc-9154)、SR-A 抗体(sc-20444)均采购自Santa Cruz 公司,脱脂奶粉、二氟乙烯膜、ECL 发光试剂盒、甘氨酸、丙烯酰胺、N,N’-甲叉双丙烯酰胺、十二烷基磺酸钠、四溴苯酚磺酞、过硫酰胺、四甲基乙二胺、油红O粉末均采购于Sigma-Aldrich公司。
冰冻切片机CM1950型(Leica 公司)、正置立体式显微镜M125 型(Leica 公司)、激光共聚焦显微镜TCS SP5 型(Leica 公司)、荧光酶标仪Infinite F200型(Tecan公司)。
1.3 副干酪乳杆菌的培养
副干酪乳杆菌(DSM 20207)采购于德国DSMZ菌库,培养基采用ATCC Medium 2431培养基,将培养获得的菌体以每5×109CFU 用200 μL 含终浓度为10%甘油的无菌PBS重悬后,-80 ℃冻存备用。
1.4 动脉粥样硬化模型小鼠的建立
ApoE-/-小鼠随机分为3 组,每组10 只,分别为正常饲料对照组、模型组和副干酪乳杆菌干预组。除正常饲料对照组外,其余各组均采用高脂高胆固醇饲料喂养12 周建立动脉粥样硬化斑块模型,高脂高胆固醇饲料的配方为20%蛋白质、50%碳水化合物、21%脂肪、0.21%胆固醇。模型组每天灌胃无菌磷酸盐缓冲溶液,灌胃体积为200 μL,副干酪乳杆菌干预组每天灌胃5×109CFU 的副干酪乳杆菌,灌胃体积为200 μL,连续干预12周。
1.5 葡萄糖耐量实验
在干预满12 周时,各组小鼠禁食14 h 后测定禁食血糖并称量体质量,每只小鼠经皮下注射1.5 mg/g 体质量的葡萄糖溶液,并分别在注射后的15 min、30 min、60 min、90 min、120 min 测定小鼠的血糖并记录。
1.6 小鼠腹腔巨噬细胞的提取
在各组小鼠饲养结束前3 d,分别腹腔注射2 mL 3%的巯基乙醇酸钠培养基以使巨噬细胞向腹腔聚集;用14 mg/mL 的戊巴比妥钠麻醉后处死,75%酒精消毒后转移至超净台中,用预先高压灭菌的眼科剪及眼科镊小心剪开并暴露小鼠的腹膜;使从小鼠左下腹部腹膜处缓慢注入预冷的含1%胎牛血清的PBS 缓冲液。用10 mL 无菌注射器从小鼠腹膜中部缓慢吸出细胞悬液并用70 μm 的滤膜过滤后收集于50 mL无菌离心管中;重复以上过程2-3 次以尽可能多的收集小鼠腹腔巨噬细胞。4 ℃,200×g离心5 min 收集到的巨噬细胞悬液,重悬巨噬细胞,测定细胞悬液的密度并进行调整。以1.5×107的密度将细胞接种于细胞6 孔板中,以5×105的密度将细胞接种于共聚焦皿中。在含5%二氧化碳的细胞培养箱中37 ℃培养4 h。小心弃掉培养皿中的培养基并用无菌PBS 轻柔冲洗培养皿3 次,去除未贴壁的细胞。加入RPMI 1640 完全培养基后继续在细胞培养箱中培养24 h。
1.7 腹腔巨噬细胞胆固醇外流能力的测定
取出在细胞培养箱中培养了24 h 的小鼠腹腔巨噬细胞弃掉培养基,并用温热的无菌PBS 洗3 次后加入含终浓度为1 μg/mL NBD-胆固醇的无酚红PRMI 1640 培养基孵育6 h;然后,用温热的无菌PBS 洗3 次后分别加入含终浓度为50 μg/mL apo AI、50 μg/mL HDL的无酚红PRMI 1640培养基孵育6 h 诱导巨噬细胞胆固醇外流,孵育结束后收集培养基于1.5 mL 的离心管中。然后,用温热的无菌PBS 洗3 次后加入200 μL RIPA 裂解液裂解细胞30 min 后收集细胞裂解液,在常温条件下100×g离心10 min 去除细胞碎片。分别取100 μL 细胞裂解液上清液和细胞培养基于黑底96 孔板中,采用荧光酶标仪测定样品中NBD-胆固醇的荧光强度。胆固醇外流率为孵育6 h后细胞培养液的荧光强度与6 h后细胞培养液的荧光强度加上细胞裂解液的荧光强度的比值,需要用不含NBD-胆固醇的PRMI 1640的培养基及RIPA裂解液做空白校正。
1.8 腹腔巨噬细胞中性脂肪蓄积的测定
将已在细胞培养箱中培养24 h 的小鼠腹腔巨噬细胞弃掉培养基,并用40 g/L 多聚甲醛固定20 min,弃掉固定液并用PBS 缓冲液洗2 次;然后,用Bodipy495/503 染色工作液(1:1 000),37 ℃避光染色30 min,PBS 洗2 次,最后用DAPI(1:500),37 ℃避光染色30 min,染色结束后弃掉染液,最后用PBS 洗2 次,并加1 mL PBS 缓冲液保持细胞的湿润状态,于共聚焦显微镜下观察并拍照。
1.9 腹腔巨噬细胞胆固醇的吞噬
取出在细胞培养箱中培养了24 h 的小鼠腹腔巨噬细胞弃掉培养基,并用含10 μg/mL Dil-ox-LDL 的PRMI 1640 基础培养基干预6 h,干预结束后弃掉培养基并用PBS 缓冲液清洗细胞3 次,然后用40 g/L 多聚甲醛常温固定细胞20 min,固定结束后再次用PBS 缓冲液清洗细胞3 次,最后用DAPI(1:500),37 ℃避光染色30 min,染色结束后弃掉染液,最后用PBS洗2次,并加1 mL PBS缓冲液保持细胞的湿润状态,于共聚焦显微镜下观察并拍照。
1.10 酶法检测血脂水平
小鼠血液样品于4 ℃条件下800×g离心20 min,收集小鼠血清,按照试剂盒的说明及操作流程加入相应的试剂反应进行血清总胆固醇(total cholesterol,TC)、总甘油三酯(total triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)含量的测定。
1.11 心脏组织切片、染色及图像处理
心脏组织用PBS缓冲液充分灌洗掉血液之后,浸润于OCT 组织包埋剂中,放入-20 ℃冰箱中,待组织冷冻成固体状态时置于冰冻切片机中切片,将组织切为10 μm 厚的连续冰冻切片,心脏组织切片常温复温20 min,用40 g/L多聚甲醛固定20 min,于60%异丙醇中浸润20 s;油红O 工作液染色20 min后,将切片置入60%异丙醇中清洗10 s,双蒸水清洗掉浮色后用苏木素染液染色10 s,再次用双蒸水清洗切片,待切片水分风干后,用苏木素返蓝液返蓝2 min,染色结束后,用甘油明胶封片并进行拍照,采用Image J 软件对主动脉窦斑块面积的大小进行定量分析。
1.12 主动脉病理学观察
动物干预结束后,用PBS缓冲液对小鼠心脏进行灌注,利用小鼠体循环的特点,将左心室及脉管系统中的血液充分冲洗干净,使用眼科剪将心脏去除并包埋,在立体显微镜下观察并用显微镊及显微剪小心剥离血管外膜上附着的脂肪及其他组织。剥离干净后,用显微剪小心将血管纵向剖开,并用PBS 缓冲液清洗2 次。用油红O 工作液染色20 min,60%异丙醇清洗20 s,染色结束后将主动脉平铺于黑色方形橡胶板,并用细针固定,于立体显微镜下拍照,以斑块面积占血管面积的百分比代表动脉粥样硬化严重程度的评价指标。
1.13 蛋白质印迹法
蛋白印迹法(western blot,WB)检测巨噬细胞中脂质代谢相关蛋白CD36、SR-A 的表达。细胞进行相应的处理后,PBS洗涤3次,收集细胞,采用RIPA裂解液收集总蛋白并用BCA蛋白定量法测定总蛋白的浓度。进行10%十二烷基硫磺钠聚丙烯酰胺凝胶电泳,采用恒压100 V电转120 min的条件将蛋白转移到PVDF 膜上,用TBST 缓冲液清洗PVDF膜5 min后,用5%脱脂牛奶封闭90 min。用相应的一抗于4 ℃冰箱摇床孵育过夜,洗涤后用二抗在室温孵育1 h。洗涤后采用化学发光法进行显影,使用Image J软件进行各目的蛋白的蛋白净光密度值。
1.14 荧光定量PCR
采用Trizol 法提取中RNA 后,根据Takara 公司逆转录试剂盒RR036A 说明书的方法进行cDNA 的合成。荧光定量PCR 反应步骤参照Takara 公司试剂盒DRR081A 说明书进行,引物序列如表1 所示。在vii A7 Quantitative PCR System(美国Applied Biosystems)进行PCR 反应,以荧光定量PCR 基因表达量q=2-ΔΔCt方法进行计算ABCA1 及ABCG1 基因的相对表达水平。
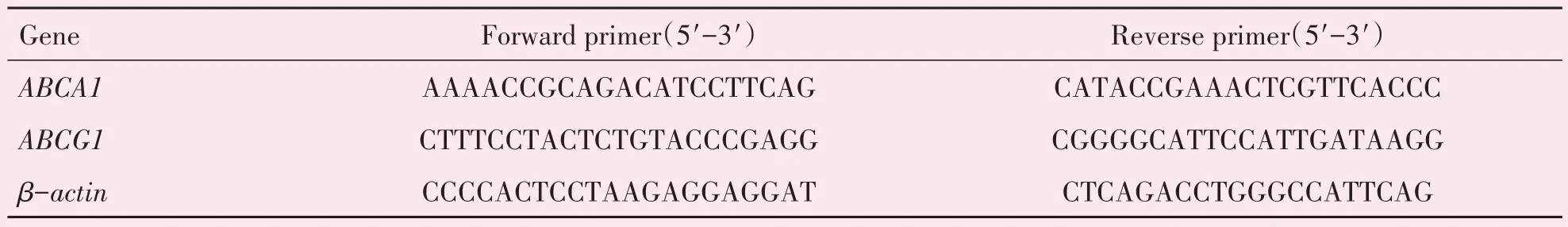
表1 引物序列Table 1 The sequence of primers
1.15 免疫荧光染色
从-80 ℃冰箱中取出主动脉窦切片并常温复温30 min,用PBS 洗涤切片3 次,洗涤结束后,用40 g/L 多聚甲醛固定组织20 min;用PBS 洗涤切片3次,去除残留在组织上的40 g/L 多聚甲醛,于黑色避光湿盒中用5% BSA 室温孵育组织90 min;用PBS 按照1:200 的稀释度稀释F4/80 抗体和α-actin抗体,将抗体工作液滴加到切片组织上,放置于湿盒4 ℃孵育过夜;赋予结束后取出湿盒,室温复温30 min 后,用PBS 洗涤切片3 次,用PBS 按照1:400的稀释度稀释Cy3 标记的荧光二抗,将抗体工作液滴加到切片组织上,放置于湿盒中室温避光孵育60 min;用PBS 洗涤切片3 次,向切片滴加1 μg/mL的DAPI 工作液,放置于避光湿盒中37℃染色30 min;用PBS洗涤切片3次,最后使用抗荧光淬灭剂封片液对切片进行封片后,激光共聚焦进行拍照。
1.16 统计学处理
实验结果计量数据用均数±标准差(±s)表示,采用SPSS 22.0 软件进行处理分析,各组定量资料都呈正态分布并且方差齐性采用单因素方差分析,多重比较采用Tukey HSD;各组定量资料都呈正态分布但不满足方差齐性的情况时采用Welch方差分析,多重比较采用Games-Howell 检验。样本量较小采用Kruskal WallisH检验,P<0.05 定义为差异具有统计学意义。
2 结果
2.1 副干酪乳杆菌干预显著抑制动脉粥样硬化斑块的形成
油红O 染色结果显示,各组小鼠的主动脉窦斑块病变区域面积(F=23.931,P<0.001)、主动脉大体斑块病变面积(F=22.780,P<0.001)的平均水平差异具有统计学意义。与模型组相比,副干酪乳杆菌干预组主动脉大体斑块病变区域面积比例明显下降(P<0.000 1;图1A);另外,与模型组相比,副干酪乳杆菌干预组主动脉窦斑块病变区域面积明显减少(P<0.005;图1C)。
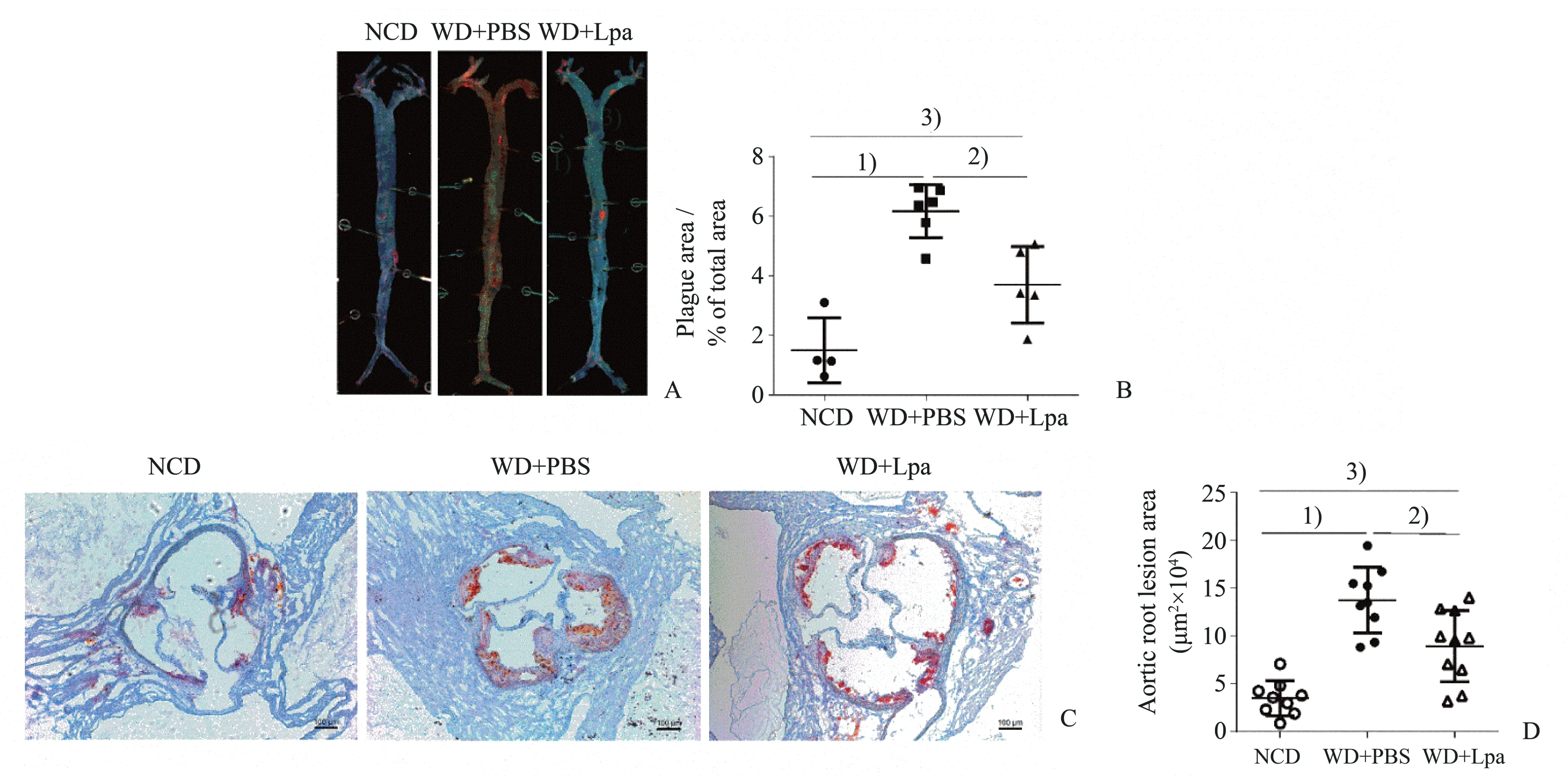
图1 副干酪乳杆菌干预减少高脂高胆固醇饮食诱导的ApoE-/-小鼠动脉斑块的形成Fig.1 Intervention of Lactobacillus paracasei reduced the formation of atherosclerotic plague of Western diet-fed ApoE-/-mice
2.2 副干酪乳杆菌干预改善小鼠血脂谱
实验结果显示,各组小鼠的血清总胆固醇TC(F=12.597,P<0.001)、总甘油三酯TG(F=5.629,P<0.05)、高密度脂蛋白胆固醇HDL-c(F=9.825,P<0.001)及低密度脂蛋白胆固醇LDL-c(F=25.489,P<0.001)平均水平差异具有统计学意义。与对照组相比,模型组小鼠血清总胆固醇TC、总甘油三酯TG、高密度脂蛋白胆固醇HDL-c 及低密度脂蛋白胆固醇LDL-c平均水平均显著升高(均P<0.05);与模型组相比,副干酪乳杆菌干预组的TC、TG、HDLc、LDL-c 的平均水平差异无统计学意义(均P>0.05),但其结果提示副干酪乳杆菌干预有改善血脂水平的趋势(图2)。

图2 副干酪乳杆菌干预对血脂水平的影响Fig.2 The effect of Lactobacillus paracasei intervention on serum lipid levels
2.3 副干酪乳杆菌干预抑制动脉硬化进展的作用与糖代谢改变无关
经尾静脉检测ApoE-/-小鼠的禁食血糖、日常血糖及葡萄糖耐量试验结果表明,三组间的平均禁食血糖水平(F=0.393,P>0.05)、平均日常血糖水平(F=0.165,P>0.05)、葡萄糖耐量实验平均血糖水平(F=1.066,P>0.05)差异不具有统计学意义。提示:副干酪乳杆菌干预不影响ApoE-/-小鼠的糖代谢功能(图3)。

图3 副干酪乳杆菌干预对血糖的影响Fig.3 Effect of Lactobacillus paracasei intervention on glucose metabolism
2.4 副干酪乳杆菌干预抑制巨噬细胞和血管平滑肌细胞浸润
巨噬细胞的浸润和血管平滑肌细胞的迁移与增殖可进一步促进动脉血管局部的炎症反应而促进动脉粥样硬化斑块的进展。以F4/80抗体标记巨噬细胞,α-actin 抗体标记血管壁平滑肌细胞。主动脉窦组织免疫荧光染色结果显示,与对照组相比,模型组主动窦斑块内巨噬细胞浸润和血管平滑肌细胞浸润显著增加,而副干酪乳杆菌干预可以减少ApoE-/-小鼠动脉粥样硬化斑块中巨噬细胞和平滑肌细胞浸润(图4、5)。结果提示:副干酪乳杆菌干预可抑制高脂高胆固醇饮食诱导的动脉血管局部炎症反应。
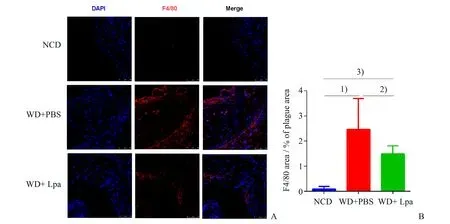
图4 副干酪乳杆菌干预对主动脉窦斑块内巨噬细胞浸润的影响Fig.4 The effect of Lactobacillus paracasei intervention on macrophages infiltration in aortic root plaque
图5 副干酪乳杆菌干预对主动脉窦斑块内平滑肌细胞浸润的影响Fig.5 The effect of Lactobacillus paracasei intervention on smooth muscle cells infiltration in aortic root plaque
2.5 副干酪乳杆菌干预抑制巨噬泡沫细胞的形成
经Bodipy493/503 染色结果表明,与正常饲料对照组相比,模型组小鼠的腹腔巨噬细胞脂质蓄积水平明显升高(P<0.000 1)。与模型组相比,副干酪乳杆菌干预组的腹腔巨噬细胞脂质蓄积程度明显降低(P<0.01)。正常饲料组与副干酪乳杆菌干预组的腹腔巨噬细胞脂质蓄积水平差异无统计学意义。结果提示,副干酪乳杆菌干预可抑制巨噬泡沫细胞的形成(图6)。

图6 副干酪乳杆菌干预对巨噬细胞脂质蓄积的影响Fig.6 The effect of Lactobacillus paracasei intervention on lipid accumulation of macrophages
2.6 副干酪乳杆菌干预降低巨噬细胞胆固醇吞噬
巨噬细胞主要通过吞噬ox-LDL 形成巨噬泡沫细胞,为进一步探究副干酪乳杆菌干预如何抑制巨噬泡沫细胞的形成,采用10 μg/mL Dil-ox-LDL 分别处理正常饲料对照组、模型组、副干酪乳杆菌干预组小鼠腹腔巨噬细胞6 h。实验结果如图7 所示,与模型组相比,副干酪乳杆菌干预能明显降低巨噬细胞对Dil-ox-LDL 的吞噬(P<0.01)。CD36和SR-A 是介导巨噬细胞胆固醇吞噬的主要受体蛋白,如图8 所示,与模型组相比,副干酪乳杆菌干预组小鼠腹腔巨噬细胞中SR-A 蛋白水平明显降低(P<0.05);而CD36的表达不受副干酪乳杆菌的影响。实验结果表明,副干酪乳杆菌干预可通过抑制SR-A受体蛋白的表达,减少巨噬细胞对胆固醇的吞噬。
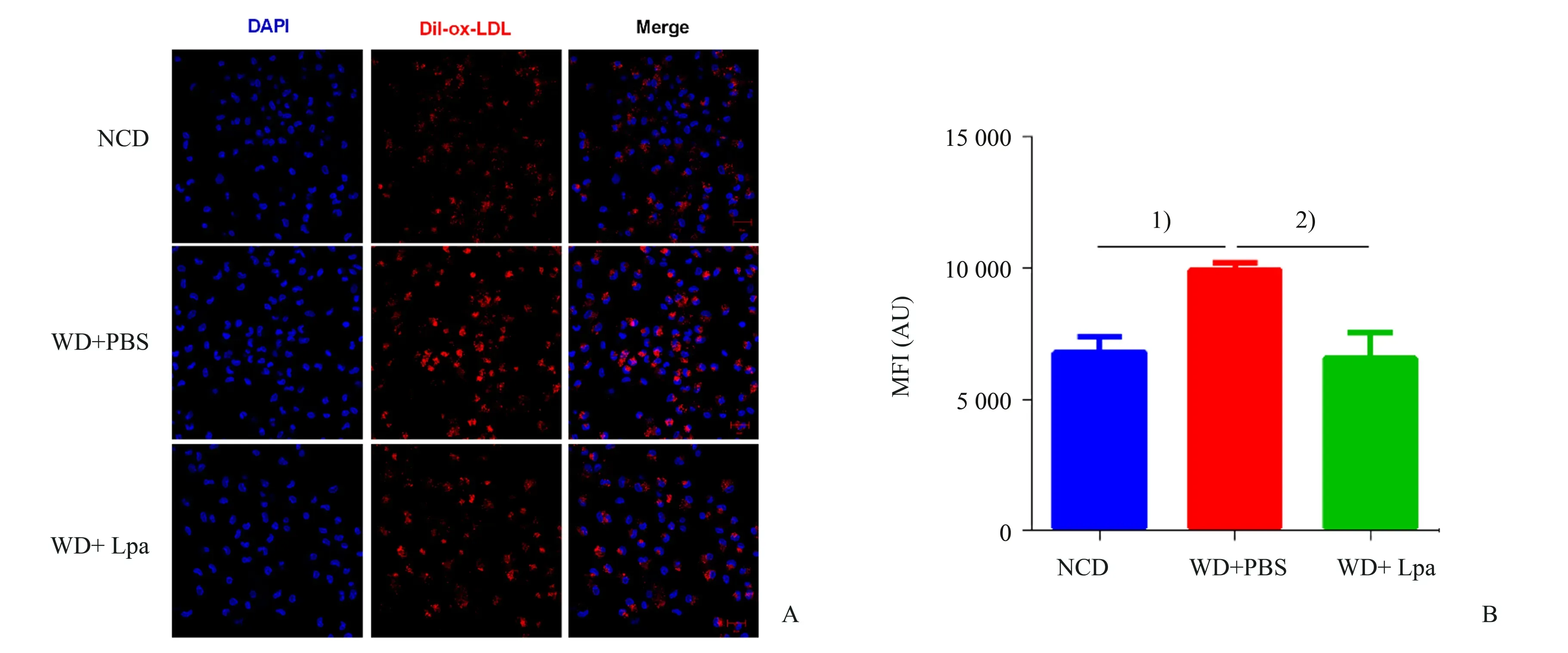
图7 副干酪乳杆菌干预对巨噬细胞胆固醇吞噬的影响Fig.7 The effect of Lactobacillus paracasei intervention on cholesterol uptake of macrophages

图8 副干酪乳杆菌干预对巨噬细胞胆固醇吞噬相关基因表达的影响Fig.8 The effects of Lactobacillus paracasei intervention on cholesterol uptake related gene expression of macrophages
2.7 副干酪乳杆菌抑制巨噬泡沫细胞形成的作用与胆固醇外流无关
副干酪乳杆菌干预对HDL 及Apo-AI 介导的胆固醇外流能力均无明显影响。ABCA1 和ABCG1是负责巨噬细胞胆固醇外流的主要转运蛋白,正常饲料组、模型组和副干酪乳杆菌干预组小鼠的腹腔巨噬细胞中ABCA1、ABCG1mRNA 表达水平差异均无统计学意义。结果提示,副干酪乳杆菌干预对巨噬细胞胆固醇外流能力及其相关蛋白的mRNA 表达均无明显影响(图9)。

图9 副干酪乳杆菌干预对巨噬细胞胆固醇外流及相关受体基因表达的影响Fig.9 Effects of Lactobacillus paracasei intervention on cholesterol efflux and expression of ABCA1 and ABCG1 mRNA of macrophages
3 讨论
本研究首次探明了副干酪乳杆菌干预能够有效抑制动脉斑块部位巨噬细胞的浸润、血管平滑肌的迁移与增生,减少巨噬细胞泡沫化,对动脉粥样硬化斑块形成及其所致的心血管疾病具有一定的预防和治疗作用。研究使用8 周龄的雄性ApoE-/-小鼠,高脂高胆固醇饲料喂养12 周,成功建立动脉粥样硬化模型。进一步的实验发现,副干酪乳杆菌有效抑制动脉粥样硬化的进展作用主要从以下3个方面来解释。首先,副干酪乳杆菌干预有效抑制小鼠动脉血管局部的炎症反应,从而抑制脉管系统中巨噬细胞的黏附聚集及血管平滑肌细胞的迁移与增生。其次,副干酪乳杆菌对小鼠巨噬细胞胆固醇吞噬相关的受体蛋白SR-A 具有一定的调控作用,抑制了巨噬细胞对胆固醇的吞噬,从而抑制了巨噬泡沫细胞的形成,减少巨噬细胞内脂质的蓄积。最后,副干酪乳杆菌干预能够改善小鼠的血脂谱。
副干酪乳杆菌广泛存在于人体肠道和口腔中,是一类常用于发酵乳制品和蔬菜制品的益生菌。既往的研究结果表明,副干酪乳杆菌可抑制脂多糖介导的肠道炎症反应,从而促进肠道黏膜修复及其功能恢复[14]。副干酪乳杆菌还能通过抑制炎症因子的产生,发挥其延缓系统性红斑狼疮所诱导的心血管疾病进展的作用[15]。此外,副干酪乳杆菌还可以抑制猪肺泡巨噬细胞胆固醇的蓄积,并且通过抑制猪肺泡中脂多糖介导的炎症反应,发挥保护肺泡正常功能的作用[16]。然而,副干酪乳杆菌对动脉粥样硬化的影响未见报道。本研究结果发现,副干酪乳杆菌干预有效抑制高脂高胆固醇诱导的ApoE-/-小鼠动脉粥样硬化斑块的形成,具有抗动脉粥样硬化的作用。
动脉粥样硬化是多因素共同参与的慢性炎症反应单核细胞来源的巨噬细胞在动脉粥样硬化发生发展的过程中发挥着重要的作用[17]。在动脉粥样硬化斑块形成的早期,动脉内皮细胞功能紊乱,释放多种细胞因子诱导单核细胞黏附聚集并分化为巨噬细胞。巨噬细胞的脂质代谢功能紊乱是形成泡沫细胞的主要原因,巨噬细胞额脂质代谢主要涉及在SR-A 及CD36 受体蛋白的介导下吞噬胆固醇及胆固醇酯与ABCA1、ABCG1 受体蛋白介导下的胆固醇外流[18-21]。当巨噬细胞吞噬胆固醇及胆固醇酯形成巨噬泡沫细胞后其迁移能力下降,聚集在动脉内膜损伤的部位。巨噬泡沫细胞凋亡所释放脂质和促炎因子又进一步促进脉管系统炎症的进展及脂质的蓄积,从而加速动脉粥样硬化斑块的形成[4]。在本研究中,动物实验结果证明,副干酪乳杆菌的干预有效减轻动脉斑块局部巨噬细胞的浸润、血管平滑肌细胞的浸润和增殖,抑制了动脉血管局部的炎症反应和巨噬泡沫细胞的形成,并降低了巨噬细胞SR-A 受体蛋白的表达,但副干酪乳杆菌干预不影响CD36受体蛋白的表达;其次,副干酪乳杆菌干预不影响HDL 及Apo-AI 所介导的胆固醇外流、胆固醇外流相关蛋白ABCA1 和ABCG1 mRNA 的表达。高脂血症及糖代谢紊乱是动脉粥样硬化的危险因素,进一步的实验结果显示,副干酪乳杆菌干预可降低血清LDL-c的水平,但不影响糖代谢。以上结果提示,副干酪乳杆菌可能通过抑制动脉血管局部的炎症反应及SR-A 所介导的胆固醇吞噬作用和调节脂质代谢,发挥抑制动脉粥样硬化进展的作用。
我们证实了副干酪乳杆菌可通过抑制血管局部的炎症反应、调节脂质代谢及SR-A 所介导的胆固醇吞噬作用,减少巨噬泡沫细胞的形成,延缓动脉粥样硬化的进展,为动脉粥样硬化性心血管疾病防治提供了新靶点。然而,SR-A 作为一种广泛分布的膜蛋白,可受到多种因素的调整。副干酪乳杆菌抑制SR-A表达的具体机制亟待进一步的探索。

